医药网4月1日讯 3月27日,国家药品监督管理局发布《国家药监局综合司关于进一步加强无菌和植入性医疗器械监督检查的通知》(下称《通知》),决定从生产、流通和使用三个环节对无菌和植入性医疗器械开展监督检查。
其中,生产环节上,由省级
药品监督管理部门组织对本行政区域无菌和植入性
医疗器械生产
企业开展监督检查。
流通和使用环节上则由市县级负责医疗器械监督管理的部门对经营企业和医疗机构开展监督检查。
《通知》显示,生产环节的检查重点包括:
(1)上一年度企业质量管理体系自查报告、监督管理部门抽验和检查发现的问题是否完成整改;
(2)企业法定代表人(企业负责人)、管理者代表及相关质量人员是否接受过
法规培训和考核;
(3)洁净室(区)的控制是否符合要求;
(4)生产设备、检验设备是否与所生产产品和规模相匹配;
(5)产品变更是否履行变更程序,特别是强制性标准实施后是否履行变更程序;
(6)
采购环节是否符合要求,是否对供应商进行审核评价,特别是一次性输注器具生产企业是否符合聚氯乙烯输液输血器具中荧光物质识别及定量补充检验方法的要求,是否对原材料进行控制;
(7)生产环节是否对特殊工序和关键过程进行了识别和有效控制;
(8)灭菌过程控制是否符合要求,尤其是产品的无菌性能和环氧乙烷残留量是否满足标准要求,有相应的检验或者验证记录;
(9)质量控制及产品放行是否符合强制性标准以及经注册的产品技术要求;
(10)是否建立与所生产产品相适应的医疗器械不良事件收集方法,是否及时收集医疗器械不良事件信息,对存在安全隐患的医疗器械,是否采取了召回等措施,并按规定向有关部门进行报告。
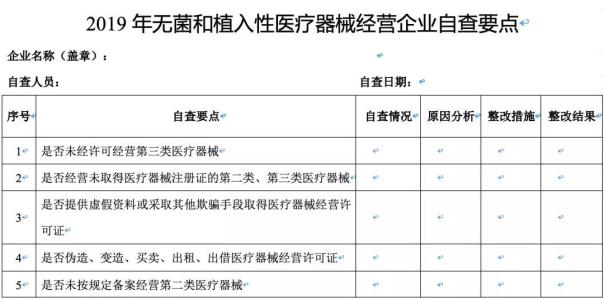
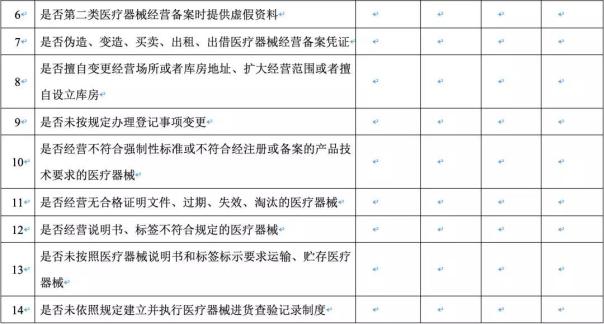
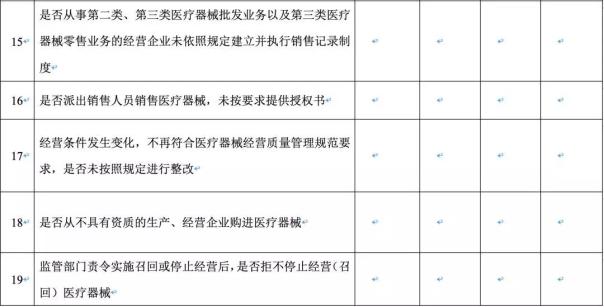
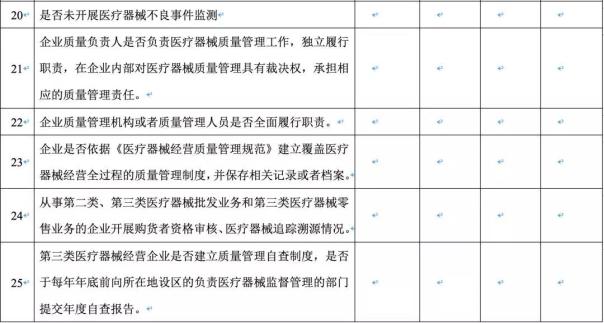
流通环节检查重点包括:
(1)是否未经许可(备案)从事经营(网络销售)医疗器械;
(2)是否经营(网络销售)未取得注册证或者备案凭证的医疗器械;
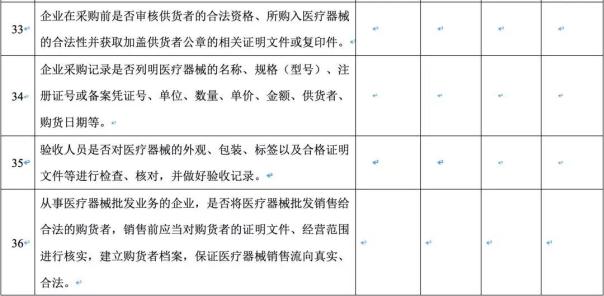
(3)购销渠道是否合法;
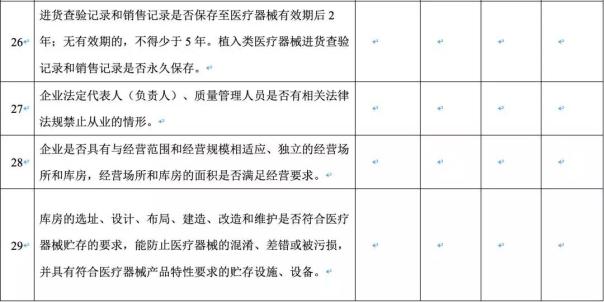
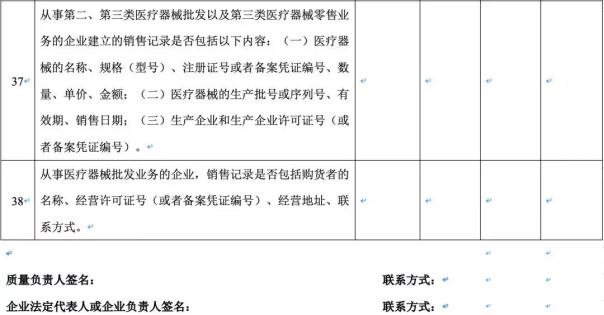
(4)进货查验记录和销售记录是否真实完整,相关信息是否能够追溯;
(5)是否经营无合格证明文件以及过期、失效、淘汰的医疗器械;
(6)运输、储存条件是否符合标签和说明书的标示要求,经营需冷链管理的医疗器械是否配备相适应的设施设备;
(7)是否履行医疗器械不良事件监测相关义务。
在医疗机构的使用环节上,检查重点则包括:
(1)是否购进、使用未依法注册或者备案、无合格证明文件以及过期、失效、淘汰的医疗器械;
(2)是否建立覆盖质量管理全过程的使用质量管理制度;
(3)是否严格查验供货商资质和产品证明文件;
(4)对无菌和植入类医疗器械是否建立并执行使用前质量检查制度;
(5)是否对植入和介入类的医疗器械建立使用记录,植入性医疗器械使用记录是否永久保存,相关资料是否纳入信息化管理系统,相关信息是否能够追溯;
(6)储存条件是否符合标签和说明书的标示要求,对需冷链管理的医疗器械是否配备相适应的设施设备;
(7)是否履行医疗器械不良事件监测相关义务。
《通知》要求,无菌和植入性医疗器械的生产经营企业和使用单位要全面开展自查,5月底前,生产企业自查表上报所在地省级药品监督管理部门,经营企业自查表上报所在地市县级负责医疗器械监督管理的部门,医疗机构自查表上报所在地市级负责医疗器械监督管理的部门。
同时,各省级药品监督管理部门应当针对企业自查情况组织对本行政区域无菌和植入性医疗器械生产企业开展全面检查,特别是对重点检查项目的检查,督促企业认真进行自查并及时完成整改。
各市县级负责医疗器械监督管理的部门要抽取不少于15%的本行政区域经营无菌和植入性医疗器械企业和医疗机构开展经营使用环节的监督检查。对未提交自查报告和自查报告弄虚作假的企业和医疗机构,应当严格监管,对于存在违法违规行为的从重处罚。
最后要求,各省级药品监督管理部门于2019年12月10日前将监督检查总结报告的电子版和纸质版报送国家局。总结报告应当包括对本行政区域内医疗器械生产、经营和使用环节检查情况、检查发现的主要问题、处理措施、相关意见和建议等。
附:2019年无菌和植入性医疗器械经营企业自查要点