发布时间:2018年12月24日 15:57:03 来源:振东健康网
一、概述
淋巴瘤(lyphoma)是我国最常见的恶性肿瘤之一。根据国家癌症中心公布的数据,2014年我国淋巴瘤的确诊发病率为5.94/10万,2015年预计发病率约为6.89/10万。由于淋巴瘤病理类型复杂,治疗原则各有不同,为进一步提高淋巴瘤诊疗能力和规范化水平,配合抗肿瘤药品供应保障有关政策调整,保障医疗质量与安全,现对《中国恶性淋巴瘤诊疗规范(2015年版)》进行修订和更新。
二、淋巴瘤的诊断
应当结合患者的临床表现、体格检查、实验室检查、影像学检查和病理学等进行诊断。
(一)临床表现
淋巴瘤的症状包括全身和局部症状。全身症状包括不明原因的发热、盗汗、体重下降、皮肤瘙痒和乏力等。局部症状取决于病变不同的原发和受侵部位,淋巴瘤可以原发于身体的任何器官和组织,通常分为原发于淋巴结和淋巴结外两大类。最常见表现为无痛性的进行性淋巴结肿大。如有以上述症状的患者在基层医院就诊时,应予以重视,并尽早转诊至上级医院或肿瘤专科医院。
(二)体格检查
应特别注意不同区域的淋巴结是否增大、肝脾的大小、伴随体征和一般状态等。
(三)实验室检查
应完成的实验室检查包括血常规、肝肾功能、乳酸脱氢酶(lactate dehydrogenase,LDH)、β2微球蛋白、红细胞沉降率、乙型肝炎和丙型肝炎病毒检测以及骨髓穿刺细胞学和活检等,还应包括人类免疫缺陷病毒(human immunodeficiency virus,HIV)筛查在内的相关感染性筛查。对原发胃的黏膜相关边缘带B细胞淋巴瘤,应常规进行幽门螺杆菌(helicobacter pylori,Hp)染色检查;对NK/T细胞淋巴瘤患者,应进行外周血EB病毒DNA滴度检测。对于存在中枢神经系统受累风险的患者应进行腰穿,予以脑脊液生化、常规和细胞学等检查。
(四)影像学检查
常用的影像检查方法:计算机断层扫描(computed tomography,CT)、核磁共振(nuclear magnetic resonance,MRI)、正电子发射计算机断层显像(positron emission tomography,PET-CT)、超声和内镜等。
1. CT:目前仍作为淋巴瘤分期、再分期、疗效评价和随诊的最常用影像学检查方法,对于无碘对比剂禁忌证的患者,应尽可能采用增强CT扫描。
2. MRI:对于中枢神经系统、骨髓和肌肉部位的病变应首选MRI检查;对于肝、脾、肾脏、子宫等实质器官病变可以选择或者首选MRI检查,尤其对于不宜行增强CT扫描者,或者作为CT发现可疑病变后的进一步检查。
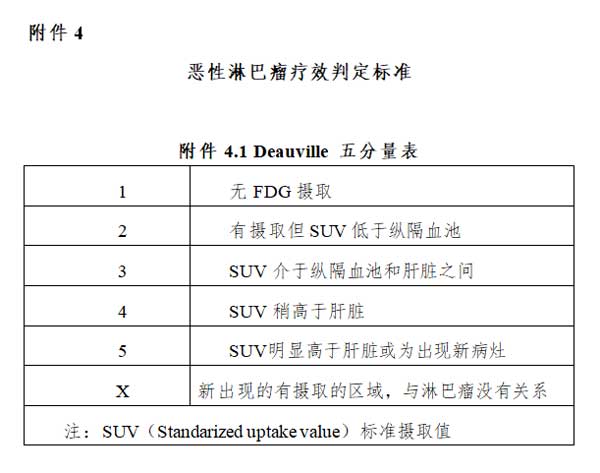
3. PET-CT:目前是除惰性淋巴瘤外,淋巴瘤分期与再分期、疗效评价和预后预测的最佳检查方法。对于
下列情况,有条件者推荐使用PET-CT:①PET-CT可作为霍奇金淋巴瘤(Hodgkin lymphoma,HL)以及 氟脱氧葡萄糖(fluorodeoxyglucose,FDG)亲和性高的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)亚型治疗前分期以及再分期的常规检查,并用Deauville五分量表(表1)评估病变缓解情况。但对于FDG亲和性差的淋巴瘤亚型(如惰性淋巴瘤),治疗前的分期检查仍以增强CT扫描为首选。②如果有影像学的临床指征,PET-CT 可用于治疗中期疗效评价,但仍处于临床研究阶段,故根据中期PET-CT结果更改治疗方案仍须慎重。③对于HL和多数弥漫性大B细胞淋巴瘤(Diffuse large B cell lymphoma,DLBCL),如果PET-CT提示有明确的骨髓受累,则无需行骨髓活检。④PET-CT可以作为惰性淋巴瘤向侵袭性更强的病理类型转化时活检部位选择的依据。⑤PET-CT对于疗效和预后预测好于其他方法,可以选择性使用。
4. 超声:可用于浅表淋巴结和浅表器官(如睾丸、甲状腺、乳腺等)病变的诊断和随诊,但一般不用于淋巴瘤的分期诊断。对于浅表淋巴结和浅表器官(如睾丸、乳腺等)病变的诊断和治疗后随诊具有优势,可以常规使用;对于腹部、盆腔淋巴结检查可以选择性使用;对于肝、脾、肾、子宫等腹盆腔实质性器官的评估,可以作为CT和MRI的补充,尤其是不能行增强CT扫描时。在浅表淋巴结切除活检时,选取超声检测声像图异常的淋巴结,有助于提高活检的准确度。超声引导下穿刺活检也应用于深部淋巴结、肝脏、纵隔等部位的病变诊断。
5. 同位素骨扫描:淋巴瘤骨受侵患者的全身骨显像缺乏特征性改变,难以与骨转移瘤、多发性骨髓瘤、骨结核、骨纤维异常增殖症、甲状旁腺功能亢进、感染性疾病等鉴别,需要结合患者的病史、实验室检查和其他影像学检查。
常规骨扫描(99Tcm-MDP)对初治HL患者的临床评估价值有限,但骨扫描对原发骨淋巴瘤治疗后随访观察和预后评估作用优于CT。
(五)其他针对性检查
(1)可疑胃肠道受侵的患者应行胃镜、肠镜检查。
(2)常规进行心电图检查;有心血管基础疾病、高龄或拟应用蒽环类药物者选择性进行超声心动图检查。
(3)拟用博来霉素、且有肺基础病变者应进行肺功能检查。
(六)病理学检查
病理学检查是淋巴瘤诊断的主要手段。对于淋巴结病灶,应尽可能切除完整淋巴结。如果淋巴结病灶位于浅表,应尽量选择颈部、锁骨上和腋窝淋巴结。空芯针穿刺仅用于无法有效、安全地获得切除或切取病变组织的患者。初次诊断时,应首选切除或切取病变组织;对于复发患者,如果无法获得切除或切取的病变组织标本,可通过空芯针穿刺获取的病变组织进行病理诊断。
淋巴瘤的病理诊断需综合应用形态学、免疫组织化学(Immunohistochemistry,IHC)、遗传学和分子生物学技术以及流式细胞术等,尚无一种方法可以单独定义为“金标准”。
1.形态学:在淋巴瘤病理诊断中非常重要,不同类型的淋巴瘤具有特征性和诊断性的形态学特点。
2.IHC:可用于鉴别淋巴瘤细胞的免疫表型,如B或T/NK细胞、肿瘤细胞的分化及成熟程度等。通过组合相关的IHC标记物,进行不同病理亚型的鉴别诊断。
3.荧光原位杂交(fluorescence in situ hybridization,FISH)检测技术:可以发现特定的染色体断裂、易位或扩增等,对特定染色体异常相关淋巴瘤的辅助诊断有指导意义,如Burkitt 淋巴瘤相关的t(8;14)易位、滤泡性淋巴瘤相关的t(14;18)易位、结外黏膜相关淋巴组织边缘区淋巴瘤相关的t(11;18)易位、套细胞淋巴瘤相关的t(11;14)易位以及双打击或三打击高级别B细胞淋巴瘤相关的MYC(8q24)、BCL2(18q21)和BCL-6(3q27)重排等。
4.淋巴细胞抗原受体基因重排检测技术:淋巴细胞受体基因单克隆性重排是淋巴瘤细胞的主要特征,可用于协助鉴别淋巴细胞增殖的单克隆性与多克隆性,以及无法通过IHC诊断的淋巴瘤,是对形态学和IHC检查的重要补充。
5.其他:包括原位杂交、二代测序(Next-generation sequencing,NGS)、流式细胞技术等,是常规病理学诊断方法的有益补充。
随着新检测方法的出现,淋巴瘤的病理诊断也随病理研究的深入,出现新的改变。在2017年修订版WHO淋巴瘤分类中,间变大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)分为ALK 阳性ALCL、ALK 阴性ALCL和乳房植入相关的ALCL。ALK阴性ALCL的部分患者存在融合性突变,其中存在6p25染色体DUSP22和IRF4 重排的患者预后好,存在TP63重排的患者预后差;而血管免疫母细胞T细胞淋巴瘤(angioimmunoblastic T-cell lymphoma,AITL)与具有滤泡辅助性T细胞(follicular helper T cells,TFH)表型的结内外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL),则被认为应归为一类。
三、淋巴瘤的分期
2014版Lugano会议对Ann-Arbor 分期系统进行了修订,适用于HL和原发淋巴结的NHL,而对于某些原发淋巴结外的NHL,如慢性淋巴细胞白血病、皮肤T细胞淋巴瘤、原发结外鼻型NK/T细胞淋巴瘤和原发胃、肠道、中枢神经系统淋巴瘤等,则难以适用,这些原发于特殊结外器官和部位的NHL,通常有其专属的分期系统。
四、淋巴瘤放射治疗
放射治疗是淋巴瘤综合治疗的重要组成部分,实施中如何选择放疗线束、射野和剂量,由具体病例的治疗目的和诊疗条件决定。可采用光子、电子和质子等射线束以达到对靶区的合理涵盖及正常组织的最大保护。复杂放疗技术如调强适形放疗(intensity modulated radiation therapy,IMRT)、屏气和呼吸门控、影像引导、甚至质子治疗,可在特定情况下,特别是在以治愈为目的预期生存期较长的患者中,显著提高临床获益,予以酌情推荐。
根据放疗目的和作用,淋巴瘤放射治疗的适应证分为:①根治性治疗;② 综合治疗的一部分;③ 化疗不能耐受或抗拒、残存病灶的挽救治疗;④姑息治疗。
放疗设野分为:全淋巴照射(total lymphoid irradiation,TLI)和次全淋巴照射(sub-Total lymphoid irradiation,STLI)。TLI通常包括斗篷野+锄形野+盆腔野(在未行脾切除的病例中还需要进行脾照射),STLI可以省略部分受照区域,目前已不再用于HL综合治疗中。受累野照射(Involved field radiotherapy,IFRT)仅照射化疗前受累淋巴结的整个淋巴结区域,受累野范围包括所有已知肿瘤的部位和临近区域;随着影像诊断和适形放疗技术的发展,IFRT在HL和侵袭性淋巴瘤中,被更精准的累及淋巴结(involved-node radiotherapy ,INRT)或累及部位照射(involved-site radiotherapy ,ISRT)所替代。
附:
INRT:化疗前充分对肿瘤进行评估,在放射治疗体位下行PET-CT检查,并融合至化疗后放疗的定位CT中,准确照射所有化疗前大体肿瘤位置,即为INRT。该定义强调:一是射野就是化疗前大体肿瘤体积(Gross-tumor volume,GTV)的范围,二是必须有化疗前精确的治疗体位下的PET-CT评估。
ISRT:无法获取化疗前治疗体位下的PET影像时,可以通过适度增大射野来涵盖治疗中的不确定性因素。参考化疗前后的影像学信息,勾画出化疗前肿瘤位置,并外放一定边界对不确定性予以补偿。
ISRT靶区定义与勾画:
ISRT结内病变:目前ISRT作为化疗敏感的NHL和HL标准靶区勾画方法。计划需要以CT模拟为基础,融合其他现代显像手段如PET和MRI。ISRT的靶区主要目的是包括初诊时累及的淋巴结。射野包全化疗前或手术前最初的所有受累区域,但排除临近的正常组织,比如肺、骨、肌肉、肾脏等。化疗前或活检前GTV是勾画临床靶区(Clinical Target Volume,CTV)的基础。出于对存在疑问的亚临床病灶和对原始肿瘤显像准确性的考虑,可以在设置CTV时,基于临床判断适当扩充边界。对于惰性NHL,采用单纯放疗时,倾向采用扩大照射野。例如,FL的射野应该较同样受累时的DLBCL化疗后的射野更大。照射时在CTV基础上充分考虑器官运动形成的内靶区(internal target volume,ITV),之后形成计划靶区(planning target volume,PTV)。
ISRT结外病变:结外病变的射野原则与结内病变类似。但在某些结外器官原发病变中,CTV需要包括整个器官,如眼、乳腺、胃、唾液腺和甲状腺。在其他的结外器官中,如肺、骨和皮肤等,可考虑部分器官照射。多数情况下,不需进行未受累淋巴结的预防照射。
放疗剂量:HL的根治剂量为36~40 Gy,化疗后达晚期缓解(complete remission,CR)(亚临床病灶)20~30 Gy。低度恶性NHL的根治性照射剂量为24~30 Gy,DLBCL化疗CR后巩固性放疗30~40 Gy,PR后的巩固剂量为40~50 Gy。结外鼻型NK/T细胞淋巴瘤(Extranodal NK/T-cell lymphoma,nasal type,ENKTL)的根治照射剂量为50~56 Gy。
五、淋巴瘤综合治疗总论
作为一组临床特点不尽相同、诊断标准与治疗方式各异的恶性肿瘤,在诊断时,需明确淋巴瘤患者的病理亚型和预后不良的分子病理改变,通过相关影像诊断技术明确患者分期,综合临床表现和实验室检查,根据各自的预后风险的评判标准,判断其预后;选择包括合理的内科治疗手段(化疗、靶向治疗和(或)生物免疫治疗等)、放疗及必要的手术治疗等,进行综合治疗。以期最大限度地实现临床治愈或疾病长期无进展生存,最大限度地改善患者的生活质量。
六、淋巴瘤的中医药治疗
淋巴瘤常见中医证型虚实夹杂,多为两种或多种证候要素组成的复合证候;可分为气虚、阴虚、血虚、痰湿、血瘀、气滞等六种证候;目前中医治疗淋巴瘤主要在减轻内科治疗和放疗后的不良反应,改善食欲、体力及免疫低下等方面发挥辅助治疗的作用,对于终末期患者起支持治疗的作用。
适应人群:内科治疗及放疗期间、治疗后恢复期及晚期患者。
治疗方法:口服汤药、中成药、中成药制剂及外敷、针灸等其他中医疗法。
七、常见淋巴瘤病理类型的临床特点、诊断与治疗
(一)霍奇金淋巴瘤(HL)
HL是一种独特的淋巴系统恶性疾病,男性多于女性,男女之比为1.4∶1~1.3∶1。其发病年龄在欧美发达国家呈较典型的双峰分布,分别在15~39岁和50岁以后;而包括中国在内的东亚地区,发病年龄多在30~40岁,呈单峰分布。
1. 临床表现:90%的HL以淋巴结肿大为首发症状,多起始于一组受累的淋巴结,以颈部和纵隔淋巴结最常见,随着病情进展可逐渐扩散到其他淋巴结区域,晚期可累及脾、肝、骨髓等。患者初诊时多无明显全身症状,20%~30%的患者可伴有B症状,包括不明原因的发热、盗汗和体重减轻,还可以有瘙痒、乏力等症状。
2. 病理分类及诊断:根据2017年修订版WHO淋巴瘤分类,HL分为经典型和结节性淋巴细胞为主型两大类型,经典型HL(Classic Hodgkin lymphoma,cHL)可分为4种组织学亚型,即结节硬化型、富于淋巴细胞型、混合细胞型和淋巴细胞消减型;结节性淋巴细胞为主型少见,约占HL的10%。
HL起源于生发中心的B淋巴细胞,形态学特征表现为正常组织结构破坏,在混合性细胞背景中散在异型大细胞,如Reed–Sternberg(R-S)细胞及变异型R-S细胞。典型R-S细胞为双核或多核巨细胞,核仁嗜酸性,大而明显,细胞质丰富;若细胞表现为对称的双核时则称为镜影细胞。结节性淋巴细胞为主型HL中的肿瘤细胞为淋巴细胞为主型(lymphocyte predominant,LP)细胞,过去称为淋巴细胞和组织细胞(lymphocytic-histocytic cell,L-H细胞),细胞核大、折叠,似‘爆米花样’,故又称为爆米花(popcorn)细胞,其核仁小、多个、嗜碱性。LP被PD-1阳性的T细胞环绕。越来越多的证据提示完全呈弥漫生长的结节性淋巴细胞为主型霍奇金淋巴瘤(Hodgkin lymphoma nodular lymphocytic predominance type,NLPHL)和富于T细胞/组织细胞的大B细胞淋巴瘤重叠。
诊断HL应常规检测的IHC标记物包括CD45(LCA)、 CD20、CD15、CD30、PAX5、CD3、MUM1、Ki-67和EBV-EBER。cHL常表现为CD30(+)、CD15(+)或(-)、PAX5 弱(+)、MUM1(+)、CD45(-)、CD20(-)或弱(+)、CD3(-),BOB1(-)、OCT2(-/+)、部分病例EBV-EBER(+)。NLPHL为CD20(+)、 CD79ɑ(+)、BCL6(+)、CD45(+)、CD3(-)、CD15(-)、CD30(-)、BOB1(+)、)OCT2(+)、EBV-EBER(-)。在进行鉴别诊断时需增加相应的标记物,以鉴别ALCL或DLBCL等。治疗和预后相关的标志物包括PD-1、PD-L1和P53等。
骨髓细胞学检查显示骨髓有核细胞增生活跃或明显活跃,部分病例嗜酸粒细胞增多。若肿瘤细胞骨髓漫润,可找见本病特征性的R-S细胞。骨髓穿刺细胞学涂片找到R-S细胞阳性率较低,仅3%左右;骨髓活检可提高到9%~22%。如有混合性细胞增生,小淋巴细胞明显,呈流水样结构,提示有cHL的可能,要引起注意。
3. 治疗原则
(1)NLPHL:①IA/IIA期(无大肿块):观察或局部放疗。②IB/IIB期和IA/IIA期(有大肿块):局部放疗 ±化疗±利妥昔单抗治疗。③III/IV期:化疗 ± 利妥昔单抗 ± 局部放疗。
一线化疗方案可选择ABVD方案(多柔比星+博来霉素+长春花碱+达卡巴嗪)、CHOP方案(环磷酰胺+多柔比星+长春新碱+泼尼松)、CVP方案(环磷酰胺+长春新碱+泼尼松)等 ± 利妥昔单抗治疗。
(2)cHL:①I和II期:化疗2~6周期 + IFRT或ISRT。其中预后良好的早期HL,ABVD方案化疗2~3周期,序贯IFRT或ISRT 20-30Gy,未达CR的患者可适当提高照射剂量;如化疗后PET-CT评价代谢完全缓解(Complete metabolic response,CMR)的患者,如不选择ISRT,需要延长化疗至6周期。预后不良组中不具有巨块的早期HL,ABVD方案化疗4周期后,序贯30Gy IFRT;如在ABVD方案化疗2周期后接受PET-CT复查,且评价为阳性(未达CMR)的患者,建议序贯BEACOPPesc方案2周期及30-36GyIFRT或INRT;具有纵隔巨块、淋巴结直径>5cm或存在B症状的早期预后不良的HL,ABVD方案化疗4~6周期,序贯IFRT,未达CR的患者可适当提高照射剂量;或选择BEACOPPesc方案化疗2周期,序贯ABVD方案2周期和IFRT。②III和IV期:可以选择ABVD方案化疗8周期,未达CR或有大肿块的患者,行IFRT;或选择6周期BEACOPPesc方案化疗,化疗后PET-CT评价未达CMR的患者,序贯IFRT。对于>60岁的老年患者,可选用不含博来霉素方案(如AVD)治疗。
初治患者的一线化疗方案包括ABVD方案、Stanford V方案(多柔比星+长春花碱+氮芥+长春新碱+博来霉素+足叶乙苷+泼尼松,每周给药)或BEACOPPesc方案(足叶乙苷+多柔比星+环磷酰胺+长春新碱+博来霉素+泼尼松+甲基苄肼)方案。复发/难治患者接受二线治疗方案包括DHAP方案(地塞米松+高剂量阿糖胞苷+顺铂)、DICE方案(地塞米松+异环磷酰胺+顺铂+足叶乙苷)、ESHAP方案(足叶乙苷+甲强龙+高剂量阿糖胞苷+顺铂)、GDP方案(吉西他滨+顺铂+地塞米松)、GVD方案(吉西他滨+长春瑞滨+脂质体多柔比星)、ICE方案(异环磷酰胺+卡铂+足叶乙苷)、IGEV(异环磷酰胺+吉西他滨+长春瑞滨)、miniBEAM方案(卡氮芥+足叶乙苷+阿糖胞苷+米尔法兰)和MINE方案(美司那+异环磷酰胺+米托蒽醌+足叶乙苷)等。对于一般状态好的年轻患者,解救治疗缓解后,应该选择高剂量化疗联合自体造血干细胞移植(High dose chemotherapy with autologous hematopoietic stem cell transplantation,HDC/AHSCT)作为巩固治疗,对于初治时未曾放疗的部位,也可放疗。对于复发/难治患者可以选择程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)单抗作为解救治疗。对于CD30阳性的复发/难治患者,可选择CD30单抗(brentuximab vedotin,BV)。
4.HL预后因素(见附件3.1)
(1)初治早期HL的不良预后因素:不同研究组关于早期HL的不良预后因素略有不同。
(2)晚期HL的不良预后因素:国际预后评分(international prognostic score,IPS):①白蛋白< 40g/L;②血红蛋白< 105g/L;③男性;④年龄≥ 45岁;⑤Ⅳ期病变;⑥白细胞增多,≥ 15×109/L;⑦淋巴细胞减少,占白细胞比例< 8%和(或)计数< 0.6×109/L。
(3)早期PET-CT评估结果:无论诊断时分期早晚,化疗2~3周期后进行PET-CT评估,结果为阴性的患者,预后明显优于阳性患者。
(二)非霍奇金淋巴瘤(NHL)
1.弥漫大B细胞淋巴瘤(DLBCL)
DLBCL是 NHL中最常见的类型,在欧美地区占成人NHL的30%~40%,我国约占35%~50%。
(1)临床表现:DLBCL中位发病年龄为50~60岁,男性略多于女性。DLBCL临床表现多样,依据原发部位和病变严重程度而不同,初起时多表现为无痛性淋巴结肿大,但淋巴结外的病变比例可达40%~60%,可以原发于任何淋巴结外组织器官。临床病程呈侵袭性,表现为迅速增大的肿物。约1/3的患者伴有B症状,半数以上患者LDH升高。约50%的患者初诊时为III-IV期。
(2)病理诊断及分类:DLBCL的主要病理特征是体积较大的异常淋巴样细胞弥漫性生长,破坏正常淋巴结结构。DLBCL包括多种变异型和亚型(见附件1)。
诊断DLBCL常规IHC标记物包括CD19、CD20、PAX5、CD3、CD5、CD79α、CyclinD1、Ki-67;通常表现为CD19(+)、CD20(+)、PAX5(+)、CD3(-)。DLBCL诊断后,为进一步探讨肿瘤细胞起源(生发中心或非生发中心),可以选择Han’s分类(CD10、BCL-6、MUM-1)或Choi分类(GCET1、FOXP1、CD10、BCL-6、MUM-1),也可以增加CD30、CD138、ALK等进行鉴别诊断;建议所有DLBCL患者常规检测EBER,以鉴别EBV阳性DLBCL(非特指型)。建议所有DLBCL患者常规检测BCL-2、BCL-6、C-MYC免疫组化,如果表达强且广泛,Ki-67指数>80%阳性,尤其是生发中心细胞型,最好再增加相应的FISH检测,以鉴别伴MYC、BCL2和(或)BCL6重排的高级别B细胞淋巴瘤。如果没有条件做FISH检测,要评价MYC蛋白(40%为界值),BCL-2(>50%界值),称双表达(Double express,DE)淋巴瘤,提示预后不良。 另外预后和治疗的相关指标还包括PD-1、PD-L1和P53等。
骨髓细胞学:当DLBCL骨髓侵润时,可见到瘤细胞胞体较大,染色质粗糙,核仁多个、但不明显,胞质灰蓝色、有少量空泡。
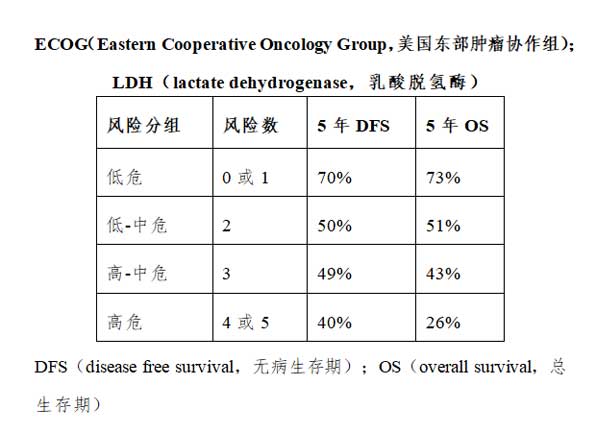
(3)预后指标:国际预后指数(International Prognostic Index,IPI)是目前国际上常用的DLBCL预后评分系统[26]。此系统依据5个独立的不良预后因素,即年龄>60岁、Ⅲ~Ⅳ期、结外累及部位数目>1、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)行为状态(performance status,PS)评分≥2、血清LDH水平>正常上限,每一个不良预后因素为1分。 0~1分为低危组;2分为低中危组;3分为高中危组;4~5分为高危组。对于应用利妥昔单抗治疗的患者,可以采用修正的IPI预后指数(Revised IPI,R-IPI),此系统包含与IPI相同的5个独立不良预后因素,每一个不良预后因素为1分。0分为预后非常好;1~2分为预后好;3~5分为预后差。对于年龄≤60岁的患者,可以采用年龄调整的IPI预后指数(Age adjusted IPI,aaIPI),aaIPI有3个不良预后因素,包括:分期III~IV期、血清LDH水平>正常上限和ECOG PS评分≥2,其中0分为低危、1分为中低危、2分为中高危、3分为高危。近年来在IPI基础上将年龄和LDH进一步分层形成的NCCN-IPI预后系统,更能准确预测患者预后。NCCN-IPI也由上述5种不良预后因素构成,但年龄分为3个组,年龄>40岁而≤60岁,积1分,年龄>60岁而≤75岁,积2分,年龄>75岁,积3分;血清LDH水平分两组,>1倍至≤3倍,积1分,>3倍,积2分;结外受累定义为骨髓、中枢神经系统、肝脏、消化道或肺的受累;ECOG评分≥2分;分期III-IV期。最高积8分,NCCN-IPI评分0~1分为低危组;评分2~3分为低中危组;评分3~4分为高中危组;评分≥6分为高危组(见附件3.2)。
(4)治疗原则:DLBCL的治疗原则是以内科治疗为主的多学科综合治疗。内科治疗包括化疗和免疫治疗。治疗策略应根据年龄、IPI评分和分期等因素而定。对高肿瘤负荷患者,可以在正规化疗开始前给予一个小剂量的诱导治疗,药物包括泼尼松±长春新碱,以避免肿瘤溶解综合征的发生。对乙型肝炎病毒(Hepatitis B virus,HBV)携带或感染患者,应密切监测外周血HBV-DNA滴度,并选择适当的抗病毒治疗。
①I和II期DLBCL的初始治疗:对I和II期无大肿块患者,可以选择R-CHOP方案化疗3~4周期 + 放疗,或R-CHOP方案化疗6周期 ± 放疗。对I和II期有大肿块患者,可以选择R-CHOP方案6~8周期 ± 放疗。
②III和IV期患者的初始治疗 :可选择参加临床试验,或进行R-CHOP 方案化疗6~8个周期。可选择治疗开始前和治疗结束时进行PET-CT检查,根据其结果制定和调整治疗方案。化疗后未达CR的患者,针对残存病灶行ISRT。初治患者化疗后疗效评价CR或未确认的完全缓解(Uncomfirmed Complete remission,CRu),放疗30~40Gy,部分缓解(Partial Response,PR)患者,放疗40~50Gy。
③年龄超过 80 岁的虚弱患者:初始治疗可以选择R-miniCHOP方案。左室功能不全的患者初始治疗可以选择RCEPP方案、RCDOP方案、DA-EPOCH-R方案、RCEOP方案和RGCVP方案。
④中枢神经系统(Central nervous system ,CNS)预防:伴有 4~6 个CNS受侵的危险因素的患者(危险因素包括:年龄 > 60 岁、 LDH 升高、 III 期或 IV期、 ECOG PS > 1、结外病变 > 1、肾或肾上腺受累)、病变累及鼻旁窦、椎旁,HIV 相关淋巴瘤、 原发睾丸和乳腺的DLBCL ,发生CNS受侵的风险可能会增加,应考虑中枢神经系统预防。预防的方法存在争议,可采用鞘内注射4 ~ 8 剂的甲氨蝶呤和(或)阿糖胞苷,或全身应用 3 ~ 3.5 g/m2甲氨蝶呤进行预防性治疗。
⑤一线巩固治疗:治疗后达到CR的年轻高危患者可以考虑进行HDC/AHSCT。
⑥解救治疗:对适合HDC/AHSCT的患者,可采用的解救化疗方案包括:DICE方案、DHAP方案、ESHAP方案、GDP方案、ICE方案和MINE方案。先用解救化疗方案 ± 利妥昔单抗进行诱导治疗,缓解后行HDC/AHSCT。对不适合HDC/AHSCT的患者,可采用的解救治疗方案包括:苯达莫司汀单药、CEPP方案、CEOP方案、DA-EPOCH方案、GDP方案、GemOx方案;以上方案可联合利妥昔单抗。也可采用利妥昔单抗单药或姑息性放疗。部分患者仅能接受最佳支持治疗。合适的患者也可考虑行异基因造血干细胞移植治疗。
(5)特殊原发部位DLBCL
1)原发中枢神经系统DLBCL:是指原发于脑内或眼内的DLBCL,不包括硬脑膜淋巴瘤、血管内大B细胞淋巴瘤、淋巴瘤继发中枢神经系统受侵及免疫缺陷相关淋巴瘤。原发中枢神经系统DLBCL不足NHL的1%,约占原发脑肿瘤的2%~3%。中位发病年龄约为60岁,男性略多于女性。
①临床表现:50%~80%的患者出现局灶性症状,常伴有精神和反应水平的改变;由于颅内压升高可引起恶心、呕吐、头痛等症状。软脑膜病变可导致头痛和非对称性颅神经功能异常。眼内淋巴瘤表现为视力模糊、视野缺损等。
②诊断:影像学上表现为中枢神经系统的结节或肿物。MRI是首选的检查方法,可见病灶在T1加权像呈低信号或等信号,T2加权像呈高信号,常伴有水肿。病理学检查仍为确诊本病所必需,可通过立体定向穿刺活检或开颅活检取得。在无法取得肿瘤组织活检时,脑脊液细胞学检查阳性也可接受,脑脊液流式细胞分析可作为辅助性诊断手段。需与本病鉴别的疾病包括脱髓鞘疾病、亚急性梗死及感染所致的颅内占位性病变、脑胶质瘤和转移瘤。尤其应注意鉴别影像学表现与本病相似和激素治疗有效的疾病,如多发性硬化和神经系统结节病。
原发中枢神经系统DLBCL的血管周围浸润更为明显,肿瘤细胞形态多类似生发中心母细胞,基本上起源于非生发中心B细胞,Ki-67阳性细胞比例常超过90%。病理诊断时免疫组化检查抗体选择与DLBCL相同。
③治疗原则:本病的治疗以内科治疗为主。皮质激素类药物可以迅速缓解症状,但若未经化疗或放疗,肿瘤多在短期内复发。在活检前,不推荐使用皮质激素类药物,但颅内高压危及生命时除外。化疗是最主要的治疗,选用药物的原则是能透过血脑屏障。首选的化疗方案为包含高剂量甲氨蝶呤的方案,可联合利妥昔单抗,能够有效延长患者生存时间。一线治疗达到CR/CRu的患者可进行巩固治疗,包括HDC/AHSCT、高剂量阿糖胞苷+/-足叶乙苷。化疗抗拒或未达CR患者建议放疗。复发耐药的患者可选择高剂量甲氨蝶呤±利妥昔单抗方案(缓解期≥12个月)、替莫唑胺±利妥昔单抗方案、包含高剂量阿糖胞苷的方案、拓扑替康单药、培美曲塞单药等,解救治疗有效患者可考虑HDC/AHSCT。
放疗可有效缩小肿瘤,缓解症状,与单纯支持治疗比较,可延长患者生存时间。放疗方法一般是全脑照射+局部肿瘤区照射。但单纯放疗复发率高,且可造成一定神经毒性,因此仅限于不能接受化疗的患者。放疗可以作为化疗后的巩固治疗,但对于化疗后获得CR的老年患者(>60岁),行巩固放疗的利弊尚有一定争议。手术在本病中的作用仅限于活检,完整切除肿瘤并无益处。
④预后:本病恶性程度较高,支持治疗的中位生存时间仅为2~3个月,单纯手术为3~5个月,单纯放疗约为12~16个月,经含高剂量甲氨蝶呤方案化疗后为25~84个月。最重要的预后因素为年龄和体力状况评分。
2)原发睾丸DLBCL:原发睾丸DLBCL占睾丸肿瘤的3%~9%,占NHL的1%~2%。DLBCL是原发睾丸淋巴瘤最常见的病理类型,占80%~90%。本病是60岁以上男性最常见的睾丸恶性肿瘤,中位发病年龄约65岁。
①临床表现:多表现为睾丸无痛性肿物或肿胀,少数表现为阴囊疼痛。诊断时双侧睾丸同时受累者约占20%,多达35%的患者在病程中对侧睾丸受侵。腹膜后淋巴结肿大者可表现为腹痛和腹腔积液。B症状通常只见于晚期患者。本病易出现结外器官受累,包括中枢神经系统、皮肤、皮下组织、韦氏环、肺和胸膜等。其超声表现主要为:睾丸体积增大,外形光整,睾丸内局限性或弥漫性低回声区,边界可清楚或不清楚,彩超显示有丰富血供,病灶内可有正常睾丸血管穿行。
②治疗原则:原发睾丸DLBCL应接受包括手术、放疗和免疫化疗在内的综合治疗。患者应接受睾丸切除和高位精索结扎术,术后应行免疫化疗,并配合对侧睾丸预防性放疗和中枢神经系统预防性治疗。Ⅱ期患者还可接受区域淋巴结照射。
③预后:本病在初始治疗后10~14年仍可能出现复发。不良预后因素包括高龄、晚期、LDH升高、B症状、IPI指数高和未经手术或放疗。
3)原发纵隔DLBCL:多见于年轻的成年人,中位发病年龄35岁左右,女性略多于男性。肿瘤细胞起源于胸腺B细胞,基因表达谱具有自身独特性,与cHL相似性更高。不同于大多数DLBCL,70%表达CD23和PD-L1。CD30和CD23表达提示为原发纵隔DLBCL。
①临床表现:临床症状和体征多与快速增大的纵隔肿物相关,可致上腔静脉压迫综合症,心包积液和胸腔积液等。初治时病变常较局限,主要位于前上纵隔,可伴有锁骨上、颈部和肺门淋巴结累及,复发后常伴有广泛的结外器官或组织受侵。I-II期占80%左右,III-IV期少见。
②治疗原则:化疗方案的选择尚存争议。可选择的方案包括:R-DA-EPOCH或R-CHOP续贯R-ICE等。早期患者首选化疗后序贯放疗,无大肿块且PET-CT阴性的女性患者可以考虑不放疗。因采用CT评价,常可见残存肿物影,无法鉴别是否为肿瘤残存,推荐化疗结束时采用PET-CT评估。复发耐药患者的治疗参照复发耐药的DLBCL。
③预后:预后优于非特指型DLBCL,采用R-DA-EPOCH方案治疗的5年总生存(overall survival,OS)可以达到90%以上。不良预后因素包括:年龄大、一般状态不佳、分期晚等。
2. 滤泡性淋巴瘤(follicular lymphoma,FL)
FL是欧美地区最常见的惰性淋巴瘤,约占NHL的20%~30%,包括我国在内的亚洲地区发病率较低,不足NHL的10%。中位发病年龄约60岁。
(1)临床表现:主要表现为多发淋巴结肿大,亦可累及骨髓、外周血、脾脏、韦氏环、胃肠道和软组织等,原发结外者少见。晚期患者多见,约占70%左右。
(2)病理诊断:形态学上表现为滤泡中心细胞和中心母细胞的增生,多为滤泡样结节状生长。根据中心母细胞的数量,将FL分为3级:每个高倍镜视野0~5个中心母细胞为1级、6~15个为2级、15个以上为3级,FL3级可以进一步分为3a级和3b级,其中3b表现为中心母细胞呈片状分布且缺乏中心细胞。诊断FL应常规检测的IHC标记物包括CD19、CD20、PAX5、CD3、CD10、BCL-2、BCL-6、LMO2、CD21和Ki-67,也包括鉴别诊断所需的标记物,如鉴别慢性淋巴细胞白血病(Chronic Lymphocytic Leukemia,CLL)/小淋巴细胞淋巴瘤(Small lymphocytic lymphoma,SLL)和套细胞淋巴瘤(Mantle cell lymphoma,MCL)的CD23、CD5、cyclin D1。FL常存在t(14;18)易位及所致的Bcl-2蛋白过表达,但随着级别的升高有不同程度的丢失,为确诊带来困难,必要时可以应用FISH进行BCL2检测。
2017年修订版WHO淋巴瘤分类新提出十二指肠型滤泡性淋巴瘤,其预后很好,需要与其他胃肠道解剖部位的滤泡性淋巴瘤区分开;新提出的伴IRF4基因重排的大B细胞淋巴瘤,常发生于韦氏环(Waldeyer ring)和颈部淋巴结,儿童及年轻人多见,组织学表现与经典FL一致,免疫组化显示IRF4+、CD10+、BCL6+,分子检测显示有IRF4基因重排,该类型预后相对较好。另外把之前原位滤泡性淋巴瘤改为原位滤泡性肿瘤。
骨髓细胞学:当瘤细胞累及骨髓时,有核细胞增生可明显活跃,以FL细胞增多为主,FL细胞较正常淋巴细胞大,胞核圆形或不规则形,核染色质较细,核仁隐约可见,胞质丰富,呈淡蓝色,部分FL细胞可见空泡变性。FL的诊断主要依据病理组织学,当出现FL白血病时,骨髓或外周血可见一定数量的FL细胞。
(3)治疗
1~2级FL属于惰性淋巴瘤,治疗策略如下。3级FL的治疗等同于DLBCL。
①早期FL:Ⅰ、Ⅱ期FL的推荐治疗可选择放疗、免疫化疗±放疗、利妥昔单抗±化疗或观察等待等。具体治疗选择应根据患者年龄、一般状况和治疗意愿,结合循证医学证据作出选择。有>7cm肿块的患者,应按照晚期FL治疗。
②晚期FL:以现有的治疗手段,晚期FL仍被认为是一种不可治愈的疾病。多项研究结果显示,对于晚期和低肿瘤负荷的FL患者,诊断后即刻治疗与先观察等待、待出现治疗指征时再进行治疗,患者的总生存时间并无差异。
FL的标准一线治疗方案为利妥昔单抗联合化疗,也可考虑有症状部位的姑息放疗及参加临床试验。化疗方案可有多种选择,无任一方案经证实可以显著延长患者的总生存期(overall survival,OS)。可选择的化疗方案包括CHOP方案和CVP方案、BR方案等。对于老年和体弱的患者,还可以选择单药利妥昔单抗,或单药烷化剂(如苯丁酸氮芥、环磷酰胺)± 利妥昔单抗等。初治、高肿瘤负荷的患者,在诱导化疗后达到CR或PR,可行利妥昔单抗维持治疗。
晚期FL的治疗指征为:可以参加合适的临床试验、有症状、威胁器官功能、继发血细胞减少、大肿块和病变持续进展。
③复发、难治FL的治疗:对于复发的FL,仍可首选观察等待,当出现治疗指征时再开始解救治疗。如复发或进展距离末次应用利妥昔单抗6个月以上,还可联合利妥昔单抗治疗。根据一线治疗后复发或进展发生的时间,可选择的二线解救化疗方案包括一线化疗方案、含氟达拉滨的联合方案以及所有DLBCL的二线解救治疗方案。对于快速进展的FL,应首先排除是否发生组织学类型的转化。可疑发生转化的临床表现包括LDH升高、某一受累区域不对称性快速生长、出现结外病变或新出现的B症状等。如PET-CT检查显示某一受侵部位标准摄取值(Standarized uptake value)显著增高,应警惕发生组织学类型的转化,需对可疑发生转化的部位进行组织活检,明确病理类型。复发或进展时发生转化的FL,预后较差,对部分诱导化疗后缓解的患者,可以考虑进行HDC/AHSCT或异基因造血干细胞移植。转化型淋巴瘤进展时建议再取活检并根据结果进行治疗(有可能复发病灶为转化前病理类型)。
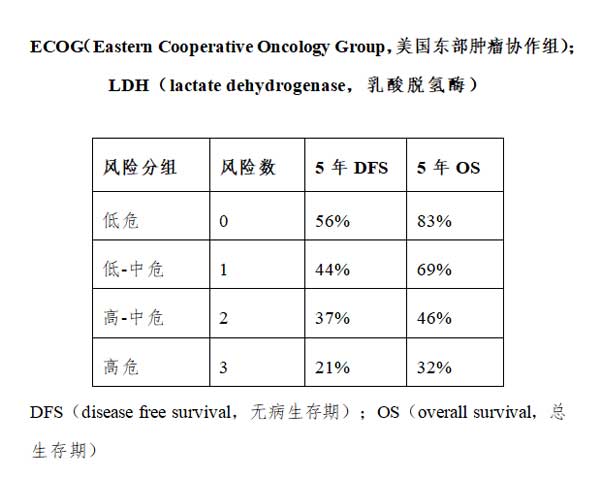
④预后:FL国际预后指数(Follicular lymphoma international prognostic index,FLIPI)有FLIPI1和FLIPI2两个评分系统,分别包含5个独立的预后不良因素,均将患者分为3个风险组,0 ~1分为低危组,2分为中危组,≥3分为高危组。FLIPI1是回顾性研究分析利妥昔单抗上市前的治疗情况得出的,5个不良预后因素分别为年龄≥60岁、>4个淋巴结区域受累、Ⅲ~Ⅳ、LDH升高和血红蛋白<120g/L;低危、中危和高危组患者的10年OS分别为71%、51%和36%。FLIPI2 为应用利妥昔单抗治疗后,经前瞻性研究分析得出的,5个不良预后因素分别为年龄≥60岁、淋巴结最长径>6cm、骨髓侵犯、β2微球蛋白升高和血红蛋白<120g/L;低危、中危和高危患者的5年OS分别为98%、88%和77%,5年PFS分别为79%、51%和20%(见附件3.3)。
3. 边缘区淋巴瘤(marginal zone lymphoma,MZL)
MZL是起源于边缘区的B细胞淋巴瘤,属于惰性淋巴瘤。按照起源部位的不同,分为3种亚型:即结外MZL [也称为黏膜相关淋巴组织(mucosa- associated lymphoid tissue,MALT)淋巴瘤]、淋巴结MZL和脾MZL。其中MALT淋巴瘤最常见,也是我国最常见的惰性淋巴瘤亚型。MALT淋巴瘤的预后优于淋巴结MZL和脾MZL。
MZL的病因与慢性感染或炎症所致的持续免疫刺激有关。如胃MALT淋巴瘤与幽门螺旋杆菌(Helicobacterpylori,Hp)的慢性感染有关,甲状腺MALT淋巴瘤与桥本氏甲状腺炎有关,腮腺MALT淋巴瘤与干燥综合征(Sjögren's syndrome,SS)有关,丙型肝炎病毒感染与淋巴结MZL和脾MZL有关。
MZL的病理诊断更多的是一种排除法,免疫标记物无特异性,需在除外其他类型的小B细胞淋巴瘤后方可诊断,CD21和CD23常显示扩大的滤泡树突状细胞网。病理学形态上常表现为小的淋巴细胞克隆性增生,引起边缘区增宽,生发中心萎缩,可见滤泡“植入”现象和淋巴上皮病变。在鉴别诊断MALT淋巴瘤或者淋巴结边缘区淋巴瘤伴有浆细胞分化时建议添加κ和λ。
骨髓细胞学:有核细胞增生明显活跃,有绒毛的淋巴细胞显著增多,粒、红两系百分率均减低,巨核系细胞数量变化不定。
(1)MALT淋巴瘤:MALT淋巴瘤最常见的原发部位是胃肠道,其中胃原发者占约80%~85%。约2/3的患者为局限期,1/3的患者为广泛期,骨髓受侵的比例约为10%~15%。
1)原发胃MALT淋巴瘤
①临床特点:症状包括消化不良、返酸、腹痛和体重减轻等,B症状不常见,胃出血比例约为20%~30%、穿孔比例约为5%~10%。Ⅰ和Ⅱ期患者可占80%~90%,90%的患者Hp阳性。胃镜下可表现为胃黏膜红斑、糜烂和溃疡等。
②病理诊断:胃MALT淋巴瘤需要胃镜活检病理诊断,常规进行Hp染色。MALT淋巴瘤的典型形态是小的淋巴细胞密集增生,浸润并破坏黏膜上皮,形成淋巴上皮病变。IHC标记物包括CD3ε、CD5、CD10、CD19、CD20、PAX5、CD23和Cyclin D1。在除外了FL、CLL/SLL和MCL后,结合形态及B细胞表型方可诊断为MALT淋巴瘤。为了判定胃MALT淋巴瘤是否具有Hp依赖性,可以通过FISH或PCR法检测t(11;18)易位,以提示抗Hp治疗的耐药情况。当体积大的转化淋巴细胞呈实性或片状增生时,应诊断为DLBCL伴有MALT淋巴瘤。
③治疗原则:I期:Hp阳性患者首选抗Hp治疗,此后胃镜随诊Hp清除情况,但t(11;18)易位患者抗Hp治疗后需接受放疗。对于抗Hp治疗无效或 Hp阴性患者,首选放疗。不适合接受放疗的患者,可考虑单药利妥昔单抗治疗。Ⅲ、Ⅳ期:无治疗指征者可选择观察等待,有治疗指征的患者可参考晚期FL的治疗原则,手术治疗仅限于发生大出血和穿孔等特殊情况。
2)非胃原发MALT淋巴瘤
①临床特点:非胃MALT淋巴瘤呈现惰性进程,预后与原发胃MALT淋巴瘤近似。常见非胃MALT淋巴瘤发病部位包括唾液腺、肺、头颈部、眼附属器、皮肤、甲状腺和乳腺等。
②治疗原则:Ⅰ、Ⅱ期首选放疗。因治疗可能产生严重并发症者,也可观察等待或单药利妥昔单抗治疗。Ⅲ、Ⅳ期参考晚期FL的治疗。
(2)淋巴结MZL
①临床特点:占所有淋巴瘤的1.5%~1.8%,中位发病年龄60岁,男女比例相仿,晚期病变多见。主要累及淋巴结,偶可累及骨髓和外周血。大部分患者表现为无痛性多发淋巴结肿大,需注意除外MALT淋巴瘤或脾MZL合并淋巴结受累的患者。
②病理诊断:结构特点与脾MZL相近,免疫表型无特异性,与其他MZL亚型近似。
③治疗原则:参考FL的治疗原则。
④预后:5年生存率为60%~80%,预后判断可参考FLIPI。
(3)脾MZL
①临床特点:占淋巴瘤的2%,中位发病年龄50岁,男女比例相当。常累及脾、脾门淋巴结,也常累及骨髓、外周血和肝脏。主要表现为脾大,可伴有自身免疫性血小板减少、贫血,外周血中可见毛细胞。实验室检查必须包括丙型肝炎病毒的检测。
②病理诊断:组织结构与淋巴结MZL相似,免疫表型无特异性。可依据骨髓或外周血中出现的异常小淋巴细胞,且同时伴有脾大的临床表现,在排除了CLL/SLL、MCL、FL等之后方可诊断。
③治疗原则:对于无症状、无进行性血细胞减少、无脾肿大的患者可先观察等待。对伴有脾肿大且丙型肝炎病毒阳性的患者,如不存在丙型肝炎治疗禁忌,可给予抗丙型肝炎治疗。对伴有脾肿大、但丙型肝炎病毒阴性的患者,如无症状也可先观察等待;对有症状的患者,首选单纯脾切除或利妥昔单抗单药治疗。对于上述治疗后进展的患者,可参考晚期FL的治疗原则。
④预后:伴有大肿块及一般状况差者预后差。
4. 慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)
CLL/SLL属于惰性B细胞淋巴瘤,CLL和SLL是同一种疾病的不同表现,SLL通常无白血病样表现,CLL则以骨髓和外周血受累为主。国际慢性淋巴细胞白血病工作组(The International Workshop on Chronic Lymphocytic Leukemia,IWCLL)对SLL的定义为:有淋巴结肿大和(或)脾肿大、无因骨髓受侵导致的血细胞减少、外周血B细胞数<5×109/L。SLL需由淋巴结活检的组织病理学确诊,而流式细胞学通常足以诊断CLL,诊断困难时需淋巴结活检及骨髓活检。CLL需达到以下标准:外周血克隆性B细胞计数≥5×109/L;外周血中特征性的成熟小淋巴细胞显著增多,淋巴细胞中不典型淋巴细胞及幼稚淋巴细胞≤55%;典型的免疫表型为CD19+、CD5+、CD23+、CD20弱+、CD43+/-、CD10-、CyclinD1-;流式细胞学确认B细胞呈克隆性异常。
CLL/SLL在欧美国家约占NHL的7%~10%,是欧美国家最常见的白血病类型。亚洲及我国CLL/SLL的发病率较低,约占NHL的1%~3%。中位发病年龄65岁,男女比例1.5~2:1。
(1)临床表现:病变通常累及外周血、骨髓、淋巴结和肝脾。临床表现多样,大部分患者可无症状,部分可出现乏力、自身免疫性贫血、感染、肝脾和淋巴结肿大。
(2)病理诊断:典型的CLL/SLL细胞为单一性,弥漫性浸润,有假滤泡形成,细胞核染色质颗粒状是其特点,可见增殖中心。IHC表型:CD5+、CD23+、CD43+或-、CD10-、CD19+、CD20弱+。需要鉴别诊断时可以针对性增加其他标记物,如Cyclin D1、CD10和BCL-6等。增殖灶的出现易误诊为反应性增生,前期都有单克隆B细胞增生症(Monoclonal B-cell lymphocytosis,MBL)。
细胞学诊断:
血象:外周血RBC和HGB早期多为正常,晚期可见减低。WBC增高,多为(30~100)×109/L;淋巴细胞数持续增高,分类时以分化较好的CLL性淋巴细胞为主,常>50%,可达80%~90%,其形态类似正常淋巴细胞,但细胞核形不规则、呈深切迹或核裂隙,核染色质呈不规则聚集、胞质量少、灰蓝色多无颗粒。破碎细胞(即篮状细胞)多见;可见少量幼淋巴细胞增多,通常<2%。晚期可见血小板减少。如果没有髓外组织侵润,外周血CLL表型的单克隆性淋巴细胞必须≥5x109/L。
骨髓象:骨髓有核细胞增生明显活跃或极度活跃。淋巴细胞高度增生,以异常的成熟小淋巴细胞为主,占40%以上,甚至高达90%。细胞大小和形态基本与外周血一致,形态异常不明显,核可有深切迹或裂隙,核染色质不规则聚集,核仁无或不明显,有少量胞质,无颗粒。还可夹杂一些中到大的淋巴细胞。原、幼淋巴细胞一般<5%。幼淋巴细胞数目增多与疾病进展相关。当幼淋巴细胞大于55%时,可诊断为B幼淋巴细胞白血病(Prolymphocytic leukemia,PLL)。粒系、红系及巨核系细胞三系明显减少。当患者伴发溶血时,幼红细胞可显著增生。
(3)分期:SLL参考Lugano分期;CLL参考Rai和Binet分期系统(见附件2.2)。
(4)治疗
① SLL:Ⅰ期患者采用局部放疗;Ⅱ~Ⅳ期患者,如无治疗指征可以观察等待,有治疗指征时参考CLL的治疗原则。
② CLL:Rai 0~Ⅱ期的低危和中危患者,如无治疗指征可以观察等待;有治疗指征时按照FISH检测及p53基因突变结果、患者一般状态和合并症情况,选择相应的治疗方案。Ⅲ~Ⅳ期的高危患者如有进行性血细胞减少,按照FISH检测及p53基因突变结果、患者一般状态和合并症情况,选择相应的治疗方案。应注意CLL的支持治疗,如肿瘤溶解综合征、感染和自身免疫性血细胞减少的处理。
③ 治疗指征:适合参加临床试验;出现明显的疾病相关症状,如严重乏力、盗汗、体重下降和非感染性发热;威胁脏器功能;持续增大的大肿块,如脾大超过左肋缘下6cm,淋巴结直径>10cm;淋巴细胞计数>200×109~300×109/L,或存在白细胞淤滞症状;进行性贫血和进行性血小板下降。
④ 一线治疗方案的选择:无del(17p)/p53基因突变,年龄<65岁或≥65岁无严重合并疾病患者,推荐FCR方案,FR方案,苯达莫司汀+/-利妥昔单抗,伊布替尼,大剂量甲强龙+利妥昔单抗等治疗。年龄≥65岁或<65岁有合并疾病患者,推荐伊布替尼,苯达莫司汀+/-利妥昔单抗,苯丁酸氮芥+利妥昔单抗,大剂量甲强龙+利妥昔单抗,苯丁酸氮芥单药,利妥昔单抗单药等方案治疗。体弱、伴严重合并疾病不能耐受嘌呤类药物治疗的患者,可选择伊布替尼,苯丁酸氮芥+利妥昔单抗,大剂量甲强龙+利妥昔单抗,利妥昔单抗单药,单药苯丁酸氮芥治疗。缓解后对于有微小残存肿瘤(Minimal residual disease,MRD)≥10-2的患者可考虑来那度胺维持治疗。
存在del(17p)基因改变的患者,对上述免疫化疗方案疗效均欠佳,建议参加临床试验。推荐的一线治疗包括:伊布替尼,大剂量甲强龙+利妥昔单抗,缓解后对于有MRD≥10-2的患者可考虑来那度胺维持治疗。年轻、有供者的患者考虑异基因造血干细胞移植。
⑤ 复发耐药患者治疗方案的选择:如治疗后缓解持续时间≥2年,可继续使用前一治疗方案;如治疗后缓解期<2年,可根据FISH检测及p53基因突变结果、患者年龄及合并疾病情况,选择前一线治疗方案中未曾应用的免疫化疗或靶向药物组合。首先推荐分子靶向药物及其组合方案,包括伊布替尼,利妥昔单抗+PI3K抑制剂(Idelalisib),新型CD20单抗(Ofatumumab,Obinutuzumab),Bcl-2抑制剂(Venetoclax),来那度胺等,治疗缓解后可考虑来那度胺维持治疗。
(5)预后:SLL/CLL患者的生存期为2~15年,与预后差相关的因素包括分期晚,存在del(11q)和del(17p)改变,p53基因突变,流式细胞术检测CD38阳性肿瘤细胞比例≥30%或ZAP70阳性细胞比例≥20%或免疫球蛋白重链可变区(Immunoglobulin heavy chain variable region,IGHV)突变率≤2%,CD49d≥30%,复杂核型(≥3个染色体异常)等。CLL-IPI预后分期系统综合了细胞遗传学、IGHV突变状态、β2-微球蛋白及年龄、分期等因素,可以很好的对CLL进行预后危险度分层。
5. 套细胞淋巴瘤(MCL)
MCL约占NHL的5%~10%,男女比例为2~3:1,中位发病年龄65岁左右。自然病程可以分为侵袭性和惰性。经典型MCL占大部分,具有侵袭性生长特点,同时对治疗的反应类似惰性淋巴瘤,属不可治愈疾病。既往多药联合化疗的生存期约为3~5年,近年来随着HDC/AHSCT及新药研究的进展,生存期得到明显延长。少部分惰性MCL,称为白血病样非淋巴结性MCL,分子遗传学变异较少,无p53基因突变或缺失,不表达或低表达SOX11,其病程类似于惰性淋巴瘤,预后较好。
(1)临床特点:最常累及淋巴结、骨髓、消化道、脾脏和韦氏环,诊断时70%为Ⅳ期。骨髓受侵率可达50%~100%,下消化道受侵率为80%~90%,上消化道受侵率约为40%,消化道受侵在内镜下常表现为多发性息肉样病变。
(2)病理诊断:MCL的肿瘤细胞为形态一致的小至中~大的淋巴细胞,细胞核表面略不规则,生长方式多样,包括套区性、结节性和弥漫性。由于其预后差,所以鉴别诊断非常重要,需要与CLL/SLL、FL和MZL相鉴别。IHC标记物选择包括CD20、PAX5、CD3、CD10、CD23、MUM-1,SOX11和CD138。大多数患者有CD5+、Cyclin D1+的表达特点,而在Cyclin D1 -时确诊困难,需要寻找其他证据,如可以采用FISH方法检测t(11;14),这对诊断MCL的敏感度和特异度都很高。此外,2017年修订版WHO淋巴瘤分类将MCL分为两种类型:一种为经典 MCL,表现为SOX11阳性,IGHV无突变或少突变,临床侵袭性强,预后差,还可以出现更具侵袭性的变异型母细胞型和多形性型,常伴p53突变;另一种为白血病性结外MCL,常累及外周血、骨髓及脾,表现为SOX11阴性,伴IGHV突变,临床呈惰性,预后较好,但是如果p53突变,预后变差。
骨髓细胞学:肿瘤细胞累及骨髓时,骨髓涂片中可见数量不等的异常淋巴细胞增多,肿瘤细胞胞体大小不一,胞核多为圆形或轻度不规则,多见一个大而畸形的核仁,染色质细致弥散,胞质较丰富,呈淡蓝色。
(3)治疗:对MCL患者应进行全面检查,准确分期,以指导治疗选择。发生母细胞变或有中枢神经系统症状者应进行脑脊液和脑MRI检查,对于拟诊为Ⅰ、Ⅱ期的患者,应进行内镜检查除外胃肠道侵犯。
① 治疗策略:经典型MCL,Ⅰ、Ⅱ期患者采用化疗+利妥昔单抗+放疗,或单纯放疗;Ⅱ期伴大肿块及Ⅲ、Ⅳ期患者采取分层治疗策略:对于年龄60~65岁以上,或一般状况较差、不适合HDC/AHSCT的患者,采用化疗+利妥昔单抗治疗,延长生存期;对于年龄小于60~65岁,一般状况较好、适合HDC/AHSCT的患者,应选择含大剂量阿糖胞苷的方案联合利妥昔单抗(R)诱导治疗,缓解后行HDC/AHSCT,之后R维持治疗可进一步获益。2016版血液和淋巴组织肿瘤分类新增加的两个亚型如白血病性非淋巴结套细胞淋巴瘤和原位套细胞肿瘤由于病情进展缓慢且不可治愈,不需要马上开始治疗而采用观察和等待的策略,在有治疗指征如患者有症状或病情快速进展或肿瘤负荷非常大等时才需要治疗。
②一线治疗方案:尚无标准治疗方案,推荐患者参加临床试验。对于年龄大、一般状况差、不适合HDC/AHSCT的患者,可以采用低强度化疗作为初始治疗,推荐方案包括COP、CHOP、R-CHOP、VR-CAP、B-R和降低剂量的R-HyperCVAD/R-MA交替方案等。对于年轻患者可以采用高强度化疗方案诱导缓解,行HDC/AHSCT作为一线巩固治疗,之后利妥昔单抗维持治疗3年,推荐方案包括CALGB方案、R-Hyper-CVAD/R-MA交替方案、R-CHOP/R-ICE交替方案、NORDIC/R+HD-Ara-C交替方案、R-CHOP/R-DHAP交替方案等。目前新型靶向药物如伊布替尼(ibrutinib),联合利妥昔单抗(IR)序贯R-HyperCVAD/R-MA等有望改变MCL一线治疗的模式。
③二线治疗方案:无标准治疗方案,可选用与上述一线方案无交叉耐药的方案,如含苯达莫司汀的B-R方案、R-BAC方案,也可用FCR和FMR方案等。二线巩固治疗可考虑异基因造血干细胞移植。同样值得推荐的是新型靶向药物如硼替佐米、来那度胺和伊布替尼及其联合方案。
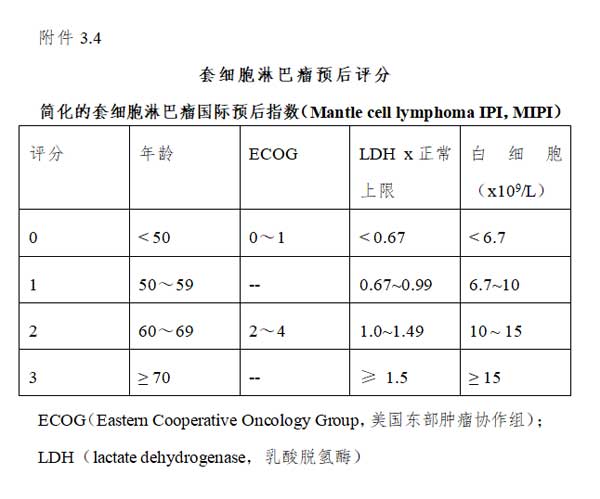
(4)预后:国际预后指数IPI源于侵袭性淋巴瘤的生存数据,也可以作为MCL的预后指标,但预后判断效能较差。简易套细胞淋巴瘤国际预后评分系统(MIPI )对MCL的预后分层效果较好,被广泛采用。而其他不良预后因素还包括Ki-67、p53和母细胞转化等。其中Ki-67是独立于MIPI的最重要的生物学预后指标,结合Ki-67指数和MIPI评分系统的联合评分系统(MIPI-c),能够更好地区分预后,也被推荐采用(见附件3.4)。
6.伯基特淋巴瘤(Burkitt lymphoma,BL)
BL属于高度侵袭性NHL,可分为地方流行性、散发性和免疫缺陷相关性等3个变异型。BL约占NHL的3%~5%,约占儿童NHL的40%。
(1)临床特点:流行型BL主要发生于非洲赤道地区和巴西东北部,高峰发病年龄在4~7岁,男女之比为2∶1,多累及颌骨,EBV阳性率>95%。散发型BL散布于世界各地,主要发生在儿童和青年,男女之比为3∶1~2∶1,腹部受累多见,EBV阳性率<30%。免疫缺陷相关型多发生于艾滋病患者,常累及淋巴结和骨髓。BL是细胞倍增周期最短的肿瘤,生长迅速。BL结外受侵常见,头颈、腹部、骨髓和中枢神经系统等是其最常受累及的部位。
(2)病理诊断:经典型BL形态学表现为较均一的中等大小肿瘤性B细胞弥漫增生,核分裂象及凋亡很明显,常见星空现象。肿瘤细胞起源于生发中心,IHC免疫表型常表现为sIgM+、单一轻链+、CD19+、CD20+、CD22+、c-Myc+、CD10+和Bcl-6+、Bcl-2-、CD5-、CD23-、MUM-1-和TdT-。增殖指数非常高,Ki-67阳性率近100%。即使形态学、免疫表型都是典型的BL,也要采用FISH进行MYC检测,其中t(8;14)占约80%,t(2;8)和 t(8;22)占15%;鉴别诊断包括伴MYC、BCL-2和(或)BCL-6重排的高级别B细胞淋巴瘤和Burkitt样淋巴瘤伴11q异常。EBV-EBER检测对BL是必须的,但我国更多的是散发性患者,EBV-EBER阴性多见。
骨髓细胞学:骨髓增生明显活跃或极度活跃。典型的BL细胞为中到大的淋巴细胞,大小不一并易见成堆分布;白血病细胞胞核较大,多为圆形或不规则形,核染色质呈粗颗粒状,有1至多个大小不等的明显核仁;胞质多少不定,强嗜碱性并含有大小不一、数量较多的脂质空泡呈穿凿样,而且细胞核上也可见空泡。涂片中退化细胞多见,粒系、红系细胞增生受抑制。
(3)治疗:以化疗为主,但CHOP方案疗效不理想,高剂量强化治疗可提高疗效。联合利妥昔单抗可以改善患者长期生存率,特别是对60岁以上的患者获益更大。应进行中枢神经系统预防性治疗,并充分预防肿瘤溶解综合征的发生。根据高危或低危,BL 可选择的化疗方案包括:CODOX-M(低危)、CODOX-M/IVAC方案(高危)、剂量调整的EPOCH或HyperCVAD/HD-MA方案。二线化疗可采用R-ICE、R-GDP、R-IVAC等方案,完全缓解者可考虑HDC/AHSCT或异基因造血干细胞移植。
(4)预后:散发型、成人、分期晚、LDH高、骨髓受侵和HIV阳性为BL不良预后因素。
7. 淋巴母细胞淋巴瘤(Lymphoblastic lymphoma,LBL)
LBL占成人NHL的3%~4%,占儿童NHL的40%左右,属于高度侵袭性淋巴瘤。可以分为T细胞来源(T-LBL)和B细胞来源(B-LBL),T-LBL占LBL的80%以上,B-LBL约占LBL的10%~15%。 LBL与急性淋巴细胞白血病(Acute lymphocyte leukemia,ALL)是属于不同临床表现及不同发展阶段的同一种疾病,WHO分型将骨髓中原始和幼稚淋巴细胞比率≥25%定义为ALL。
(1)临床表现:T-LBL的典型临床表现为前纵隔巨大肿块所致的咳嗽、气短,可伴有胸腔积液、骨髓及中枢神经系统受侵常见。B-LBL往往表现为淋巴结肿大,以皮肤或骨受侵常见。
(2)病理诊断:在细胞形态上,LBL主要表现为中等大小的肿瘤细胞呈弥漫性生长,细胞核圆形、不规则或扭曲,核仁不明显,胞质少,染色质细,核分裂易见。LBL免疫表型以TdT(+)为特点,也可以增加CD99、CD10协助母细胞分化的判定。其中B-LBL的免疫表型为sIg-、cIg+、CD10+、CD19+、CD20-或+、PAX5+;T-LBL的免疫表型为 CD3ε+或-、CD2+、CD4+、CD8+、CD1α+或-和CD7+。CD7、CD43不能单独作为T淋巴细胞的标记物。细胞幼稚时,需要增加CD34、CD117、MPO、Lys等检测,以鉴别急性髓细胞白血病。由于LBL来源于不成熟阶段的淋巴细胞,可出现肿瘤细胞同时表达B或T淋巴细胞的标记,甚至表达NK或髓系细胞的分子标记,这种情况不少见,尤应注意。当病变发生在纵隔时,需要追加上皮相关标记物(如AE1/AE3和CK19等)和T/B细胞基因克隆性重排来与胸腺瘤鉴别诊断。B-LBL常伴发有一些特定基因异常,如BCR-ABL1、ETV6-RUNX1及KMT2A重排等,在条件允许情况下,建议行相关遗传学检查。
骨髓细胞学:骨髓有核细胞增生多为极度活跃或明显活跃,以原和幼淋巴细胞增生为主,常伴有形态异常;原淋巴细胞外形呈圆形、椭圆形或有尾状突起;胞核多为圆形,核大,核染色质粗细不均、排列不规则,核可见凹陷、折叠、切迹及裂痕等。细胞胞质量少,核浆比高。粒系增生明显受抑制,粒细胞显著减少,甚至不见。红系细胞增生也明显受抑,幼红细胞少见或不见。巨核系细胞多数显著减少或不见,血小板少见。退化细胞明显增多。核分裂象细胞易见。在T-LBL中发现有嗜酸性粒细胞在淋巴瘤细胞周围浸润,需排除嗜酸性粒细胞增多和髓系增生伴有FGFR1基因的8p11.2细胞遗传学异常。
血象:白细胞计数多数增高,少数可高达100x109/L。
(3)治疗:无论是Ⅰ期还是Ⅳ期患者,均应按全身性疾病治疗。LBL患者应采用ALL的治疗方案,对于年轻成人患者,儿童ALL治疗方案的疗效优于成人方案。治疗过程包括诱导治疗、巩固强化、维持治疗等几个阶段。为预防肿瘤溶解综合征,可先采用糖皮质激素+环磷酰胺预治疗。诱导治疗推荐采用VDCLP方案,也可以采用 Hyper-CVAD/HD-MA 方案。尽早开始腰椎穿刺、鞘内注射,预防中枢神经系统受侵。诱导治疗达到完全缓解后应继续进行巩固强化治疗。对无骨髓受侵的患者,可以考虑在巩固化疗后尽快行HDC/AHSCT。HDC/AHSCT后的患者应给予MTX联合6-巯基嘌呤(6-MP)或6-硫代鸟嘌呤(6-TG)维持治疗,总的治疗周期至少2年。初治高危和复发难治的患者,可以选择异基因造血干细胞移植。对于t(9;22)/BCR-ABL 阳性的患者可采用化疗联合伊马替尼治疗,化疗方案中可不再加用左旋门冬酰胺酶(L-asparaginase,L-ASP)。推荐伊马替尼持续应用至维持治疗结束。
(4)预后:儿童LBL预后明显优于成人。其他不良预后因素包括白细胞计数高、中枢神经系统受累、达到完全缓解的时间长、诱导化疗结束后有残存病变等。某些基因异常与预后不良相关,如t(9;22)、t(4;11)、t(8;14)、复杂核型、亚二倍体或近3倍体等,而t(12;21)患者预后较好。
8.外周T细胞淋巴瘤,非特指型(Peripheral T-cell lymphoma,not otherwise specified,PTCL-NOS)
PTCL是一组起源于胸腺后成熟T淋巴细胞的淋巴系统恶性肿瘤,PTCL-NOS是PTCL中最常见的一种类型。在欧美国家,PTCL-NOS占所有NHL的7%~10%,亚洲国家发病率明显高于欧美,占所有NHL的15%~22%。由于其在形态学、免疫学、遗传学和临床表现上都无特异性,所以只有在排除其他独立分型的T细胞淋巴瘤后,方能做出PTCL-NOS的诊断。
(1)临床表现:发病常见于中老年人,中位发病年龄55岁,PTCL-NOS无明显性别差异。多表现为浅表淋巴结肿大,半数伴B症状。结外常累及皮肤及皮下组织、肝脾、消化道、甲状腺及骨髓等。初诊时多为Ⅲ、Ⅳ期。
(2)病理诊断:PTCL-NOS是成熟(外周)T细胞发育阶段的肿瘤。病理组织学为丰富的高内皮小血管增生、上皮样组织细胞增生及炎性细胞浸润的混合性背景。瘤细胞形态多样且变化大,可以由小、中等或大细胞组成,多数为中到大细胞,胞质淡染,胞核多形性,不规则,染色质多或泡状,核仁明显,核分裂象多见;常见免疫表型为CD3+、CD4+、CD5+、CD45RO+、CD7-、CD8-。肿瘤细胞常表达CD3ε和CD2等T细胞相关抗原,而丢失一种或多种其他成熟T细胞抗原(CD5或CD7),提示T细胞存在克隆性增殖;同时,PTCL-NOS的TCR基因常表现为克隆性重排,当其与淋巴组织反应性改变鉴别困难时,可借助TCR基因重排检测方法来辅助诊断。诊断时还需要注意鉴别滤泡辅助T细胞来源的淋巴瘤,如AITL、淋巴结外周T细胞淋巴瘤伴滤泡辅助T细胞表型和淋巴结滤泡型T细胞淋巴瘤等。此外,在DLBCL的细胞多形性明显时,酷似T细胞特点,也需要进行鉴别,所以B细胞标记物(如CD20和PAX5等)不可缺少。在伴有多量浆细胞增生时,请注意浆细胞的克隆性。PTCL-NOS包括三种亚型,分别过表达 GATA3、TBX21和细胞毒基因,GATA3 型预后差。
骨髓细胞学:骨髓有核细胞增生多明显活跃,以淋巴细胞增生为主,ATL细胞常>10%,可高达80%以上。粒系细胞、幼红细胞及巨核细胞常减少。
(3)治疗
① 治疗策略:PTCL-NOS本身是一组异质性的疾病,其最佳治疗方案和治疗策略仍在探索中。 对IPI低危或低中危的Ⅰ、Ⅱ期患者首先推荐参加临床试验或4~6个周期的化疗联合局部放疗。对于IPI高危或高中危的Ⅰ~Ⅳ期患者,首先推荐参加临床试验,或者6~8个周期的化疗联合或不联合局部放疗。对于复发难治的PTCL-NOS患者,则推荐参加临床试验、应用二线方案治疗或姑息性放疗。
② 一线治疗方案:预后不良年轻患者,推荐参加临床试验。可供选择的方案包括CHOP-21天方案、CHOP-14天方案、CHOEP方案、DA-EPOCH方案和HyperCVAD/MA方案等。对于不能耐受蒽环类药物治疗的患者,可考虑含吉西他滨等方案。对年轻患者,除ALK阳性的间变性大细胞淋巴瘤外,可以考虑HDC/AHSCR或异基因造血干细胞移植 。
③ 二线治疗方案:优先推荐参加临床试验,否则接受二线解救治疗(包括局部放疗)。二线系统治疗获得CR或PR患者序贯HDC/AHSCT或异基因造血干细胞移植仍然是目前优先考虑的二线治疗策略,是否计划性采用HDC/AHSCT或异基因造血干细胞移植可能影响二线治疗方案的选择。可供选择的单药方案包括:西达本胺、贝利司他、罗米地辛、普拉曲沙,还可选择BV(针对CD30+PTCL)、吉西他滨、苯达莫司汀、来那度胺、硼替佐米等;可供选择的联合方案包括:DHAP方案、ESHAP方案、GDP方案、GemOx方案、ICE方案等。
(4)预后:PTCL-NOS总体预后差于侵袭性B细胞淋巴瘤患者,5年生存率为30%左右。预后评分系统包括IPI和 PTCL-NOS预后指数(prognostic index for PTCL-NOS,PIT),PIT包括年龄>60岁、LDH增高、PS评分≥2和骨髓受侵(见附件3.5)。
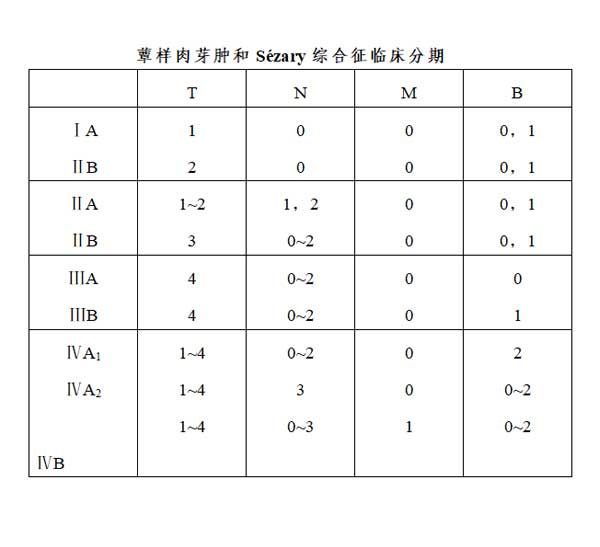
9.蕈样肉芽肿和Sézary 综合征(mycosis fungoides/sézary syndrome,MF/SS)
MF/SS是最常见的皮肤T细胞淋巴瘤(Cutaneous T cell lymphoma,CTCL),占NHL的2%~3%。MF占CTCL的60%,SS仅占5%。MF是一种以惰性表现为特征的原发皮肤的成熟T细胞淋巴瘤。SS是一种以侵袭性为特征的红皮病性白血病MF变异型,以明显的血液系统受侵和淋巴结肿大为其特征。
(1)临床特点:MF临床表现为多发性皮肤红斑、斑块和瘤样结节。全身皮肤均可发生,常伴皮肤瘙痒。病程呈反复性进展,病变可局限于皮肤数月、数年、甚至几十年,在疾病晚期可发生淋巴结和内脏受侵。约10%MF的皮损是广泛性红皮病。SS表现为广泛性红皮病伴外周血受侵(循环血中异常细胞占淋巴细胞比例>5%),在皮损组织、淋巴结和外周血中可见到Sézary细胞。诊断SS应符合以下条件: Sézary细胞计数绝对值≥1×109/L,CD4+/CD8+细胞的比值≥10,肿瘤细胞免疫表型为CD3+、CD4+、CD5+、CD45RO+、CD7-、CD8-和存在T细胞克隆性增殖的证据。
(2)病理诊断:MF的诊断比较困难,可能需要经过几年的观察、多次活检才能确诊。小的、多形核淋巴细胞聚集在表皮或表真皮交界处,向表皮浸润,形成Pautrier微脓肿是其特点。SS最主要的特征与MF类似。MF免疫表型通常为成熟记忆T细胞的表型,为CD3ε+、CD4+、CD45RO+、CD8-。偶见CD4-、CD8+的成熟T细胞表型,存在T细胞克隆性增殖的证据。本病需要与滤泡辅助性T细胞来源的淋巴瘤鉴别。MF非肿块期的病理诊断困难,需要注意与非特异性皮炎鉴别,必须密切结合临床。
(3)分期:请见皮肤T细胞淋巴瘤分期标准(见附件1.3)。
(4)治疗:MF和SS目前尚无根治性治疗方法,疾病分期是确定治疗方法的主要依据。早期皮损不宜采用强烈的治疗,以局部治疗为主或综合应用多种局部治疗手段;ⅡB、Ⅲ、Ⅳ期和难治性病变可采用以全身系统治疗为主的综合治疗或参加临床试验。治疗方法包括皮肤针对性治疗与全身治疗,或相互之间的组合疗法。皮肤针对性治疗手段包括:外用皮质类固醇、氮芥软膏或水溶液、维甲酸、光疗、电子束放射等;全身治疗手段包括:体外光照疗法、细胞因子疗法、靶向治疗、组蛋白去乙酰化酶抑制剂、单克隆抗体、全身化疗等,难治或多次复发晚期患者可选择性采用异基因造血干细胞移植。
①早期病变的治疗:早期MF患者具有正常的细胞免疫功能,绝大多数患者采用局部治疗手段即可,过早采用积极或较强烈治疗并不能改善患者的预后。针对皮肤病灶的治疗手段包括:外用皮质类固醇(中、高效力);外用氮芥软膏或水溶液;外用维甲酸(贝沙罗汀凝胶、他扎罗汀凝胶);光疗,采用紫外线(Ultraviolet,UV)照射:厚的斑块用补骨脂素加长波紫外线照射(psoralen ultraviolet,PUVA),薄的斑片或斑块用 窄谱UV(UVB);全身皮肤电子线照射:适用于广泛累及皮肤的病变。
②晚期或难治性病变的治疗:有限的MF患者发展为侵袭性难治或晚期病变,其治疗目标是减少肿瘤负荷、减轻症状以及减少转化为侵袭性淋巴瘤的潜在风险。治疗方法或药物有体外光照疗法、α-干扰素、地尼白介素
(1)、伏立诺他、罗米地辛、西达本胺、阿仑单抗、硼替佐米、BV(Brentuximab Vedotin)、单药化疗(如吉西他滨、脂质体多柔比星、喷司他丁、瘤可宁、CTX、VP-16、替莫唑胺、MTX、普拉曲沙等)、联合化疗(如CVP方案、CHOP方案、ESHAP方案、EPOCH方案等)等等。组合疗法可以是皮肤针对性治疗+全身系统性治疗,也可以是系统性治疗相互联合应用如体外光照疗法联合α-干扰素或维甲酸等。
(5)预后:MF患者的预后较好,5年生存率近90%,其预后因素取决于T分期(T3和T4)、是否有皮肤外的病变(淋巴结和内脏)和年龄(≥65岁)。SS患者预后通常不佳,中位生存期约2~4年。
10.结外鼻型NK/T细胞淋巴瘤(ENKTL)
ENKTL是EBV相关淋巴瘤,90%以上患者的肿瘤组织中EB病毒阳性。该病在亚洲和南美洲较常见,欧美极少见。在中国的NHL患者中,结外NK/T细胞淋巴瘤占所有NHL中的9%。鼻腔是最常见原发部位,是该型淋巴瘤的原型,其次为鼻咽、扁桃体和口咽等上呼吸消化道器官,也可发生于皮肤、胃肠道、睾丸等结外器官。NK/T细胞淋巴瘤80%-90%来源于NK细胞,10%-30%来源于细胞毒性T淋巴细胞,但目前并未发现不同细胞来源疾病在临床病理特征上存在明显差异,故命名为NK/T细胞淋巴瘤,由于绝大部分原发于结外,因此2001、2008和2017年修订版WHO淋巴瘤分类中,均采用ENKTL命名。
(1)临床特点:ENKTL初诊时年轻男性多见,B症状常见,一般状态良好,肿瘤常局限于鼻腔或直接侵犯邻近结构或组织,而较少有远处淋巴结受侵或结外器官转移,早期占大多数(70%~90%),III-IV期少见,约10%~30%。IPI评分多为低危组(0-1分)。上呼吸消化道是最常见的原发部位,占80%~90%,主要为鼻腔,其次为鼻咽和扁桃体等部位,上呼吸消化道外原发仅占全部患者的10%~25%,以皮肤软组织和胃肠道最常见。
(2)病理诊断:ENKTL病理学特征为弥漫性淋巴瘤细胞浸润,呈血管中心性、血管破坏性生长,导致组织缺血坏死以及黏膜溃疡。坏死很常见,是导致漏诊的主要原因。诊断所需IHC标记物包括CD3、CD56、CD2、CD4、CD5、CD7、CD8、CD45RO、CD20、PAX5、TIA-1、granzyme B、Ki-67及EBV-EBER等。典型的ENKL免疫表型为CD2+、CD3+、CD56+、TIA-1+、granzyme B+和EBV-EBER+。EBV-EBER阴性时诊断要谨慎,如果CD56+、CD3+、细胞毒标志物均表达可以诊断 ENKTL,如果CD3-、CD56-,则诊断PTCL-NOS。60%~90%的 ENKTL无TCR基因重排。本病还需注意与未分化癌相鉴别,应增加CK、EMA等上皮标记物检测。PD-1、PD-L1、CD30和p53的表达与治疗和预后相关。
(3)分期:可以采用Lugano分期系统对 ENKTL患者进行分期,分为Ⅰ、Ⅱ和Ⅳ期,Ⅲ期病变归入Ⅳ期。
(4)治疗
①IE期无任何不良预后因素患者(年龄<60岁,ECOG 0-1分,LDH正常,I期,无原发肿瘤侵犯):建议单纯放射治疗,放疗采用扩大受累野,根治剂量50Gy。
②IE期伴有任何不良预后因素及IIE患者:建议放化综合治疗;放疗采用扩大受累部位照射,根治剂量50Gy,化疗推荐含L-ASP、培门冬酶(PEG-ASP)或者吉西他滨方案。
③晚期(III-IV)患者,倾向于使用含有L-ASP、PEG-ASP或者吉西他滨方案化疗,如SMILE方案或GDP等新方案化疗。含L-ASP或PEG-ASP方案的近期疗效优于其他方案,但III-IV期患者预后差,即使采用新方案化疗,中位生存期仅为8-12个月,5年总生存率仍然低于30%,优先考虑临床研究。晚期化疗达CR和PR的患者,加入放疗可能改善预后。
ENKTL不同的原发部位CTV和照射剂量是放疗成败的关键,与肿瘤局部区域控制率和预后密切相关。早期患者应用大野照射和50 Gy根治剂量的局部区域控制率达到90%以上,5年生存率70%~80%;如果使用小野低剂量(<50 Gy)照射,局部复发率高达50%,5年生存率仅40%~50%。国内外多项研究结果证明,放疗患者的局部区域控制率和5年无进展生存率、总生存率呈线性相关,低于50 Gy会导致局部区域治疗失败风险明显增高,死亡风险也相应增加。
5.预后因素
目前NCCN指南推荐采用的预后模型为KPI、PINK和PINK-E模型,其中KPI包括B症状、LDH升高、区域淋巴结侵犯、III-IV期,PINK包括年龄>60岁、远处淋巴结侵犯、III-IV期、鼻外原发;如果PINK模型因素加上血浆EBV-DNA水平则形成PINK-E模型。
基于中国大样本数据的预后模型中,包括年龄(>60岁和≤60岁)、ECOG评分(≥2分和0-1分)、LDH升高、Ann Arbor分期(I期、II期、III-IV期)和原发肿瘤侵犯(Primary tumor invasion,PTI);PTI定义为任何分期情况下,原发肿瘤侵犯邻近器官或组织。
生物预后因素包括循环血EBV-DNA和Ki-67等。血浆EBV-DNA和肿瘤负荷有关,LDH增高、分期晚、B症状和IPI评分高的患者EBV-DNA浓度高。