发布时间:2018年12月24日 10:25:51 来源:振东健康网
一、概述
脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,世界卫生组织(WHO)中枢神经系统肿瘤分类将脑胶质瘤分为Ⅰ-Ⅳ级,Ⅰ、Ⅱ级为低级别脑胶质瘤,Ⅲ、Ⅳ级为高级别脑胶质瘤。本规范主要涉及星形细胞、少突胶质细胞和室管膜细胞来源的高、低级别脑胶质瘤的诊治。
我国脑胶质瘤年发病率为5-8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。脑胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。
脑胶质瘤临床表现主要包括颅内压增高、神经功能及认知功能障碍和癫痫发作三大类。目前,临床诊断主要依靠计算机断层扫描(CT)及磁共振成像(MRI)检查等影像学诊断,磁共振弥散加权成像(DWI)、磁共振弥散张量成像(DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)、功能磁共振成像(fMRI)、正电子发射计算机断层显像(PET)等对脑胶质瘤的鉴别诊断及治疗效果评价有重要意义。
脑胶质瘤确诊需要通过肿瘤切除或活检获取标本,进行组织和分子病理学检查,确定病理分级和分子亚型。目前主要的分子病理标记物包括:异柠檬酸脱氢酶(IDH)突变、染色体1p/19q联合缺失状态(co-deletion)、O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子区甲基化、α地中海贫血伴智力低下综合征X连锁基因(ATRX)突变、端粒酶逆转录酶(TERT)启动子突变、人组蛋白H3.3(H3F3A)K27M突变、BRAF基因突变、PTPRZ1-MET基因融合、miR-181d、室管膜瘤RELA基因融合等1,2。这些分子标志物对脑胶质瘤的个体化治疗及临床预后判断具有重要意义。
脑胶质瘤治疗以手术切除为主,结合放疗、化疗等综合治疗方法。手术可以缓解临床症状,延长生存期,并获得足够肿瘤标本用以明确病理学诊断和进行分子遗传学检测。手术治疗原则是最大范围安全切除肿瘤,而常规神经导航、功能神经导航、术中神经电生理监测和术中MRI实时影像等新技术有助于实现最大范围安全切除肿瘤。放疗可杀灭或抑制肿瘤细胞,延长患者生存期,常规分割外照射是脑胶质瘤放疗的标准治疗。胶质母细胞瘤(GBM)术后放疗联合替莫唑胺(TMZ)同步并辅助化疗,已成为成人新诊断GBM的标准治疗方案。
脑胶质瘤治疗需要神经外科、神经影像科、放射治疗科、神经肿瘤科、病理科和神经康复科等多学科合作,遵循循证医学原则,采取个体化综合治疗,优化和规范治疗方案,以期达到最大治疗效益,尽可能延长患者的无进展生存期(PFS)和总生存期(OS),提高生存质量。为使患者获得最优化的综合治疗,医师需要对患者进行密切随访观察,定期影像学复查,兼顾考虑患者的日常生活、社会和家庭活动、营养支持、疼痛控制、康复治疗和心理调控等诸多问题。
二、影像学诊断
(一)脑胶质瘤常规影像学特
神经影像常规检查目前主要包括CT和MRI。这两种成像方法可以相对清晰精确地显示脑解剖结构特征及脑肿瘤病变形态学特征,如部位、大小、周边水肿状态、病变区域内组织均匀性、占位效应、血脑屏障破坏程度及病变造成的其他合并征象等。在图像信息上MRI优于CT。CT主要显示脑胶质瘤病变组织与正常脑组织的密度差值,特征性密度表现如钙化、出血及囊性变等,病变累及的部位,水肿状况及占位效应等;常规MRI主要显示脑胶质瘤出血、坏死、水肿组织等的不同信号强度差异及占位效应,并且可以显示病变的侵袭范围。多模态MRI不仅能反映脑胶质瘤的形态学特征,还可以体现肿瘤组织的功能及代谢状况。
常规MRI扫描,主要获取T1加权像、T2加权像、FLAIR像及进行磁共振对比剂的强化扫描。脑胶质瘤边界不清,表现为长T1、长T2信号影,信号可以不均匀,周边水肿轻重不一。因肿瘤对血脑屏障的破坏程度不同,增强扫描征象不一。
脑胶质瘤可发生于脑内各部位。低级别脑胶质瘤常规MRI呈长T1、长T2信号影,边界不清,周边轻度水肿影,局部轻度占位征象,如邻近脑室可致其轻度受压,中线移位不明显,脑池基本正常,病变区域内少见出血、坏死及囊变等表现;增强扫描显示病变极少数出现轻度异常强化影。高级别脑胶质瘤MRI信号明显不均匀,呈混杂T1/T2信号影,周边明显指状水肿影;占位征象明显,邻近脑室受压变形,中线结构移位,脑沟、脑池受压;增强扫描呈明显花环状及结节样异常强化影。
不同级别脑胶质瘤的PET成像特征各异。目前广泛使用的示踪剂为18F-FDG。低级别脑胶质瘤一般代谢活性低于正常脑灰质,高级别脑胶质瘤代谢活性可接近或高于正常脑灰质,但不同级别脑胶质瘤之间的18F-FDG代谢活性存在较大重叠(2级证据)3。氨基酸肿瘤显像具有良好的病变-本底对比度,对脑胶质瘤的分级评价优于18F-FDG,但仍存在一定重叠。
临床诊断怀疑脑胶质瘤拟行活检时,可用PET确定病变代谢活性最高的区域。18F-FET和11C-MET比,18F-FDG具有更高的信噪比和病变对比度(2级证据)4,5。PET联合MRI检查比单独MRI检查更能准确界定放疗靶区(1级证据)6。相对于常规MRI技术,氨基酸PET可以提高勾画肿瘤生物学容积的准确度,发现潜在的被肿瘤细胞浸润/侵袭的脑组织(在常规MRI图像上可无异常发现),并将其纳入到患者的放疗靶区中(2级证据)7-9。18F-FDGPET由于肿瘤/皮层对比度较低,因而不适用于辅助制定放疗靶区(2级证据)10。
神经外科临床医师对神经影像诊断的要求很明确:首先是进行定位诊断,确定肿瘤的大小、范围、肿瘤与周围重要结构(包括重要动脉、皮层静脉、皮层功能区及神经纤维束等)的毗邻关系及形态学特征等,这对制定脑胶质瘤手术方案具有重要的作用;其次是对神经影像学提出功能状况的诊断要求,如肿瘤生长代谢、血供状态及肿瘤对周边脑组织侵袭程度等,这对患者术后的综合疗效评估具有关键作用。多模态MRI可提供肿瘤的血液动力学、代谢、神经纤维组织受累状况和皮质功能区等信息,对于脑胶质瘤的鉴别诊断、确定手术边界、预后判断、监测治疗效果及明确有无复发等具有重要意义,是形态成像诊断的一个重要补充。

(二)脑胶质瘤鉴别诊断
1.脑内转移性病变:脑内转移性病变以多发病变较为常见,多位于脑皮层下,大小不等,水肿程度不一,表现多样,多数为环状或结节样强化影。脑内转移性病变的18F-FDG代谢活性可低于、接近或高于脑灰质;氨基酸代谢活性一般高于脑灰质。单发转移癌需要与高级别脑胶质瘤鉴别,影像学上可以根据病变大小、病变累及部位、增强表现,结合病史、年龄及相关其他辅助检查结果综合鉴别。
2.脑内感染性病变:脑内感染性病变,特别是脑脓肿,需与高级别脑胶质瘤鉴别。两者均有水肿及占位征象,强化呈环形。脑脓肿的壁常较光滑,无壁结节,而高级别脑胶质瘤多呈菜花样强化,囊内信号混杂,可伴肿瘤卒中。绝大部分高级别脑胶质瘤的氨基酸代谢活性明显高于正常脑组织,而脑脓肿一般呈低代谢。
3.脑内脱髓鞘样病变:与脑胶质瘤易发生混淆的是肿瘤样脱髓鞘病变,增强扫描可见结节样强化影,诊断性治疗后复查,病变缩小明显,易复发,实验室检查有助于鉴别诊断。
4.淋巴瘤:对于免疫功能正常的患者,淋巴瘤的MRI信号多较均匀,瘤内出血及坏死少见,增强呈明显均匀强化。18F-FDG代谢活性一般较高级别脑胶质瘤高且代谢分布较均匀。
5.其他神经上皮来源肿瘤:包括中枢神经细胞瘤等。可以根据肿瘤发生部位、增强表现进行初步鉴别诊断。
(三)脑胶质瘤影像学分级
1.常规MRI检查:除部分Ⅱ级脑胶质瘤(如多形性黄色星形细胞瘤、第三脑室脊索瘤样脑胶质瘤和室管膜瘤等)外,高级别脑胶质瘤MRI常有强化伴卒中、坏死及囊变。MRI有无强化及强化程度受到诸多因素影响,如使用激素、注射对比剂的量、机器型号及扫描技术等。
2.多模态MRI检查:包括DWI、PWI及MRS等。DWI高信号区域,提示细胞密度大,代表高级别病变区;PWI高灌注区域,提示血容量增多,多为高级别病变区;MRS中Cho和Cho/NAA比值升高,与肿瘤级别正相关。
3.18F-FDGPET:脑胶质瘤代谢成像的肿瘤-本底对比度偏低,而氨基酸肿瘤显像具有较好的组织对比度,因此建议采用氨基酸PET脑显像评价脑胶质瘤级别(2级证据)11,12。11C-METPET评估准确度高于MRI,高级别脑胶质瘤的11C-MET代谢活性通常高于低级别脑胶质瘤,但高/低级别脑胶质瘤间仍存在一定的重叠(2级证据)13-17。必要时建议使用18F-FDGPET动态成像分析以提高对脑胶质瘤的影像学分级。
(四)脑胶质瘤治疗后影像学评估
脑胶质瘤术后24-72小时内需复查MRI(平扫+增强),评估肿瘤切除程度,并以此作为脑胶质瘤术后基线影像学资料,用于后续比对。胶质瘤治疗效果的影像学评价参见RANO标准18(表2)。
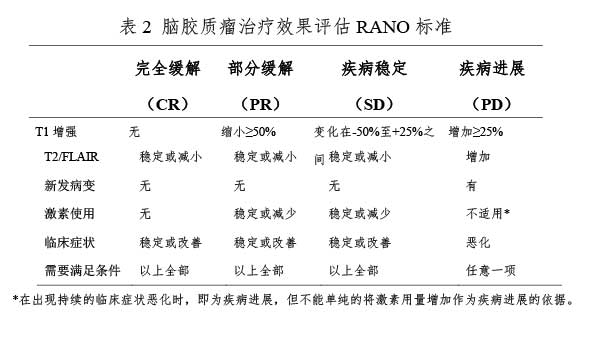
脑胶质瘤按照复发部位包括原位复发、远处复发和脊髓播散等特殊方式,其中以原位复发最为多见19。组织病理学诊断仍然是金标准。假性进展多见于放/化疗后3个月内,少数患者可见于10-18个月内。常表现为病变周边的环形强化,水肿明显,有占位征象,需要结合临床谨慎判断。对于高级别脑胶质瘤,氨基酸PET对鉴别治疗相关变化(假性进展、放射性坏死)和肿瘤复发/进展的准确度较高(2级证据)20-22。放射性坏死多见于放疗3个月后,目前尚无特异性检查手段鉴别放射性坏死与肿瘤进展/复发。对于高级别胶质瘤,18F-FDGPET用于评价术后肿瘤复发和放射性坏死较MRI优势不明显,氨基酸PET用于鉴别肿瘤进展和治疗相关反应具有较高的敏感度和特异度。对于低级别胶质瘤,18F-FDGPET不适用于评价肿瘤治疗反应,而氨基酸PET的评价作用也有限(1级证据)23-25。定期MRI或PET检查,有助于鉴别假性进展和肿瘤进展/复发(表3)。

三、神经病理学与分子病理学诊断
(二)脑胶质瘤病理学综合诊断
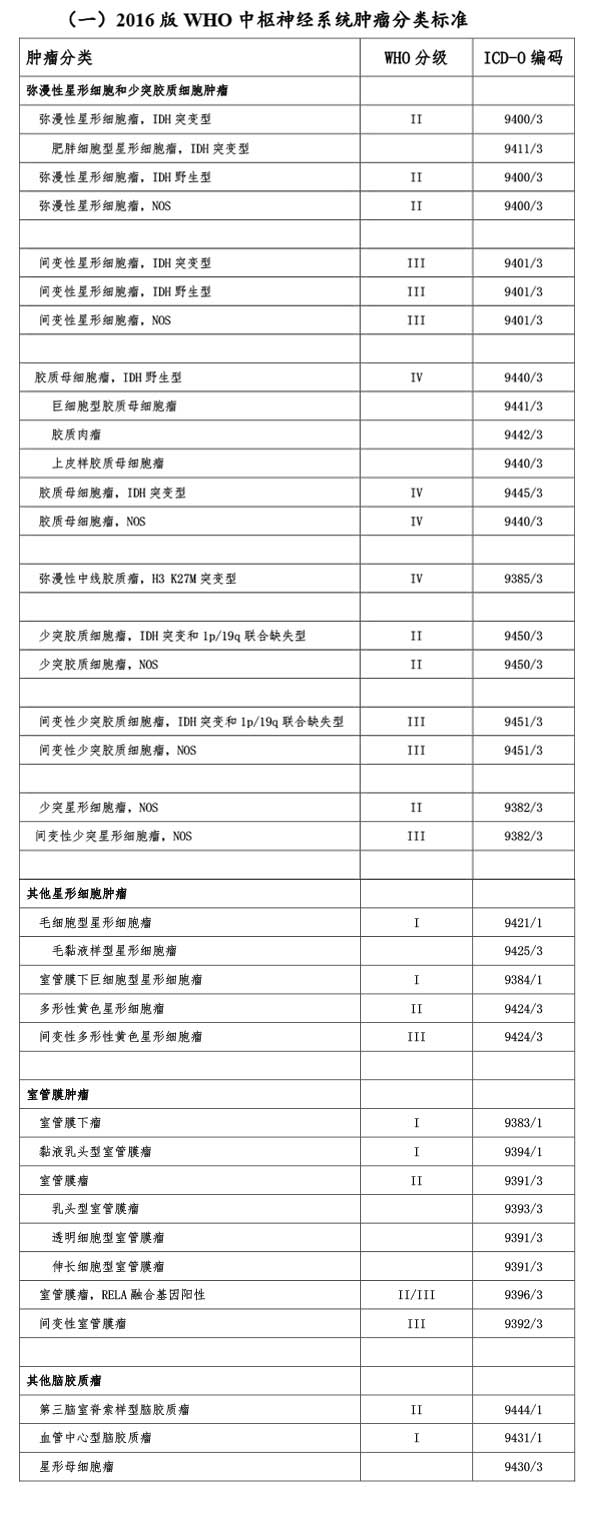
脑胶质瘤是一组具有胶质细胞表型特征的神经上皮肿瘤的总称,2016年世界卫生组织发布了第四版《中枢神经系统肿瘤WHO分类》(修订版),首次整合了肿瘤的组织学特征和分子表型,提出了新的肿瘤分类标准。这一标准是目前脑胶质瘤诊断及分级的重要依据。
1.肿瘤组织学分类与分子表型
(1)星形细胞肿瘤
①弥漫性星形细胞瘤,IDH突变型
定义以IDH1或IDH2基因突变为特征,可伴有TP53及ATRX基因突变。细胞分化程度较高,生长缓慢。可发生于中枢神经系统任何部位,额叶多见;肿瘤具有恶变潜能,可进展成IDH突变型间变性星形细胞瘤,甚或IDH突变型GBM。
大体肿瘤边界不清,位于灰质或白质内,可见大小不等的囊腔、颗粒样区域及软硬度不同的区域。
镜下肿瘤由分化好的纤维型星形细胞组成,细胞密度中等,核不典型,核分裂像少或缺如。间质疏松,常伴微囊形成,不伴有血管内皮细胞增生。Ki-67增殖指数常小于4%。
免疫组织化学胶质纤维酸性蛋白(GFAP)、波形蛋白(Vimentin)、Ki-67/MIB-1、p53蛋白、IDH1R132H和ATRX。
分子病理学IDH1codon132、IDH2codon172基因突变。
肥胖细胞型星形细胞瘤,IDH突变型
定义是弥漫性星形细胞瘤,IDH突变型的一个亚型,以含有大量肥胖型星形细胞为特点,且肥胖型星形细胞含量大于20%。
大体与其他低级别弥漫性脑胶质瘤无区别。
镜下肿瘤细胞呈多角形,胞质丰富、嗜酸性、毛玻璃样,核常偏位,染色质簇状,偶见核仁。血管周围淋巴细胞套常见。
②弥漫性星形细胞瘤,IDH野生型
定义具备弥漫性星形细胞瘤的形态学特征,但无IDH基因突变的一类肿瘤。这类肿瘤较少见,被认为是一种暂定的亚型。
③弥漫性星形细胞瘤,NOS
定义具备弥漫性星形细胞瘤的形态学特征,但缺乏IDH基因突变信息的一类肿瘤。
④间变性星形细胞瘤,IDH突变型
定义具备间变性特征的星形细胞瘤,增生活跃,伴IDH1或IDH2基因突变。这类肿瘤可进展为IDH突变型GBM。
大体肿瘤边界常较清,部分呈颗粒状,不透明,较软,囊变少见。
镜下可见区域性或弥漫性细胞密度增高,肿瘤细胞核有一定异形性,可见病理性核分裂像,可有不同程度的血管内皮细胞增生,但无坏死。免疫组织化学GFAP、p53蛋白、Ki-67/MIB-1、IDH1R132H、ATRX。
分子病理学IDH1codon132、IDH2codon172基因突变。
⑤间变性星形细胞瘤,IDH野生型
定义具备间变性星形细胞瘤的形态学特征,但无IDH基因突变的一类肿瘤。较少见,约占所有间变性星形细胞瘤的20%。这类肿瘤恶性程度高于IDH突变型的间变性星形细胞瘤,与IDH野生型的GBM相似。
⑥间变性星形细胞瘤,NOS
定义具备间变性星形细胞瘤的形态学特征,但缺乏IDH基因突变信息的一类肿瘤。
(2)GBM
①GBM,IDH野生型
定义是恶性程度最高的星形细胞肿瘤,由分化差的肿瘤性星形细胞组成,无IDH基因突变,占所有GBM的90%。主要见于成人,男性多发。这类肿瘤一旦发生即为原发性GBM,多位于幕上,可累及周围及远处脑组织。
大体肿瘤界限不清,切面颜色不一,呈灰色或灰白色,坏死区呈黄色,伴出血时呈现红色或棕色。坏死物液化后可形成含混浊液体的大囊腔。
镜下由分化差的肿瘤性星形细胞组成,细胞密度高,核异型性明显,核分裂像多见,并见大量病理性核分裂像。明显的微血管增生,经常可出现“肾小球样”血管内皮细胞增生和(或)坏死,肿瘤细胞围绕坏死灶呈“假栅栏状”排列是诊断的基本要点。
免疫组织化学GFAP、S-100、OLIG2、EMA、Nestin、WT-1、p53蛋白、Ki-67/MIB-1、IDHR132H、VEGF、MMP-9、EGFR、EGFRvIII。
分子病理学IDH1codon132、IDH2codon172基因突变、MGMT启动子区甲基化、EGFRvIII重排、TERT启动子区突变(C228T和C250T)。检测7号/10号染色体相关基因(MET、PTEN等)及融合基因(FGFR1-TACC1,FGFR3-TACC3)26有助于患者预后的评估及靶向药物的选择(2级证据)。此外,miR-181d对于GBM是一个预后相关的可靠指标,其表达状态可以预测对TMZ化疗的敏感度(2级证据)27
巨细胞型GBM
定义是IDH野生型GBM的一个亚型,罕见。肿瘤主要由含怪异形核的细胞及多核巨细胞组成,偶可见丰富的网状纤维。AURKB表达及TP53突变常见,EGFR基因扩增少见。此亚型患者预后优于其他类型GBM。
免疫组织化学GFAP、p53蛋白、S-100、Vimentin、β-tubulinIII、EGFR、IDHR132H、AURKB。
胶质肉瘤
定义是IDH野生型GBM的一个亚型,具有胶质和间叶组织双向分化的特点。此亚型常与GBM有关,也可由室管膜瘤和少突胶质细胞瘤转化而来。主要见于成人,可原发或继发,预后较差。
大体因含大量结缔组织,肿瘤质地较硬、界限清楚。
镜下肿瘤含两种成分:胶质成分和肉瘤成分。
免疫组织化学GFAP、IDHR132H、p53蛋白及其他胶质肿瘤和间叶肿瘤标志物。
特殊染色:网织纤维染色。
上皮样GBM
定义是IDH野生型GBM的一个亚型,好发于小儿及青年人,常见于大脑和间脑,预后差。
镜下含有密集排列的上皮样细胞,部分横纹肌样细胞,核分裂活跃,微血管增生,以及坏死。
免疫组织化学GFAP、S-100、EMA、OLIG2、KI-67/MIB-1、Syn、NFP、VE1、SMARCB1、SMARCA4、IDHR132H。
分子病理学BRAFV600E、IDH1codon132、IDH2codon172基因突变。与其他GBM相比,BRAFV600E突变率较高(~50%)。
②GBM,IDH突变型
定义伴有IDH1或IDH2基因突变的一类GBM,由弥散性星形细胞瘤或间变性星形细胞瘤发展而来,故称继发性GBM,占所有GBM的10%。
镜下组织学特征与IDH野生型GBM相似,但坏死范围更小。
免疫组织化学GFAP、IDHR132H、ATRX、p53蛋白、EGFR。
分子病理学IDH1codon132、IDH2codon172基因突变。检测7号染色体/10号染色体相关基因(EGFR、MET和PTEN等)及融合基因(PTPRZ1-MET)有助于患者预后的评估及靶向药物的选择(2级证据)28。
③GBM,NOS
定义缺乏IDH突变信息的一类GBM。
(3)弥漫性中线胶质瘤,H3K27M突变型
定义发生于中线的高级别星形细胞肿瘤,伴有H3F3A或HIST1H3B/C基因K27M突变。主要发生于儿童,也可见于成人。最常见的发病部位包括脑干、丘脑和脊髓。预后差,2年生存率小于10%。
镜下肿瘤由大小一致的小细胞或大的多形性细胞组成,多数细胞呈星形细胞形态,少数呈少突胶质细胞形态。约10%病例缺乏核分裂象、微血管增生和坏死,组织学相当于WHOII级。其余均为高级别,其中25%病例可见核分裂像,75%病例既可见核分裂像,也可见坏死和微血管增生。
免疫组织化学GFAP、NCAM1、S-100、OLIG2、MAP2、p53蛋白、ATRX、H3K27M。
分子病理学H3F3A、HIST1H3B、HIST1H3C基因突变。
(4)少突胶质细胞瘤
①少突胶质细胞瘤,IDH突变和1p/19q联合缺失型
定义一种弥漫浸润、生长缓慢的脑胶质瘤,伴IDH基因突变和1p/19q联合缺失。主要发生于成年人,多数位于大脑半球,尤其是额叶。
大体肿瘤界限清楚,呈灰粉色,质软。钙化、囊变、瘤内出血常见。
镜下肿瘤细胞呈中等密度,大小较一致,核圆,核周空晕。其他特征包括微钙化、黏液/囊性变和致密分枝状毛细血管网。Ki-67增殖指数<5%。
免疫组织化学IDHR132H、p53蛋白、ATRX、OLIG2、CIC、FUBP1、MAP2、S-100、LEU7、NeuN、NOGO-A、Ki-67/MIB-1。
分子病理学IDH1codon132、IDH2codon172基因突变、1p/19q原位杂交、TERT启动子区突变(C228T和C250T),MGMT甲基化状态。
②少突胶质细胞瘤,NOS
定义具有少突胶质细胞瘤的组织学特点,但缺乏IDH基因突变和染色体1p/19q缺失状态信息的一类肿瘤。
③间变性少突胶质细胞瘤
间变性少突胶质细胞瘤,IDH突变和1p/19q联合缺失型
定义具有间变性少突胶质细胞瘤的组织学特征,伴IDH基因突变和1p/19q联合缺失。
大体与少突胶质细胞瘤相似,并见坏死区。
镜下肿瘤细胞具备少突胶质细胞的特征,并见间变性特征,包括细胞密度高、细胞异型性明显、核分裂像增多、微血管增生及坏死。
免疫组织化学IDHR132H、p53蛋白、ATRX、OLIG2、CIC、FUBP1、MAP2、S-100、LEU7、NeuN、NOGO-A、Ki-67/MIB-1。
分子病理学IDH1codon132、IDH2codon172基因突变、1p/19q原位杂交、,MGMT甲基化状态、TERT启动子区突变(C228T和C250T)。
④间变性少突胶质细胞瘤,NOS
定义具有间变性少突胶质细胞瘤的组织学特征,但缺乏IDH基因突变和染色体1p/19q缺失状态信息的一类肿瘤。
(5)少突星形细胞瘤
由少突胶质细胞瘤和星形细胞瘤两种成分组成,且分子表型不明确的一类肿瘤。WHO分类不推荐此类诊断,依据IDH基因突变和1p/19q联合缺失状态,大多数少突星形细胞瘤可以归入星形细胞瘤或少突胶质细胞瘤的范畴。依据组织学特点和增殖活性,又可分为少突星形细胞瘤,NOS和间变性少突星形细胞瘤,NOS。
(6)其他星形细胞肿瘤
①毛细胞型星形细胞瘤
定义一种界限清楚,生长缓慢的星形细胞瘤,多见于儿童和年轻人,常呈囊性,具有双相组织学特点:即含Rosenthal纤维的密集双极细胞区,以及含微囊和嗜酸性颗粒小体/透明滴的疏松多极细胞区。蛛网膜下腔浸润是常见的特点。
免疫组织化学GFAP、S-100、OLIG2、Syn、IDHR132H、NFP、pMAPK、VE1。
分子病理学BRAFV600E基因突变、KIAA1549-BRAF融合基因。
毛黏液样型星形细胞瘤
定义是一种毛细胞样肿瘤,与毛细胞型星形细胞瘤密切相关,具有明显的黏液样基质和以血管为中心的形态单一的双极性肿瘤细胞,通常没有Rosenthal纤维和嗜伊红颗粒小体。
免疫组织化学GFAP、S-100、Vimentin、Syn、NFP、CD34、VE1、Ki-67/MIB-1。
分子病理学KIAA1549-BRAF融合基因。
②室管膜下巨细胞型星形细胞瘤
定义一种良性、生长缓慢的肿瘤,典型部位是侧脑室壁,由大的节细胞样星形细胞构成,与结节硬化复征密切相关。
镜下肿瘤界限清楚,成簇状生长和血管周围假栅栏状排列是常见的特点。肿瘤细胞表现出广泛的星形细胞表型,可以是胞质丰富呈玻璃样的多角细胞,也可以是位于纤维基质中稍小的长形细胞。
免疫组织化学GFAP、S-100、β-tubulin、NeuN、SOX2、CD34、Ki-67/MIB-1。
分子病理学TSC1、TSC2基因突变。
③多形性黄色星形细胞瘤和间变性多形性黄色星形细胞瘤
定义一种预后相对较好的星形细胞肿瘤,常发生于儿童和年轻人,好发于大脑半球的浅表部位,常侵及脑膜。典型的组织学特征包括表达GFAP的多形性细胞和脂质化细胞,这些细胞常被网状纤维和嗜酸性颗粒小体包绕。根据核分裂像,可将肿瘤分为多形性黄色星形细胞瘤(WHOII级,<5/10HPF)和间变性多形性黄色星形细胞瘤(WHOIII级,≥5/10HPF)。其中,间变性肿瘤可伴坏死。
免疫组织化学GFAP、S-100、β-tubulin、MAP2、CD34、VE1、CDKN2A、Ki-67/MIB-1。
特殊染色:网织纤维染色。
分子病理学BRAFV600E基因突变。
(7)室管膜肿瘤
①室管膜下瘤
定义一种生长缓慢的良性肿瘤,位于脑室壁,簇状脑胶质瘤细胞包埋在丰富的纤维基质中,常伴微囊形成。
免疫组织化学GFAP、NCAM1、NSE、EMA、MDM2、Ki-67/MIB-1。
②黏液乳头型室管膜瘤
定义一种生长缓慢的脑胶质瘤,几乎毫无例外的发生于脊髓圆锥、马尾和终丝。组织学以肿瘤细胞围绕血管黏液样间质轴心排列,呈乳头状结构为特点。
免疫组织化学GFAP、S-100、Vimentin、NCAM1、AE1/AE3、CD99、Ki-67/MIB-1。
③室管膜瘤
定义一种生长缓慢的肿瘤,发生于儿童和年轻人,起源于脑室壁或脊髓导水管,由肿瘤性室管膜细胞构成。肿瘤界限清楚,细胞密度适中,核形态单一,呈圆形或卵圆形,染色质呈胡椒盐状,核分裂像罕见。血管周围假菊形团和室管膜周围菊形团是室管膜瘤的关键特征。根据形态特征可分为三个亚型:乳头型室管膜瘤、透明细胞型室管膜瘤和伸长细胞型室管膜瘤。
免疫组织化学GFAP、S-100、EMA、L1CAM、OLIG2、Ki-67/MIB-1。
④室管膜瘤,RELA融合基因阳性
定义一类RELA融合基因阳性的幕上室管膜瘤,预后较其他类型室管膜瘤差。
免疫组织化学GFAP、EMA、L1CAM、Ki-67/MIB-1。
分子病理学C11orf95-RELA融合基因。
⑤间变性室管膜瘤
定义一种具有室管膜分化的恶性脑胶质瘤,尤其在儿童患者,生长速度快,预后很差。组织学特点为核分裂像增多,伴微血管增生及坏死。
(8)其他脑胶质瘤
①第三脑室脊索样型脑胶质瘤
定义一种罕见的、生长缓慢、非侵袭性、位于成人第三脑室的脑胶质瘤。
镜下在黏液性基质中可见簇状和条索状排列的上皮样GFAP阳性的肿瘤细胞,特征性的伴淋巴浆细胞浸润。
免疫组织化学GFAP、TTF-1、EMA、Vimentin、CD34、Ki-67/MIB-1。
②血管中心型脑胶质瘤
定义常见症状是癫痫发作,是一种生长缓慢的脑胶质瘤,儿童和青年人多见。组织学特点为血管中心性生长,单形性双极瘤细胞和室管膜分化。
免疫组织化学GFAP、S-100、Vimentin、EMA、Ki-67/MIB-1。
分子病理学:MYB-QKI融合基因。
③星形母细胞瘤
定义一种罕见,好发于儿童、青少年和青年人,由GFAP阳性细胞伴宽的、有时尖端渐细的突起,放射状围绕在呈现硬化的血管周围,而形成的胶质细胞肿瘤。
免疫组织化学GFAP、S-100、Vimentin、EMA、CAM5.2、AE1/AE3、Ki-67/MIB-1。
2.肿瘤WHO分级
弥漫型星形细胞瘤按照WHO分级标准可分为II-IV级,其中II级表现为细胞密度中等,核分裂像少见或缺如,Ki-67/MIB-1增殖指数<5%;III级表现为细胞密度增高,核异型性明显,核分裂像增多,Ki-67/MIB-1增殖指数5%-10%;IV级细胞密度增高,明显的核异型、活跃的核分裂活性、明显的微血管增生和(或)坏死,Ki-67/MIB-1增殖指数>10%。值得注意的是,Ki-67/MIB-1增殖指数只作为肿瘤分级的参考,目前尚无准确的阈值可以用来明确区分肿瘤级别。
3.病理报告主要内容
脑胶质瘤病理报告应当标准化、规范化,内容应包括:(1)患者基本临床信息;(2)肿瘤部位;(3)免疫组织化学与分子病理学检测结果;(4)组织学类型、分级及分子病理学诊断和分级;(5)特殊情况备注等。
四、治疗
(一)手术治疗
1.概述
脑胶质瘤手术治疗原则是最大范围安全切除(maximalsaferesection),其基本目的包括:解除占位征象和缓解颅内高压症状;解除或缓解因脑胶质瘤引发的相关症状,如继发性癫痫等;获得病理组织和分子病理,明确诊断;降低肿瘤负荷,为后续综合治疗提供条件。
脑胶质瘤手术治疗方式主要可分为肿瘤切除术和病理活检术。
(1)肿瘤切除术适应证和禁忌证
①适应证:CT或MRI提示颅内占位;存在明显的颅内高压及脑疝征象;存在由于肿瘤占位而引起的神经功能障碍;有明确癫痫发作史;患者自愿接受手术。
②禁忌证:严重心、肺、肝、肾功能障碍及复发患者,一般状况差不能耐受手术;其他不适合接受神经外科开颅手术的禁忌证。
(2)病理活检术适应证和禁忌证
①适应证:肿瘤位于优势半球,广泛浸润性生长或侵及双侧半球;肿瘤位于功能区皮质、白质深部或脑干部位,且无法满意切除;需要鉴别病变性质。
②禁忌证:严重心、肺、肝、肾功能障碍及复发患者,一般状况差不能耐受手术;其他不适合接受神经外科手术的禁忌证。
(3)病理活检手术方式
活检可分为立体定向或导航下活检和开颅手术活检两类。立体定向或导航下活检适用于位置更加深在的病变;而开颅活检适用于位置浅表或接近功能区皮质的病变。开颅活检比立体定向活检可以获得更多的肿瘤组织,有利于结果的判定。活检的诊断准确率高于影像学诊断,但是受肿瘤的异质性和靶区选择等因素影响仍存在误诊率。
(4)围手术期处理
①术前处理:若术前出现明显的颅内高压症状,应及时给予脱水药物缓解颅内高压;若存在明显脑积水,可考虑先行脑室腹腔分流术或脑室穿刺外引流术。
②术后处理:需根据颅内压情况选择是否使用脱水药物进行降颅压治疗,并适当使用激素稳定患者神经功能状态;若术后出现发热,需及时进行腰椎穿刺采集脑脊液进行化验,积极防治颅内感染;术后应常规监测电解质,积极纠正电解质紊乱;对幕上脑胶质瘤患者,术后应常规应用抗癫痫药物预防癫痫发作。
(5)新型手术辅助技术的运用
新型手术辅助技术的应用有助于手术切除程度和肿瘤边界的判定及术中功能保护。
推荐:神经影像导航、功能神经影像导航(2、3级证据)29、术中神经电生理监测技术(例如,皮质功能定位和皮质下神经传导束定位)(3级证据)30和术中MRI实时影像神经导航(3级证据)31。多模态神经导航联合术中皮质及皮质下定位,可进一步提高手术安全性,保护神经功能,有利于最大范围安全切除(3级证据)32,33。
可推荐:荧光引导的显微手术(3级证据)34和术中B超影像实时定位。
(6)脑胶质瘤手术切除程度的判定
强烈推荐脑胶质瘤术后24-72小时内复查MRI,高级别脑胶质瘤以MRI增强、低级别脑胶质瘤以T2/FLAIR的容积定量分析为标准,并以此影像作为判断后续治疗疗效或肿瘤进展的基线。以此将切除程度按切除肿瘤体积分为4个等级:即全切除、次全切除、部分切除、活检35-38,目前具体标准尚不统一。
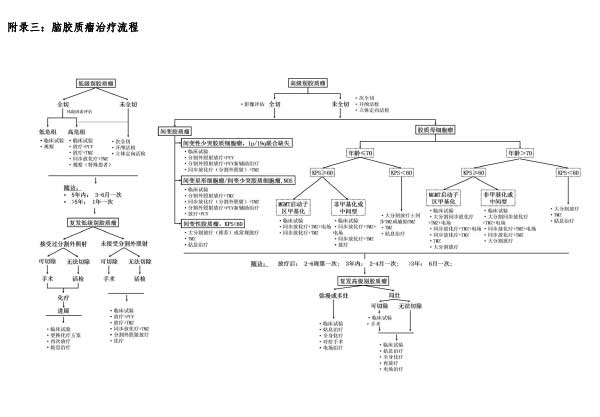
2.高级别脑胶质瘤
强烈推荐最大范围安全切除(2、3级证据)39,40。手术目的包括:缓解由颅压高和压迫引起的症状;降低类固醇药物使用,维持较好的生存状态;降低肿瘤细胞负荷,为辅助放/化疗创造条件;延长生存期;获得精确病理诊断。与单纯活检相比,尽可能切除肿瘤是影响高级别脑胶质瘤患者预后的重要因素41,但由于高级别脑胶质瘤的浸润特性,实现病理上完全切除肿瘤常较困难。新型手术辅助技术的运用有助于高级别脑胶质瘤的最大范围安全切除。肿瘤切除程度是高级别脑胶质瘤的独立预后因素之一,肿瘤全切可延长术后肿瘤复发时间和患者生存期(2、3级证据)39,40,42。
3.低级别脑胶质瘤
低级别脑胶质瘤约占脑胶质瘤的30%,患者的发病年龄比高级别脑胶质瘤年轻,常位于或靠近重要功能区,如运动、语言、视空间和记忆。对于弥漫性低级别脑胶质瘤,强烈推荐最大范围安全切除肿瘤(2、3级证据)43,44。新型手术辅助技术可以有效提高患者影像学的肿瘤全切率,减低术后永久性神经功能障碍的发生率(2、3级证据)30,31。唤醒手术技术扩大了在脑功能区实施手术的指征(详见“功能区脑胶质瘤的手术治疗”部分)。针对非功能区或邻近功能区的低级别脑胶质瘤,脑功能定位技术可以识别与关键脑功能有关的皮质和皮质下结构,使手术切除范围扩大到重要功能结构的临界,以实现低级别脑胶质瘤的最大范围安全切除45。
4.复发脑胶质瘤
目前,复发脑胶质瘤的手术治疗获益,尚缺乏高级别的循证医学证据。手术原则是最大范围安全切除。手术目的包括:获取组织学和生物学信息,确定是复发还是假性进展,减小肿瘤负荷,缓解症状,术后可进行其他治疗46。新型手术辅助技术有助于实现最大范围安全切除复发脑胶质瘤。复发脑胶质瘤的手术治疗必须个体化,应该考虑患者年龄、临床功能状态、组织学类型、初始治疗反应、复发类型(局部还是弥漫性)、第一次手术和再次手术的时间间隔、既往治疗方式等47。
5.功能区脑胶质瘤
功能区脑胶质瘤是指根据术前磁共振影像显示肿瘤累及感觉运动区(中央前回、运动前区、辅助运动区和感觉区)、语言区(包括:优势半球的颞上回后部、颞中回和颞下回后部、额下回后部、额中回后部、缘上回、角回等)、顶叶视空间认知功能区和计算功能区、基底节或内囊、丘脑、距状沟视皮质等皮质及皮质下结构48。功能区脑胶质瘤手术具有其特殊的手术方式和手术技巧。
(1)手术方式
目前,对功能区脑胶质瘤患者手术时推荐采用术中唤醒配合术中脑功能定位49-54,在提高肿瘤切除范围及切除程度的同时,可有效避免患者出现术后永久性功能障碍。
适应证包括:累及脑功能区的脑胶质瘤患者;对功能定位有主观配合意愿;自愿接受唤醒麻醉手术者。
除常规全麻下开颅手术禁忌证外,禁忌证还应包括55:患者术前出现严重的颅内高压症状或已存在脑疝,常规术前使用脱水药物后功能无改善;存在意识障碍或重度认知障碍;明确精神病史;沟通交流障碍,存在严重神经功能缺失或难以配合完成术中指定检测任务;麻醉医师和手术医师无唤醒手术经验;患者拒绝接受唤醒麻醉手术;年龄小于18岁(相对禁忌)心理发育迟滞;患者不能长时间耐受固定体位。
(2)术前评估
主要可分为影像学评估、神经功能评估和术前宣教三部分内容。
①术前影像学评估:
强烈推荐:T1、T2、T2-FLAIR、T1增强、任务态血氧水平依赖功能磁共振成像(BOLD-fMRI)、DTI、3D-T1WI;推荐:MRS、静息态功能磁共振(Rs-fMRI)、PWI。
T1、T2、T2-FLAIR、T1增强:可确定病变范围,水肿及恶性程度。肿瘤侵袭区域和功能区的距离与患者的功能状态相关。当肿瘤距离手运动区皮质小于6mm时,肿瘤易造成患者术前肌力损伤56。BOLD-fMRI技术常用于对患者四肢运动功能区及语言功能区的定位(3级证据)57-59,但当肿瘤临近功能区(如肿瘤距离手运动区皮质小于4mm时),其定位准确效度会受肿瘤影响而下降(3级证据)60,因此需谨慎对待定位结果。术前应用fMRI技术对患者进行功能区定位,有利于术者在术中确定肿瘤的切除范围,有效避免患者术后出现永久性功能损伤(3级证据)61。Rs-fMRI是一种不需要患者在检查中完成任务的成像方法(3级证据)62,63,推荐将该技术作为一种补充检查手段(3级证据)64,应用于无法配合完成BOLD-fMRI检查的患者。DTI及纤维束追踪:强烈推荐在肿瘤侵犯脑功能区的脑胶质瘤患者中使用,可以提高肿瘤切除范围,同时保护患者的神经功能(3级证据)65。同时,推荐在非功能区脑胶质瘤患者中广泛应用该技术,以了解肿瘤与周围神经纤维解剖结构的情况。
②术前神经功能评估:
术前应用客观神经心理学量表评估患者的功能状态,为术者制定手术及术后治疗方案提供帮助。应用的量表应具备包含正常范围参考值、可重复性高等特点。
强烈推荐:KPS、爱丁堡利手检查;
推荐(根据肿瘤累及的脑功能区选择):韦氏成人测验、西部失语症检查(WAB)中文版、ABC失语症检查、忽视测评:(如线段等分划消实验等);
可推荐:韦达(WADA)试验、中国康复研究中心失语症检查法(CRRCAE)、蒙特利尔认知评估量表(MoCA)、抑郁自评量表(SDS)、焦虑自评量表(SAS)、症状自评量表(SDL90)。
③术前癫痫评估:
强烈推荐对患者的癫痫史、癫痫发作的症状、癫痫发作程度及药物控制这四方面情况客观评估。具体细则参考《国际抗癫痫联盟(ILAE)癫痫治疗指南1981年版、1990年修订版及2013版癫痫治疗指南》。
(3)手术准备
①切口设计:
根据病变的部位和功能区的位置设计切口,原则上应包含肿瘤和其累及的重要功能脑区(监测靶区)。基于以下因素综合考虑:①暴露病变及周围功能区,利于术中监测和功能定位保护。②复发率高的肿瘤(如脑胶质瘤)要考虑二次手术可能。③功能区分布的个体间差异性。④皮下动脉,静脉窦,发际线等常规需要考虑的结构因素。
②体位:
常采取侧卧位或仰卧位,以头架固定。若采取仰卧,应严密注意防范术中误吸的发生。选择的体位要保证患者术中舒适,摆好体位后使用保温毯有助于减少患者唤醒后寒战以及其引起的颅内压增高等。
③麻醉方式:
目前的功能区脑胶质瘤唤醒手术可以分为两种:术中唤醒麻醉开颅脑功能区肿瘤切除术和监护麻醉下全程清醒开颅脑功能区肿瘤切除术。睡眠-清醒-睡眠(AAA)麻醉模式,是目前最为常用的唤醒手术麻醉方式,是一种深度麻醉接近于全身麻醉的技术,此种技术需要喉罩、带套囊口咽气道等辅助气道工具来保持患者气道通常;在监护麻醉下进行的全程清醒开颅脑功能区肿瘤切除术,是一种使患者处于适度镇静的清醒状态下的肿瘤切除手术,其优势在于手术过程中患者一直处于自主呼吸状态,无需进行喉罩等辅助通气设备,可避免术中唤醒后因拔除喉罩诱发患者颅内压增高。
(4)术中操作
开颅过程:头架固定钉局部浸润麻醉、头皮重要神经阻滞(眶上神经和滑车上神经、耳颞神经、枕小神经、枕大神经和第三枕神经)和切口局部浸润麻醉,切口麻醉范围包括术野皮肤、皮下至骨膜,包括皮瓣基底部。告知麻醉医师唤醒患者,并对硬膜用2%利多卡因浸润棉片覆盖15-20min。待患者唤醒且一般状况及情绪稳定后,剪开硬脑膜并四周悬吊硬脑膜(不可过度牵拉),硬膜外彻底止血55,66。
术中影像学技术:强烈推荐:神经导航系统;推荐:可使用术中MRI、术中超声等。
①神经导航系统:术中可根据导航棒探针的位置,确定手术切除位置及切除深度(3级证据)67,68。
②术中MRI技术可以辅助术者确定肿瘤切除后残余肿瘤的体积,提高肿瘤的最终切除程度(3级证据)69,70。③术中超声成像可在术中辅助判断肿瘤范围和切除程度,提供病变周围及内部血流情况。
术中脑功能定位技术:强烈推荐:直接电刺激定位功能区皮质(2、3级证据)44,71,72;推荐:体感诱发电位定位中央沟,持续经颅或经皮质运动诱发电位监测运动通路完整性,直接电刺激定位皮质和皮质下功能结构,神经导航结合术前功能磁共振定位影像。
运动区监测:①运动区阳性表现为对侧肢体或面部相应部位肌肉出现不自主动作,同时可记录到肌电活动;电刺激运动前区或辅助运动区可能引起复杂运动。②运动区皮质下需要监测和保护的重要结构为锥体束73-75。
感觉区监测:感觉区阳性表现为对侧肢体或头部脉冲式的异常感觉,多表现为麻木感;刺激感觉区有时也可引起肢体运动。
语言区监测:推荐的语言任务有:数数和图片命名。电刺激过程中,患者出现的异常表现(包括:语言中断、构音障碍、命名错误、反应迟钝、语言重复等)76均提示该区域为物体命名相关语言中枢。图片材料推荐选用经过汉语语言标准化的物体图片。语言区皮质下需要监测和保护的重要结构有弓状束、上纵束、下枕额束、额斜束、下纵束等77-79。
切除策略:在保留重要功能结构的前提下,选择适当的手术入路尽可能切除病变。目前国际公认的切除安全范围应至少距离阳性刺激区5mm(3级证据)55,80。同时注意保护正常动脉及脑表面重要引流血管。通常先切除非功能区肿瘤,然后逐步推进至重要功能区附近,切除过程持续监测患者功能状态,可疑存在皮层下重要通路,即时进行皮质下电刺激,以确定重要皮质下功能结构并予以保护。切除病变后,可应用术中MRI扫描、术中超声、或荧光造影等技术观察病变有无残留81-83。
(5)术后评估及预后
强烈推荐术后24-72h内行MRI检查,高级别脑胶质瘤以MRI增强、低级别脑胶质瘤以T2/FLAIR的容积定量分析为标准,评价肿瘤切除程度。推荐分别在术后1~3天、1个月、3个月、6个月评价患者的KPS评分、语言功能、运动功能及生活质量等。评价过程推荐采用神经影像与行为量表相结合的方式。
应用唤醒手术直接皮质及皮质下电刺激技术定位和保护功能区,可显著降低患者术后永久性神经功能障碍的发生率,术后暂时性神经功能障碍多可在3个月内恢复。(3级证据)55,80,84。
6.合并癫痫症状的脑胶质瘤
(1)手术治疗控制脑胶质瘤相关癫痫
脑胶质瘤全切除优于次全切除对术后癫痫的控制(1级证据)85,86。脑胶质瘤全切除后大部分脑胶质瘤相关癫痫患者能达到无癫痫发作,在安全可行的情况下,尽可能做最大程度病变切除,以利于术后癫痫控制(2级证据)87。术前有继发性癫痫大发作及肿瘤有钙化的胶质瘤患者,术后癫痫预后更好(3级证据)88。与单纯病变切除相比,应用癫痫外科手术技术可以提高术后癫痫控制率,特别是颞叶脑胶质瘤相关癫痫的患者,行肿瘤切除联合钩回、杏仁核选择性切除和(或)颞叶前部皮质切除后,更利于脑胶质瘤相关癫痫的控制(2级证据)89。但是否保留海马结构,需结合患者对记忆以及学习能力的实际需求酌情考量。
脑胶质瘤引起的癫痫发作风险与肿瘤累及的脑区有关(2级证据)90。功能区脑胶质瘤的手术切除范围相对有限,术后癫痫发生率也相对较高,应充分利用现有技术,在保护脑功能的前提下,尽可能多地切除肿瘤,以减少术后癫痫发作(3级证据)91。
对于慢性癫痫相关性脑胶质瘤患者,建议酌情采用术中皮质脑电图(ECoG)或深部脑电(SEEG)监测,指导癫痫灶切除范围,以改善患者癫痫预后,提高长期癫痫治愈率(1、2级证据)92,93。
(2)术中癫痫的控制
累及脑功能区的脑胶质瘤,在术中电刺激功能区定位时,存在一定的癫痫发作风险(2、4级证据)94,95,当术中脑电监测或症状观察提示患者出现癫痫发作时,用冰林格氏液或冰生理盐水冲洗局部可控制大部分癫痫发作(2级证据)96。仍有癫痫持续发作者可以应用抗癫痫药物、镇静药物或者肌松药物终止发作(4级证据)95。
(3)难治性脑胶质瘤相关癫痫的手术治疗
应用抗癫痫药物过程中出现癫痫复发或加重常提示肿瘤进展(2级证据)97,脑胶质瘤术后无癫痫发作较长时间后再次出现癫痫发作,可能提示肿瘤复发(2级证据)98。脑胶质瘤复发伴频繁的药物难治性癫痫发作时,综合患者情况,可以手术治疗。无复发的术后脑胶质瘤伴频繁癫痫发作,可按照难治性癫痫进行全面评价,对于药物难治性脑胶质瘤相关癫痫且明显影响生活质量,可考虑手术(3级证据)99。
(二)放射治疗
放射治疗通常是在明确肿瘤病理后,采用6-10MV直线加速器,常规分次,择机进行,立体定向放疗(SRT)不适用于脑胶质瘤的初治。
1.高级别脑胶质瘤
手术是基础治疗,放/化疗等是不可或缺的重要治疗手段,高级别胶质瘤术后放疗可以取得显著的生存获益(1级证据)。
(1)放疗时机
高级别胶质瘤生存时间与放疗开始时间密切相关100,术后早期放疗能有效延长高级别胶质瘤患者的生存期,强烈推荐术后尽早(手术后2-6周)开始放疗(2级证据)。
(2)放疗技术
推荐采用三维适形(3D-CRT)或适形调强技术(IMRT),常规分次,适形放疗技术可提高靶区剂量的覆盖率、适形度及对正常组织保护,缩小不必要的照射体积,降低晚期并发症发生率(2级证据)101,放疗前图像验证(CBCT或EPID)是放疗质控不可缺少的环节。
(3)放疗剂量
推荐放射治疗照射总剂量为54-60Gy,1.8-2.0Gy/次,分割30-33次,每日1次,肿瘤体积较大和(或)位于重要功能区及WHOIII级间变性胶质瘤,可适当降低照射总剂量(1级证据)102。尽管3D-CRT或IMRT具有提高靶区适形度、减少正常组织受量,最大限度地缩小照射体积,能够给予靶区更高的放疗剂量,但提高剂量后的疗效尚未得到证实,盲目提高照射总剂量或提高分次量,应十分慎重。
(4)靶区确定
高级别胶质瘤放疗靶区争议至今,其焦点主要是最初的临床靶区(CTV)是否需要包括瘤周的水肿区,美国肿瘤放射治疗协会(RTOG)推荐CTV1需包括瘤周水肿区外2cm区域,给予46Gy,缩野后CTV2需在大体肿瘤靶区(GTV)外扩2cm,剂量增至60Gy。2018年美国国家综合癌症网络(NCCN)指南推荐MRIT1增强或T2/FLAR异常信号为GTV,外扩1-2cm形成WHOIII级胶质瘤的CTV,而外扩2-2.5cm形成GBM的CTV103。CTV外扩3-5mm形成PTV;而T2/FLAR显示的水肿区建议包括在一程的CTV1中(46Gy/23f),二程增量区(Boost:14Gy/7f)应仅仅包括残余肿瘤或术后瘤腔外扩2.0cm形成的CTV2。II期临床试验证实包或不包水肿区在肿瘤控制和生存期上无明显差异104-106,欧洲癌症研究和治疗组织(EORTC)推荐的CTV设定并不强调一定要包括所有瘤周水肿区。
靶区勾画原则是在安全的前提下,尽可能保证肿瘤达到60Gy的照射剂量,应参考术前、术后MRI,正确区分术后肿瘤残存与术后改变,在临床实践中,医师应根据靶区位置、体积、患者年龄、KPS评分等因素综合考虑,灵活运用以上关于靶区设定的建议,平衡照射剂量、体积与放射性损伤之间的关系。
(5)联合放化疗
放疗和TMZ同步应用:
①GBM:强烈推荐成人初治者放疗联合TMZ(75mg/m2)同步化疗,并随后6个周期TMZ辅助化疗,在放疗中和放疗后应用TMZ,显著延长患者生存期(1级证据)107,这一协同作用在MGMT启动子区甲基化患者中最为明显(2级证据)108。
②间变性脑胶质瘤:对于存在1p/19q联合缺失的患者对化疗和放疗更敏感(1级证据)109,110,放疗联合PCV化疗是一线治疗方案(1级证据),目前TMZ对WHOⅢ级肿瘤的治疗初步显示疗效(2级证据),而且副反应更少。研究TMZ、放疗、1p/19q联合缺失三者关系的2项大型临床随机试验正在进行中,中期结果显示:对于无1p/19q联合缺失者,放疗联合12个周期TMZ化疗,显著改善患者生存期111。IDH和TERT启动子区突变与预后密切相关,IDH野生型伴或不伴TERT启动子区突变患者,临床预后最差,应加强放化疗强度,在WHOII级胶质瘤中也同样存在这样的现象112。
间变性胶质瘤放疗应根据患者具体情况,包括一般状态、分子生物学标记和治疗需求等采用个体化治疗策略,治疗选择包括术后单纯放疗、放疗结合TMZ同步和(或)辅助化疗等。
2.低级别脑胶质瘤
低级别胶质瘤术后放疗适应证、最佳时机、放疗剂量等一直存在争议,目前通常根据患者预后风险高低来制订治疗策略。
(1)危险因素:年龄≥40岁、肿瘤未全切除,肿瘤体积大,术前神经功能缺损,IDH野生型等是预后不良因素113-115。对于肿瘤未全切除或年龄≥40岁的患者,推荐积极行早期放疗和(或)化疗。年龄<40岁且肿瘤全切除的患者,可以选择密切观察,肿瘤进展后再治疗116。
(2)放疗剂量:强烈推荐低级别胶质瘤放疗的总剂量为45-54Gy,但这个剂量是否适合IDH野生型低级别胶质瘤患者还未知,推荐分次剂量1.8-2.0Gy(1级证据)117,118。分次剂量超过2Gy会增加发生远期认知障碍的风险(2级证据)119。
(3)靶区确定:GTV主要是根据手术前后MRIT2/FLAIR异常信号区域,正确区分肿瘤残留和术后改变,推荐以GTV外扩1-2cm作为低级别胶质瘤的CTV。
3.室管膜肿瘤
手术是室管膜肿瘤首选治疗方法,室管膜肿瘤全切后多数学者主张无需辅助治疗,部分切除的室管膜瘤和间变性室管膜瘤是放疗适应症(3级证据)120-122。而对放疗后短期复发或年幼不宜行放疗者,选择化疗作为辅助治疗,但疗效并不确定。
室管膜肿瘤术后三周,需行全脑全脊髓MRI和脑脊液脱落细胞学检查,无脑或脊髓肿瘤播散证据者,局部放疗,反之则推荐全脑全脊髓放疗(3级证据)123-126。
局部放疗:根据术前和术后MRI确定肿瘤局部照射范围,通常采用增强T1像或FLAIR/T2加权像上异常信号为GTV,CTV为GTV外放1-2cm,每日分割1.8-2.0Gy,颅内肿瘤总剂量为54-59.4Gy,脊髓区肿瘤剂量45Gy,如果肿瘤位于脊髓圆锥以下时,总剂量可以提高至60Gy。
全脑全脊髓放疗:全脑包括硬脑膜以内的区域,全脊髓上起第一颈髓、下至尾椎硬膜囊,全脑全脊髓照射总剂量36Gy,1.8-2.0Gy/次,后续颅内病灶区缩野局部追加剂量至54-59.4Gy,脊髓病灶区追加剂量至45Gy。
4.复发脑胶质瘤
评估复发脑胶质瘤再放疗的安全性时,应该充分考虑肿瘤的位置及大小。由于复发前多接受过放射治疗,对于复发的较小病灶回顾性研究多采用立体定向放射外科治疗(SRS)或低分割SRT技术127,128,而对于传统的分割放疗研究多集中在体积相对较大的复发病灶,应充分考虑脑组织的耐受性和放射性脑坏死的发生风险129。放疗联合药物治疗可推荐贝伐珠单抗及TMZ,联合治疗能够延长部分患者的PFS和OS130-133。
5.放射性脑损伤
放疗对脑组织损伤依据发生的时间和临床表现划分为三种不同类型:急性(放疗后6周内发生)、亚急性(放疗后6周至6个月发生)和晚期(放疗后数月至数年)。
(1)急性和亚急性放射损伤
急性和亚急性放射损伤可能为血管扩张、血脑屏障受损和水肿所致。急性损伤表现为颅高压征象,如恶心、呕吐、头痛和嗜睡等。通常是短暂而且可逆,应用皮质类固醇可以缓解症状。有时可以在MRI表现出弥漫性水肿。亚急性放射性脑损伤表现为嗜睡和疲劳,通常可在数周内自愈,必要时予以皮质类固醇类药物治疗以控制症状。
(2)晚期放射损伤
晚期放射反应常常是进行性和不可逆的,包括白质脑病、放射性坏死和其他各种病变(多为血管性病变)。放疗的总剂量、分割剂量等与白质脑病的发生直接相关134,135。非治疗相关因素包括一些使血管性损伤易感性增加的伴随疾病,如糖尿病、高血压及高龄等,均可使白质脑病的发生率增加。同步化疗也是另外一个危险因素135。脑胶质瘤TMZ同步放化疗后假性进展发生率明显增高,其本质就是早期放射性坏死136。放疗最严重的晚期反应是放射性坏死,发生率约为3%-24%。放疗后3年是出现的高峰。放射性坏死的临床表现与肿瘤复发相似,如初始症状的再次出现,原有的神经功能障碍恶化和影像学上出现进展的,不可逆的强化病灶,其周围有相关水肿。减少放射损伤根本在于预防,合理规划照射总剂量,分次量及合适的靶区体积可有效减少放射性坏死发生率。
(三)药物治疗
化疗是通过使用化学治疗药物杀灭肿瘤细胞的治疗方法,化疗可以提高脑胶质瘤患者的PFS及OS107,137,138。对于高级别脑胶质瘤,由于其生长及复发迅速,进行积极有效的个体化化疗会更有价值。其他药物治疗手段还包括分子靶向治疗、生物免疫治疗等,目前均尚在临床试验阶段。鼓励有条件及符合条件的患者,在不同疾病阶段参加药物临床试验。
1.基本原则
(1)肿瘤切除程度影响化疗效果。推荐化疗应在最大范围安全切除肿瘤的基础上进行。
(2)术后应尽早开始化疗和足量化疗。在保证安全的基础上,采用最大耐受剂量的化疗以及合理的化疗疗程,可以获得最佳的治疗效果。应注意药物毒性和患者免疫力。
(3)选择作用机制不同及毒性不重叠的药物进行联合化疗,减少耐药的发生率。
(4)根据组织病理和分子病理结果,选择合适的化疗方案。
(5)某些抗肿瘤药物和抗癫痫药物会产生相互影响,同时使用时应酌情选择或调整化疗药物或抗癫痫药物。
(6)积极参与有效可行的药物临床试验。
2.高级别脑胶质瘤
(1)经典化疗方案
①Stupp方案:在放疗期间口服TMZ75mg/m2/d,连服42天;间隔4周,进入辅助化疗阶段,口服TMZ150-200mg/m2/d,连用5天,每28天重复,共用6个周期107,137。
②PCV方案:甲基苄肼(PCB)60mg/m2/dd8-21,洛莫司汀(CCNU)110mg/m2/dd1,长春新碱(VCR)1.4mg/m2d8,d29,8周为一周期109。
应用于胶质瘤治疗中的药物还有卡莫司汀、伊立替康、依托泊苷、顺铂、卡铂、环磷酰胺等。
(2)间变性脑胶质瘤的化疗
对于间变性脑胶质瘤,推荐进行放疗加TMZ辅助化疗(2级证据)139,放疗同步加辅助TMZ化疗(2级证据)139,放疗联合PCV化疗(2级证据),参加可行的临床试验(2级证据)。
对于具有1p/19q联合缺失的间变性少突胶质细胞瘤,推荐进行放疗102和PCV方案化疗(1级证据)109,110,放疗加同步或者辅助TMZ辅助化疗(2级证据)109,110,或接受可行的临床试验(2级证据)。
对于KPS<60的间变性脑胶质瘤,推荐进行放疗(短程放疗和常规分次放疗)(2级证据)102,140,141,MGMT启动子区甲基化者,建议接受TMZ治疗(2级证据),也可以采用姑息治疗(2级证据)。
(3)GBM的化疗(年龄≤70岁)
对于KPS≥60的患者,若存在MGMT启动子区甲基化,推荐进行常规放疗加同步和辅助TMZ化疗(1级证据)102,常规放疗加同步和辅助TMZ化疗加电场治疗(1级证据),或接受可行的临床试验(2级证据)。对于MGMT启动子区非甲基化和甲基化情况不明确者,推荐进行放疗同步并辅助TMZ化疗(I级证据)102,常规放疗加同步和辅助TMZ化疗加电场治疗(1级证据),单纯标准放疗(2级证据),或接受可行的临床试验(2级证据)。
对于KPS<60的患者,推荐在短程放疗的基础上,加或者不加同步和辅助TMZ化疗(2级证据)140,141;存在MGMT启动子区甲基化的患者,也可单独采用TMZ化疗(2级证据),或姑息治疗(2级证据)。
(4)间变性室管膜瘤的化疗
在复发手术后出现再次进展时,或全脑全脊髓播散的情况下,可采用铂类药物142、依托泊苷、洛莫司汀、卡莫司汀以及TMZ143等药物进行化疗,或接受可行的药物临床试验。
3.低级别脑胶质瘤
目前对于低级别脑胶质瘤的化疗还存在一定争议,主要包括:化疗的时机、化疗方案的选择、化疗与放疗次序的安排等。
根据目前的循证医学证据,对于有高危因素的低级别脑胶质瘤患者,应积极考虑包括化疗在内的辅助治疗。伴有1p/19q联合缺失的患者,可以优先考虑化疗,而推迟放疗的时间。高风险低级别脑胶质瘤的推荐化疗方案包括:PCV方案(1级证据)144;TMZ单药化疗(2级证据)145-147;TMZ同步放化疗(2级证据)145-147。
4.复发脑胶质瘤
目前尚无针对标准治疗后复发脑胶质瘤的标准化疗方案。如为高级别复发脑胶质瘤,强烈建议接受适当可行的临床试验,如果无合适的临床试验,可采用以下方案(2级证据):
(1)低级别脑胶质瘤复发后可选方案:①放疗加辅助PCV治疗;②放疗加TMZ辅助治疗;③同步放
化疗加TMZ辅助治疗;④对于以往没有使用过TMZ的患者还可以使用TMZ146-148;⑤洛莫司汀或卡莫司汀单药治疗;⑥PCV联合方案治疗149;⑦以卡铂或者顺铂为基础的化疗方案150-152。
(2)间变性脑胶质瘤复发后可选方案:①TMZ147,148,153,154;②洛莫司汀或卡莫司汀单药治疗155;③PCV联合方案治疗;④贝伐单抗156-158;⑤贝伐单抗加化疗(伊利替康159,160,卡莫司汀/洛莫司汀161,TMZ,卡铂162,163);⑥伊利替康164,165;⑦环磷酰胺166,167;⑧以卡铂或顺铂为基础的化疗方案;⑨依托泊苷168。
(3)GBM复发后可选方案:①贝伐单抗169-171;②贝伐单抗加化疗(伊利替康169-171,卡莫司汀/洛莫司汀161,TMZ,卡铂);③TMZ107,148,172;④洛莫司汀或卡莫司汀单药治疗155;⑤PCV联合方案治疗;⑥环磷酰胺161;⑦以卡铂或顺铂为基础的化疗方案。
(四)电场治疗
肿瘤治疗电场(TTF)是一种通过抑制肿瘤细胞有丝分裂发挥抗肿瘤作用的治疗方法,用于脑胶质瘤的电场治疗系统是一种便携式设备,通过贴敷于头皮的转换片产生中频低场强肿瘤治疗磁场。目前研究显示电场治疗安全且有效173,推荐用于新发GBM(1级证据)和复发高级别脑胶质瘤的治疗(2级证据)。
(五)老年脑胶质瘤治疗原则
目前对老年的定义尚没有统一的标准,本规范所指老年脑胶质瘤患者是指年龄>70周岁者。GBM是老年脑胶质瘤最常见的病理类型,老年GBM具有独特的分子遗传学特征,主要包括ATRX、BRAF、IDH和TP53突变率明显下降,PTEN基因突变率明显增加174,TP53突变和EGFR的扩增可能与患者的预后相关175。老年GBM患者的治疗方案主要包括手术切除、放疗以及TMZ化疗。对于KPS≥60的老年GBM患者,美国2018年NCCN指南还推荐使用电场治疗(1级证据)103。
1.手术治疗
手术切除肿瘤可以使老年GBM患者得到肯定的生存获益(1级证据)176,全切肿瘤更有利于术后功能的恢复(2级证据)177。综合老年状态评估(CGA)评价较好者,手术切除具有良好的安全性和临床获益178。因此,老年脑胶质瘤患者同样推荐手术治疗,而80岁以上老年患者需要慎重考虑手术,术前功能较差的老年患者不推荐手术治疗179。
2.放疗和化疗
放疗和化疗等辅助治疗可以明确提高患者的OS。老年GBM患者推荐应用短程放疗(40Gy/15f/3w)联合TMZ化疗(1级证据)180;对于KPS<60分的老年GBM患者,建议采用短程放疗,MGMT启动子区甲基化者建议采用TMZ单药化疗,或姑息治疗。
(六)弥漫性中线胶质瘤治疗原则
弥漫性中线胶质瘤是指发生于三脑室、丘脑、脑干等中线结构的高级别脑胶质瘤。国内目前尚无确切的流行病学数据,国外报道儿童的发病高峰在6-7岁,成人在20-50岁,没有明显性别差异181-183。因发病部位及浸润性生长的特点,治疗困难,预后极差。2016年WHO中枢神经系统肿瘤分类标准将弥漫性中线胶质瘤归为IV级。该类肿瘤包含多种病理类型,可具有任何一种已知的浸润性脑胶质瘤的组织病理学特点,在细胞形态学和基因遗传学上具有多态性和异质性,其中H3K27M基因突变是小儿弥漫内生性桥脑胶质瘤最常见的基因改变,预示患者预后更差184-186。
1.手术治疗
尽管现在对脑中线结构的解剖认识不断加深,以及神经导航和术中监测技术的不断进步,但手术切除该类肿瘤仍存在高风险,且由于肿瘤的浸润性生长导致做不到完整切除,因此手术切除肿瘤不做常规推荐187。推荐肿瘤组织活检手术,活检的目的是明确病理诊断,依据分子病理指导综合治疗188,189。
2.放疗和化疗
目前尚无成熟的放疗和化疗方案。联合放疗能够使部分肿瘤的客观反应率提高(3级证据)190,可以参考GBM放疗方案191,192,可根据患者具体情况适当调整放疗剂量。化疗可以选择使用TMZ(3级证据)191,192,或推荐合适的患者参加临床试验。
(七)康复治疗
脑胶质瘤患者术后大多存在不同程度的功能和社会心理方面的障碍,日常活动和社会参与度受到限制,生活质量降低。适当的康复治疗能使大多数患者获得明显的功能进步。
1.常见康复问题及评估
脑胶质瘤所导致的康复问题可分为残损、活动限制和参与受限3个层次。①残损:主要包括肢体肌肉无力、感觉缺失、平衡障碍、吞咽障碍、构音障碍、失语症、认知障碍和心理障碍等。肌力可用徒手肌力测试评定,感觉缺失可用Fuglmeyer四肢感觉功能评测法评定,平衡障碍则可用Berg平衡量表评定,吞咽障碍可用洼田饮水试验、视频吞咽造影检查评定,构音障碍可用改良Frenchay法评定,失语症可用波士顿诊断性失语检查法(BDAE),认知障碍评定可用简易智力状态检查法(MMSE)、认知与精神测定量表评定,焦虑和抑郁可用汉密顿焦虑和抑郁量表评定。②活动限制:指上述神经残损导致患者在移动和自我照料方面的困难。可采用Barthel量表、功能独立性量表(FIM)来评定。③参与受限:指上述神经残损导致患者在就业、家庭生活及社会融合等方面的困难。可采用SF-36生存质量量表评定。
2.康复治疗
针对上述脑胶质瘤所导致的康复问题,推荐采用个体化的综合治疗方案,包括物理治疗(PT)、作业治疗(ST)、言语和吞咽治疗(ST)、认知和行为治疗、心理治疗和康复工程(2级证据)。此外,还包括康复护理、营养支持和祖国传统医学等治疗方法。可采用药物治疗来管理疼痛和痉挛以及促进认知功能恢复等。推荐早期康复。中枢神经系统胶质瘤术后或其他治疗后,患者生命体征稳定后即可开始193,194。①物理治疗:以运动疗法为主,包括正确体位的摆放、关节活动度练习、肌力训练、耐力训练、神经肌肉促进技术训练、平衡及协调性训练、步态训练和呼吸训练等(3级证据)。不推荐磁、电等物理因子常规剂量治疗(2级证据)。②作业治疗:应用与日常生活、工作有关的各种作业活动或工艺过程中的某个运动环节作为训练方式,最终以提高患者在生活自理、工作及休闲活动上的独立能力为目的的治疗方法。主要包括:维持日常生活所必需的基本作业治疗、创造价值的作业治疗、消遣性或文娱性作业治疗、教育性作业治疗及辅助支具使用训练等(3级证据)。③言语及吞咽治疗:言语障碍包括失语症及构音障碍,需要根据患者言语康复评定的结果分别采用促进言语功能恢复的训练和非言语交流方式的使用训练,前者包括语音训练、听理解训练、口语表达训练等,后者包括手势语、画图、交流板、交流手册及电脑交流装置使用训练(3级证据)。吞咽障碍治疗主要包括营养摄入途径的改变、促进吞咽功能恢复的康复训练、食物性状和进食体位的调整、吞咽康复相关的康复护理和教育四个方面。④认知和行为治疗:认知障碍主要表现为注意力、记忆力、执行功能、定向力、结构和视空间功能障碍等。认知康复主要包括增强对认知缺损认识和理解的教育、减少认知缺损所造成影响的适应性治疗及针对认知缺损的修复性治疗,其中适应性和修复性治疗时应以患者特定生活方式和工作需要为导向。规范的认知康复有助于认知功能的改善(1级证据)193。⑤心理治疗:针对脑胶质瘤患者出现的焦虑和抑郁,可通过心理干预的方法来缓解和消除(3级证据)195,对于中、重度焦虑或抑郁患者可酌情给予抗焦虑和抑郁的药物。同时应兼顾对患者的家属、护工的心理支持和教育。⑥康复工程:对于脑胶质瘤患者的肢体无力和平衡障碍,可以通过康复工程制作各种辅助器具,达到改善患者的日常生活能力(3级证据)。如:用佩戴踝足矫形器来改善足下垂,用宽基底的四脚杖、标准助行器或半助行器来增加支撑面从而降低步行或站立时的跌倒风险等。⑦药物治疗:对于患者康复治疗过程中出现的肢体痉挛或疼痛、肺部及泌尿系统感染、抑郁或焦虑等症状时,酌情使用一些对症药物是很有必要的。⑧祖国传统和其他康复治疗:针灸、推拿和拳操也可选择用于脑胶质瘤患者的康复。患者在手术前后、放疗或化疗期间,应给予充分的营养支持和护理。
3.康复模式
目前推荐采用国内已广泛应用的脑卒中三级康复治疗体系。“一级康复”指患者早期在医院急诊室或神经外科的早期康复治疗;“二级康复”指患者在康复病房或康复中心进行的康复治疗;“三级康复”指在社区或家中继续进行的康复治疗。
五、多学科诊疗模式(MDT)
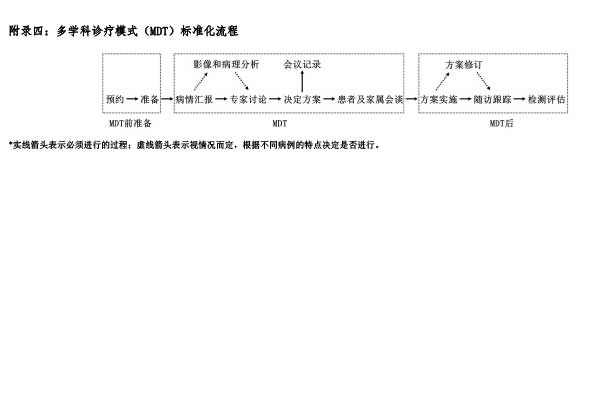
脑胶质瘤是需要多学科综合治疗的疾病,MDT应贯穿脑胶质瘤规范化诊疗的全过程196。脑胶质瘤MDT的目标是整合神经肿瘤相关多学科优势,以患者为中心,提供一站式医疗服务,实现最佳序贯治疗。
MDT组织形式包括MDT病例讨论会和MDT联合门诊等形式126,197。MDT可为脑胶质瘤患者带来诸多获益:①方便患者就医的同时提高了患者对既定诊治方案的依从性;②MDT的实施可提高患者进入临床试验的可能性;③实施MDT可改善患者预后;④此外,MDT有助于临床试验和科研的开展。MDT同时也为医疗团队带来诸多益处:①提高了医疗团队成员之间的沟通,增加了团队成员的学习和受教育机会;②实施MDT时团队成员共享决策,更易获得最佳实践和循证医学的建议;③MDT临床决策制定和治疗实施责任由成员们共同承担,可降低团队成员工作压力,减少医疗纠纷;④MDT还有利于科研工作的开展,提高医疗单位的学术水平。
MDT由相关专科医师和专业人员组成。推荐根据疾病诊治的不同阶段,以关键临床问题为导向,组织脑胶质瘤MDT成员实施。核心临床专业包括神经外科、医学影像、神经病理和分子病理、放射肿瘤学、神经肿瘤、神经内科。其他可选专业包括感染科、血液科、内分泌科、神经心理、神经康复、临床护理、生物样本库、姑息治疗等。MDT的组织机构包括:①召集人(首席专家):由权威专家担任,对MDT项目全权负责;②各科专家:专家一般应具有副高职称或高年资主治医师以上资格,有良好的神经肿瘤诊治基础并热心从事该事业。专家定期参与MDT讨论,并负责提供病例,准备资料等;③记录员:全程记录MDT,统计MDT病例的临床资料;④秘书(协调员):协助召集人进行MDT的全程组织;⑤MDT委员会:可考虑成立MDT委员会,制定MDT制度并监督MDT执行。MDT应根据亟待解决关键临床问题,设定每一期病例讨论会的召集人(首席专家)。召集人一般由患者的临床主诊科室的权威专家担任,主持并全程参与讨论。
对初次诊治患者,MDT实施路径包括讨论诊断及鉴别诊断,拟诊脑胶质瘤后决策是否手术及手术方式。对术后患者,获取组织标本,经过组织病理诊断和分子检测最终获得准确的整合病理报告,明确诊断脑胶质瘤,则讨论下一步治疗方案。如病理存疑,则讨论下一步措施(如转入其他相关科室治疗或观察)。在治疗及随访过程中,如有需要可再次提请MDT讨论,调整治疗方案,对可疑复发患者,需要讨论病变性质(如治疗反应、肿瘤进展)及下一步医疗措施。复发脑胶质瘤常规治疗无效且需要纳入新型药物临床试验的病例,建议进行MDT讨论。MDT应得到所属医院管理部门支持,并建立临床数据管理和疗效反馈制度。
六、附录
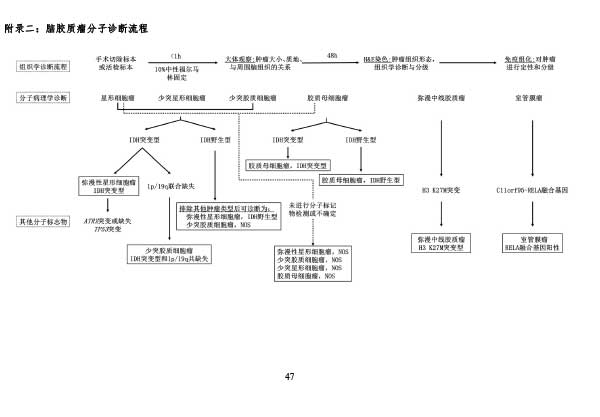
参考文献
[1]中国脑胶质瘤协作组. 中国脑胶质瘤分子诊疗指南. 中华神经外科杂志 2014;30:435-444.
[2]Jiang T, Mao Y, Ma W, et al. CGCG clinical practice guidelines for the management of adult diffuse gliomas. Cancer letters 2016;375:263-273.
[3]Dunet V, Pomoni A, Hottinger A, et al. Performance of 18F-FET versus 18F-FDG-PET for the diagnosis and grading of brain tumors: systematic review and meta-analysis. Neuro-oncology 2016;18:426-434.
[4]Kunz M, Thon N, Eigenbrod S, et al. Hot spots in dynamic (18)FET-PET delineate malignant tumor parts within suspected WHO grade II gliomas. Neuro-oncology 2011;13:307-316.
[5]Pafundi DH, Laack NN, Youland RS, et al. Biopsy validation of 18F-DOPA PET and biodistribution in gliomas for neurosurgical planning and radiotherapy target delineation: results of a prospective pilot study. Neuro-oncology 2013;15:1058-1067.
[6]Weller M, van den Bent M, Hopkins K, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol 2014;15:e395-403.
[7]Grosu AL, Weber WA, Franz M, et al. Reirradiation of recurrent high-grade gliomas using amino acid PET (SPECT)/CT/MRI image fusion to determine gross tumor volume for stereotactic fractionated radiotherapy. Int J Radiat Oncol Biol Phys 2005;63:511-519.
[8]Miwa K, Matsuo M, Ogawa S, et al. Re-irradiation of recurrent glioblastoma multiforme using 11C-methionine PET/CT/MRI image fusion for hypofractionated stereotactic radiotherapy by intensity modulated radiation therapy. Radiat Oncol 2014;9:181.
[9]Weber DC, Casanova N, Zilli T, et al. Recurrence pattern after [(18)F]fluoroethyltyrosine-positron emission tomography-guided radiotherapy for high-grade glioma: a prospective study. Radiother Oncol 2009;93:586-592.
[10]Tralins KS, Douglas JG, Stelzer KJ, et al. Volumetric analysis of 18F-FDG PET in glioblastoma multiforme: prognostic information and possible role in definition of target volumes in radiation dose escalation. J Nucl Med 2002;43:1667-1673.
[11]Giammarile F, Cinotti LE, Jouvet A, et al. High and low grade oligodendrogliomas (ODG): correlation of amino-acid and glucose uptakes using PET and histological classifications. Journal of neuro-oncology 2004;68:263-274.
[12]Manabe O, Hattori N, Yamaguchi S, et al. Oligodendroglial component complicates the prediction of tumour grading with metabolic imaging. Eur J Nucl Med Mol Imaging 2015;42:896-904.
[13]Hutterer M, Nowosielski M, Putzer D, et al. [18F]-fluoro-ethyl-L-tyrosine PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology 2013;15:341-351.
[14]Jansen NL, Schwartz C, Graute V, et al. Prediction of oligodendroglial histology and LOH 1p/19q using dynamic [(18)F]FET-PET imaging in intracranial WHO grade II and III gliomas. Neuro-oncology 2012;14:1473-1480.
[15]Moulin-Romsee G, D'Hondt E, de Groot T, et al. Non-invasive grading of brain tumours using dynamic amino acid PET imaging: does it work for 11C-methionine? Eur J Nucl Med Mol Imaging 2007;34:2082-2087.
[16]Popperl G, Kreth FW, Mehrkens JH, et al. FET PET for the evaluation of untreated gliomas: correlation of FET uptake and uptake kinetics with tumour grading. Eur J Nucl Med Mol Imaging 2007;34:1933-1942.
[17]Rapp M, Heinzel A, Galldiks N, et al. Diagnostic performance of 18F-FET PET in newly diagnosed cerebral lesions suggestive of glioma. J Nucl Med 2013;54:229-235.
[18]Wen PY, Macdonald DR, Reardon DA, et al. Updated response assessment criteria for high-grade gliomas: response assessment in neuro-oncology working group. J Clin Oncol 2010;28:1963-1972.
[19]Brandes AA, Tosoni A, Franceschi E, et al. Recurrence pattern after temozolomide concomitant with and adjuvant to radiotherapy in newly diagnosed patients with glioblastoma: correlation With MGMT promoter methylation status. J Clin Oncol 2009;27:1275-1279.
[20]Chen W, Silverman DH, Delaloye S, et al. 18F-FDOPA PET imaging of brain tumors: comparison study with 18F-FDG PET and evaluation of diagnostic accuracy. J Nucl Med 2006;47:904-911.
[21]Herrmann K, Czernin J, Cloughesy T, et al. Comparison of visual and semiquantitative analysis of 18F-FDOPA-PET/CT for recurrence detection in glioblastoma patients. Neuro-oncology 2014;16:603-609.
[22]Walter F, Cloughesy T, Walter MA, et al. Impact of 3,4-dihydroxy-6-18F-fluoro-L-phenylalanine PET/CT on managing patients with brain tumors: the referring physician's perspective. J Nucl Med 2012;53:393-398.
[23]Albert NL, Weller M, Suchorska B, et al. Response Assessment in Neuro-Oncology working group and European Association for Neuro-Oncology recommendations for the clinical use of PET imaging in gliomas. Neuro-oncology 2016;18:1199-1208.
[24]Voges J, Herholz K, Holzer T, et al. 11C-methionine and 18F-2-fluorodeoxyglucose positron emission tomography: a tool for diagnosis of cerebral glioma and monitoring after brachytherapy with 125I seeds. Stereotact Funct Neurosurg 1997;69:129-135.
[25]Wyss M, Hofer S, Bruehlmeier M, et al. Early metabolic responses in temozolomide treated low-grade glioma patients. Journal of neuro-oncology 2009;95:87-93.
[26]Singh D, Chan JM, Zoppoli P, et al. Transforming fusions of FGFR and TACC genes in human glioblastoma. Science 2012;337:1231-1235.
[27]Zhang W, Zhang J, Hoadley K, et al. miR-181d: a predictive glioblastoma biomarker that downregulates MGMT expression. Neuro-oncology 2012;14:712-719.
[28]Bao ZS, Chen HM, Yang MY, et al. RNA-seq of 272 gliomas revealed a novel, recurrent PTPRZ1-MET fusion transcript in secondary glioblastomas. Genome research 2014;24:1765-1773.
[28]Wu JS, Zhou LF, Tang WJ, et al. Clinical evaluation and follow-up outcome of diffusion tensor imaging-based functional neuronavigation: a prospective, controlled study in patients with gliomas involving pyramidal tracts. Neurosurgery 2007;61:935-948; discussion 948-939.
[29]Duffau H. Is supratotal resection of glioblastoma in noneloquent areas possible? World neurosurgery 2014;82:e101-103.
[31]Wu JS, Gong X, Song YY, et al. 3.0-T intraoperative magnetic resonance imaging-guided resection in cerebral glioma surgery: interim analysis of a prospective, randomized, triple-blind, parallel-controlled trial. Neurosurgery 2014;61 Suppl 1:145-154.
[32]Kumar A, Chandra PS, Sharma BS, et al. The role of neuronavigation-guided functional MRI and diffusion tensor tractography along with cortical stimulation in patients with eloquent cortex lesions. Br J Neurosurg 2014;28:226-233.
[33]Bello L, Gambini A, Castellano A, et al. Motor and language DTI Fiber Tracking combined with intraoperative subcortical mapping for surgical removal of gliomas. NeuroImage 2008;39:369-382.
[34]Stummer W, Pichlmeier U, Meinel T, et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol 2006;7:392-401.
[35]Pignatti F, van den Bent M, Curran D, et al. Prognostic factors for survival in adult patients with cerebral low-grade glioma. J Clin Oncol 2002;20:2076-2084.
[36]Ahmadi R, Dictus C, Hartmann C, et al. Long-term outcome and survival of surgically treated supratentorial low-grade glioma in adult patients. Acta Neurochir (Wien) 2009;151:1359-1365.
[37]Ius T, Isola M, Budai R, et al. Low-grade glioma surgery in eloquent areas: volumetric analysis of extent of resection and its impact on overall survival. A single-institution experience in 190 patients: clinical article. Journal of neurosurgery 2012;117:1039-1052.
[38]Simon M, Neuloh G, von Lehe M, et al. Insular gliomas: the case for surgical management. J Neurosurg 2009;110:685-695.
[39]Zinn PO, Colen RR, Kasper EM, et al. Extent of resection and radiotherapy in GBM: A 1973 to 2007 surveillance, epidemiology and end results analysis of 21,783 patients. Int J Oncol 2013;42:929-934.
[40]Kreth FW, Thon N, Simon M, et al. Gross total but not incomplete resection of glioblastoma prolongs survival in the era of radiochemotherapy. Ann Oncol 2013;24:3117-3123.
[41]Laws ER, Parney IF, Huang W, et al. Survival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project. J Neurosurg 2003;99:467-473.
[42]Sanai N, Polley MY, McDermott MW, et al. An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg 2011;115:3-8.
[43]McGirt MJ, Chaichana KL, Attenello FJ, et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery 2008;63:700-707; author reply 707-708.
[44]Smith JS, Chang EF, Lamborn KR, et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol 2008;26:1338-1345.
[45]中国脑胶质瘤协作组. 成人幕上低级别胶质瘤的手术治疗指南. 中华神经外科杂志 2016;32:652-658.
[46]Montemurro N, Perrini P, Blanco MO, et al. Second surgery for recurrent glioblastoma: A concise overview of the current literature. Clin Neurol Neurosurg 2016;142:60-64.
[47]Robin AM, Lee I, Kalkanis SN. Reoperation for Recurrent Glioblastoma Multiforme. Neurosurg Clin N Am 2017;28:407-428.
[48]Chang EF, Clark A, Smith JS, et al. Functional mapping-guided resection of low-grade gliomas in eloquent areas of the brain: improvement of long-term survival. Clinical article. J Neurosurg 2011;114:566-573.
[49]张忠, 江涛, 谢坚, et al. 术中功能定位切除辅助运动区低级别胶质瘤. 中华神经外科杂志 2008;24:35-38.
[50]张忠, 江涛, 谢坚, et al. 唤醒麻醉和术中功能定位切除语言区胶质瘤. 中华神经外科杂志 2007;23:643-645.
[51]Ius T, Angelini E, Thiebaut de Schotten M, et al. Evidence for potentials and limitations of brain plasticity using an atlas of functional resectability of WHO grade II gliomas: towards a "minimal common brain". NeuroImage 2011;56:992-1000.
[52]Yordanova YN, Moritz-Gasser S, Duffau H. Awake surgery for WHO Grade II gliomas within "noneloquent" areas in the left dominant hemisphere: toward a "supratotal" resection. Clinical article. Journal of neurosurgery 2011;115:232-239.
[53]白红民, 江涛, 王伟民, et al. 类别特异性命名区脑定位的临床研究. 中华神经外科杂志 2010;26:1067-1070.
[54]Wang X, Wang YY, Jiang T, et al. Direct evidence of the left caudate's role in bilingual control: an intra-operative electrical stimulation study. Neurocase 2013;19:462-469.
[55]Hervey-Jumper SL, Li J, Lau D, et al. Awake craniotomy to maximize glioma resection: methods and technical nuances over a 27-year period. Journal of neurosurgery 2015;123:325-339.
[56]Jingshan L, Shengyu F, Xing F, et al. Morphometry of the Hand Knob Region and Motor Function Change in Eloquent Area Glioma Patients. Clin Neuroradiol 2018.
[57]Moller M, Freund M, Greiner C, et al. Real time fMRI: a tool for the routine presurgical localisation of the motor cortex. Eur Radiol 2005;15:292-295.
[58]Xie J, Chen XZ, Jiang T, et al. Preoperative blood oxygen level-dependent functional magnetic resonance imaging in patients with gliomas involving the motor cortical areas. Chinese medical journal 2008;121:631-635.
[59]Belliveau JW, Kennedy DN, Jr., McKinstry RC, et al. Functional mapping of the human visual cortex by magnetic resonance imaging. Science 1991;254:716-719.
[60]Fang S, Liang J, Qian T, et al. Anatomic Location of Tumor Predicts the Accuracy of Motor Function Localization in Diffuse Lower-Grade Gliomas Involving the Hand Knob Area. AJNR Am J Neuroradiol 2017;38:1990-1997.
[61]Hall WA, Liu H, Truwit CL. Functional magnetic resonance imaging-guided resection of low-grade gliomas. Surgical neurology 2005;64:20-27; discussion 27.
[62]Jack CR, Jr., Thompson RM, Butts RK, et al. Sensory motor cortex: correlation of presurgical mapping with functional MR imaging and invasive cortical mapping. Radiology 1994;190:85-92.
[63]Tarapore PE, Martino J, Guggisberg AG, et al. Magnetoencephalographic imaging of resting-state functional connectivity predicts postsurgical neurological outcome in brain gliomas. Neurosurgery 2012;71:1012-1022.
[64]Qiu TM, Yan CG, Tang WJ, et al. Localizing hand motor area using resting-state fMRI: validated with direct cortical stimulation. Acta neurochirurgica 2014;156:2295-2302.
[65]Gunnarsson T, Olafsson E, Sighvatsson V, et al. Surgical treatment of patients with low-grade astrocytomas and medically intractable seizures. Acta neurologica Scandinavica 2002;105:289-292.
[66]中国脑胶质瘤协作组. 唤醒状态下切除脑功能区胶质瘤手术技术指南(2014版). 中国微侵袭神经外科杂志 2014;19:479-485.
[67]Du G, Zhou L, Mao Y. Neuronavigator-guided glioma surgery. Chin Med J (Engl) 2003;116:1484-1487.
[68]Nimsky C, Ganslandt O, Merhof D, et al. Intraoperative visualization of the pyramidal tract by diffusion-tensor-imaging-based fiber tracking. Neuroimage 2006;30:1219-1229.
[69]Nimsky C, Ganslandt O, Buchfelder M, et al. Intraoperative visualization for resection of gliomas: the role of functional neuronavigation and intraoperative 1.5 T MRI. Neurological research 2006;28:482-487.
[70]吴劲松, 毛颖, 姚成军, et al. 术中磁共振影像神经导航治疗脑胶质瘤的临床初步应用(附61例分析). 中国微侵袭神经外科杂志 2007;12:105-109.
[71]Duffau H. Surgery of low-grade gliomas: towards a 'functional neurooncology'. Curr Opin Oncol 2009;21:543-549.
[72]Bello L, Gallucci M, Fava M, et al. Intraoperative subcortical language tract mapping guides surgical removal of gliomas involving speech areas. Neurosurgery 2007;60:67-80; discussion 80-62.
[73]Kim SS, McCutcheon IE, Suki D, et al. Awake craniotomy for brain tumors near eloquent cortex: correlation of intraoperative cortical mapping with neurological outcomes in 309 consecutive patients. Neurosurgery 2009;64:836-845; discussion 345-836.
[74]De Benedictis A, Moritz-Gasser S, Duffau H. Awake mapping optimizes the extent of resection for low-grade gliomas in eloquent areas. Neurosurgery 2010;66:1074-1084; discussion 1084.
[75]Talacchi A, Turazzi S, Locatelli F, et al. Surgical treatment of high-grade gliomas in motor areas. The impact of different supportive technologies: a 171-patient series. Journal of neuro-oncology 2010;100:417-426.
[76]Tate MC, Herbet G, Moritz-Gasser S, et al. Probabilistic map of critical functional regions of the human cerebral cortex: Broca's area revisited. Brain 2014;137:2773-2782.
[77]Roux FE, Dufor O, Lauwers-Cances V, et al. Electrostimulation mapping of spatial neglect. Neurosurgery 2011;69:1218-1231.
[78]Ilmberger J, Ruge M, Kreth FW, et al. Intraoperative mapping of language functions: a longitudinal neurolinguistic analysis. J Neurosurg 2008;109:583-592.
[79]Duffau H, Capelle L, Sichez N, et al. Intraoperative mapping of the subcortical language pathways using direct stimulations. An anatomo-functional study. Brain 2002;125:199-214.
[80]Magill ST, Han SJ, Li J, et al. Resection of primary motor cortex tumors: feasibility and surgical outcomes. Journal of neurosurgery 2017:1-12.
[81]Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery 2008;62:753-764; discussion 264-756.
[82]Sanai N, Berger MS. Operative techniques for gliomas and the value of extent of resection. Neurotherapeutics 2009;6:478-486.
[83]Zhang Z, Jiang T, Xie J, et al. Surgical strategies for glioma involving language areas. Chinese medical journal 2008;121:1800-1805.
[84]Lima GLO, Dezamis E, Corns R, et al. Surgical resection of incidental diffuse gliomas involving eloquent brain areas. Rationale, functional, epileptological and oncological outcomes. Neurochirurgie 2017;63:250-258.
[85]Xia L, Fang C, Chen G, et al. Relationship between the extent of resection and the survival of patients with low-grade gliomas: a systematic review and meta-analysis. BMC Cancer 2018;18:48.
[86]Jiang B, Chaichana K, Veeravagu A, et al. Biopsy versus resection for the management of low-grade gliomas. Cochrane Database Syst Rev 2017;4:CD009319.
[87]Englot DJ, Han SJ, Berger MS, et al. Extent of surgical resection predicts seizure freedom in low-grade temporal lobe brain tumors. Neurosurgery 2012;70:921-928; discussion 928.
[88]You G, Sha ZY, Yan W, et al. Seizure characteristics and outcomes in 508 Chinese adult patients undergoing primary resection of low-grade gliomas: a clinicopathological study. Neuro-oncology 2012;14:230-241.
[89]Clusmann H, Kral T, Gleissner U, et al. Analysis of different types of resection for pediatric patients with temporal lobe epilepsy. Neurosurgery 2004;54:847-859; discussion 859-860.
[90]Wang YY, Zhang T, Li SW, et al. Mapping p53 mutations in low-grade glioma: a voxel-based neuroimaging analysis. AJNR American journal of neuroradiology 2015;36:70-76.
[91]Zaatreh MM, Spencer DD, Thompson JL, et al. Frontal lobe tumoral epilepsy: clinical, neurophysiologic features and predictors of surgical outcome. Epilepsia 2002;43:727-733.
[92]Wray CD, McDaniel SS, Saneto RP, et al. Is postresective intraoperative electrocorticography predictive of seizure outcomes in children? J Neurosurg Pediatr 2012;9:546-551.
[93]Yao PS, Zheng SF, Wang F, et al. Surgery guided with intraoperative electrocorticography in patients with low-grade glioma and refractory seizures. Journal of neurosurgery 2018;128:840-845.
[94]Pereira LC, Oliveira KM, L'Abbate GL, et al. Outcome of fully awake craniotomy for lesions near the eloquent cortex: analysis of a prospective surgical series of 79 supratentorial primary brain tumors with long follow-up. Acta Neurochir (Wien) 2009;151:1215-1230.
[95]Lima GL, Duffau H. Is there a risk of seizures in "preventive" awake surgery for incidental diffuse low-grade gliomas? Journal of neurosurgery 2015;122:1397-1405.
[96]Boetto J, Bertram L, Moulinie G, et al. Low Rate of Intraoperative Seizures During Awake Craniotomy in a Prospective Cohort with 374 Supratentorial Brain Lesions: Electrocorticography Is Not Mandatory. World neurosurgery 2015;84:1838-1844.
[97]Vecht CJ, Kerkhof M, Duran-Pena A. Seizure prognosis in brain tumors: new insights and evidence-based management. The oncologist 2014;19:751-759.
[98]Di Bonaventura C, Albini M, D'Elia A, et al. Epileptic seizures heralding a relapse in high grade gliomas. Seizure 2017;51:157-162.
[99]Kahlenberg CA, Fadul CE, Roberts DW, et al. Seizure prognosis of patients with low-grade tumors. Seizure 2012;21:540-545.
[100]Sun MZ, Oh T, Ivan ME, et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of neurosurgery 2015;122:1144-1150.
[101]Merchant TE, Kun LE, Wu S, et al. Phase II trial of conformal radiation therapy for pediatric low-grade glioma. J Clin Oncol 2009;27:3598-3604.
[102]Cabrera AR, Kirkpatrick JP, Fiveash JB, et al. Radiation therapy for glioblastoma: Executive summary of an American Society for Radiation Oncology Evidence-Based Clinical Practice Guideline. Pract Radiat Oncol 2016;6:217-225.
[103]National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Central Nervous System Cancers (Version 1.2018). 2018.
[104]Chiesa S, et al. PD-0516: Edema or not edema: this the matter in glioblastoma CTV! Hypothesis from two sequential phase II studies. Radiotherapy and Oncology 2014;111:S203-S204.
[105]Gilbert MR, Wang M, Aldape KD, et al. Dose-dense temozolomide for newly diagnosed glioblastoma: a randomized phase III clinical trial. J Clin Oncol 2013;31:4085-4091.
[106]Chang EL, Akyurek S, Avalos T, et al. Evaluation of peritumoral edema in the delineation of radiotherapy clinical target volumes for glioblastoma. Int J Radiat Oncol Biol Phys 2007;68:144-150.
[107]Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England journal of medicine 2005;352:987-996.
[108]Hegi ME, Diserens AC, Gorlia T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. The New England journal of medicine 2005;352:997-1003.
[109]van den Bent MJ, Brandes AA, Taphoorn MJ, et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 2013;31:344-350.
[110]Cairncross G, Wang M, Shaw E, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 2013;31:337-343.
[111]Intergroup Radiation Therapy Oncology Group T, Cairncross G, Berkey B, et al. Phase III trial of chemotherapy plus radiotherapy compared with radiotherapy alone for pure and mixed anaplastic oligodendroglioma: Intergroup Radiation Therapy Oncology Group Trial 9402. J Clin Oncol 2006;24:2707-2714.
[112]Yang P, Cai J, Yan W, et al. Classification based on mutations of TERT promoter and IDH characterizes subtypes in grade II/III gliomas. Neuro-oncology 2016;18:1099-1108.
[113]Daniels TB, Brown PD, Felten SJ, et al. Validation of EORTC prognostic factors for adults with low-grade glioma: a report using intergroup 86-72-51. Int J Radiat Oncol Biol Phys 2011;81:218-224.
[114]Smith JS, Perry A, Borell TJ, et al. Alterations of chromosome arms 1p and 19q as predictors of survival in oligodendrogliomas, astrocytomas, and mixed oligoastrocytomas. J Clin Oncol 2000;18:636-645.
[115]Nabors LB, Portnow J, Ammirati M, et al. NCCN Guidelines Insights: Central Nervous System Cancers, Version 1.2017. J Natl Compr Canc Netw 2017;15:1331-1345.
[116]Shaw EG, Berkey B, Coons SW, et al. Recurrence following neurosurgeon-determined gross-total resection of adult supratentorial low-grade glioma: results of a prospective clinical trial. Journal of neurosurgery 2008;109:835-841.
[117]Karim AB, Maat B, Hatlevoll R, et al. A randomized trial on dose-response in radiation therapy of low-grade cerebral glioma: European Organization for Research and Treatment of Cancer (EORTC) Study 22844. Int J Radiat Oncol Biol Phys 1996;36:549-556.
[118]Shaw E, Arusell R, Scheithauer B, et al. Prospective randomized trial of low- versus high-dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a North Central Cancer Treatment Group/Radiation Therapy Oncology Group/Eastern Cooperative Oncology Group study. J Clin Oncol 2002;20:2267-2276.
[119]Klein M, Heimans JJ, Aaronson NK, et al. Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas: a comparative study. Lancet 2002;360:1361-1368.
[120]Mansur DB, Perry A, Rajaram V, et al. Postoperative radiation therapy for grade II and III intracranial ependymoma. Int J Radiat Oncol Biol Phys 2005;61:387-391.
[121]Taylor RE. Review of radiotherapy dose and volume for intracranial ependymoma. Pediatr Blood Cancer 2004;42:457-460.
[122]Rodriguez D, Cheung MC, Housri N, et al. Outcomes of malignant CNS ependymomas: an examination of 2408 cases through the Surveillance, Epidemiology, and End Results (SEER) database (1973-2005). J Surg Res 2009;156:340-351.
[123]Swanson EL, Amdur RJ, Morris CG, et al. Intracranial ependymomas treated with radiotherapy: long-term results from a single institution. Journal of neuro-oncology 2011;102:451-457.
[124]Vanuytsel LJ, Bessell EM, Ashley SE, et al. Intracranial ependymoma: long-term results of a policy of surgery and radiotherapy. Int J Radiat Oncol Biol Phys 1992;23:313-319.
[125]Merchant TE, Li C, Xiong X, et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol 2009;10:258-266.
[126]《中国中枢神经系统胶质瘤诊断与治疗指南》编写组. 中国中枢神经系统胶质瘤诊断与治疗指南(2015). 中华医学杂志 2016;96:485-509.
[127]Fogh SE, Andrews DW, Glass J, et al. Hypofractionated stereotactic radiation therapy: an effective therapy for recurrent high-grade gliomas. J Clin Oncol 2010;28:3048-3053.
[128]Cabrera AR, Cuneo KC, Desjardins A, et al. Concurrent stereotactic radiosurgery and bevacizumab in recurrent malignant gliomas: a prospective trial. Int J Radiat Oncol Biol Phys 2013;86:873-879.
[129]Lawrence YR, Li XA, el Naqa I, et al. Radiation dose-volume effects in the brain. Int J Radiat Oncol Biol Phys 2010;76:S20-27.
[130]Minniti G, Armosini V, Salvati M, et al. Fractionated stereotactic reirradiation and concurrent temozolomide in patients with recurrent glioblastoma. Journal of neuro-oncology 2011;103:683-691.
[131]Boothe D, Young R, Yamada Y, et al. Bevacizumab as a treatment for radiation necrosis of brain metastases post stereotactic radiosurgery. Neuro-oncology 2013;15:1257-1263.
[132]Minniti G, Agolli L, Falco T, et al. Hypofractionated stereotactic radiotherapy in combination with bevacizumab or fotemustine for patients with progressive malignant gliomas. Journal of neuro-oncology 2015;122:559-566.
[133]Cuneo KC, Vredenburgh JJ, Sampson JH, et al. Safety and efficacy of stereotactic radiosurgery and adjuvant bevacizumab in patients with recurrent malignant gliomas. Int J Radiat Oncol Biol Phys 2012;82:2018-2024.
[134]Douw L, Klein M, Fagel SS, et al. Cognitive and radiological effects of radiotherapy in patients with low-grade glioma: long-term follow-up. Lancet Neurol 2009;8:810-818.
[135]Postma TJ, Klein M, Verstappen CC, et al. Radiotherapy-induced cerebral abnormalities in patients with low-grade glioma. Neurology 2002;59:121-123.
[136]Chamberlain MC, Glantz MJ, Chalmers L, et al. Early necrosis following concurrent Temodar and radiotherapy in patients with glioblastoma. Journal of neuro-oncology 2007;82:81-83.
[137]Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 2009;10:459-466.
[138]Wolff JE, Berrak S, Koontz Webb SE, et al. Nitrosourea efficacy in high-grade glioma: a survival gain analysis summarizing 504 cohorts with 24193 patients. Journal of neuro-oncology 2008;88:57-63.
[139]van den Bent MJ, Baumert B, Erridge SC, et al. Interim results from the CATNON trial (EORTC study 26053-22054) of treatment with concurrent and adjuvant temozolomide for 1p/19q non-co-deleted anaplastic glioma: a phase 3, randomised, open-label intergroup study. Lancet 2017;390:1645-1653.
[140]Roa W, Brasher PM, Bauman G, et al. Abbreviated course of radiation therapy in older patients with glioblastoma multiforme: a prospective randomized clinical trial. J Clin Oncol 2004;22:1583-1588.
[141]Malmstrom A, Gronberg BH, Marosi C, et al. Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma: the Nordic randomised, phase 3 trial. Lancet Oncol 2012;13:916-926.
[142]Gornet MK, Buckner JC, Marks RS, et al. Chemotherapy for advanced CNS ependymoma. Journal of neuro-oncology 1999;45:61-67.
[143]Ruda R, Bosa C, Magistrello M, et al. Temozolomide as salvage treatment for recurrent intracranial ependymomas of the adult: a retrospective study. Neuro-oncology 2016;18:261-268.
[144]Shaw EG, Wang M, Coons SW, et al. Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult low-grade glioma: initial results of RTOG 9802. J Clin Oncol 2012;30:3065-3070.
[145]Pouratian N, Gasco J, Sherman JH, et al. Toxicity and efficacy of protracted low dose temozolomide for the treatment of low grade gliomas. Journal of neuro-oncology 2007;82:281-288.
[146]Kesari S, Schiff D, Drappatz J, et al. Phase II study of protracted daily temozolomide for low-grade gliomas in adults. Clin Cancer Res 2009;15:330-337.
[147]Nicholson HS, Kretschmar CS, Krailo M, et al. Phase 2 study of temozolomide in children and adolescents with recurrent central nervous system tumors: a report from the Children's Oncology Group. Cancer 2007;110:1542-1550.
[148]Perry JR, Rizek P, Cashman R, et al. Temozolomide rechallenge in recurrent malignant glioma by using a continuous temozolomide schedule: the "rescue" approach. Cancer 2008;113:2152-2157.
[149]Triebels VH, Taphoorn MJ, Brandes AA, et al. Salvage PCV chemotherapy for temozolomide-resistant oligodendrogliomas. Neurology 2004;63:904-906.
[150]Massimino M, Spreafico F, Riva D, et al. A lower-dose, lower-toxicity cisplatin-etoposide regimen for childhood progressive low-grade glioma. Journal of neuro-oncology 2010;100:65-71.
[151]Moghrabi A, Friedman HS, Ashley DM, et al. Phase II study of carboplatin (CBDCA) in progressive low-grade gliomas. Neurosurg Focus 1998;4:e3.
[152]Brandes AA, Basso U, Vastola F, et al. Carboplatin and teniposide as third-line chemotherapy in patients with recurrent oligodendroglioma or oligoastrocytoma: a phase II study. Ann Oncol 2003;14:1727-1731.
[153]Yung WK, Prados MD, Yaya-Tur R, et al. Multicenter phase II trial of temozolomide in patients with anaplastic astrocytoma or anaplastic oligoastrocytoma at first relapse. Temodal Brain Tumor Group. J Clin Oncol 1999;17:2762-2771.
[