发布时间:2018年10月30日 17:31:17 来源:振东健康网
(一)专门通道审评审批的品种范围
近十年在美国、欧盟或日本上市但未在我国境内上市的新药,符合下列情形之一的:
1、用于治疗罕见病的药品;
2、用于防治严重危及生命疾病,且尚无有效治疗或预防手段的药品;
3、用于防治严重危及生命疾病,且具有明显临床优势的药品。
(二)品种遴选
国家药品监督管理局、国家卫生健康委员会按照上述品种范围,组织开展品种遴选。遴选工作坚持以临床价值为导向,遵循公开、公平、公正的原则,具体程序如下:
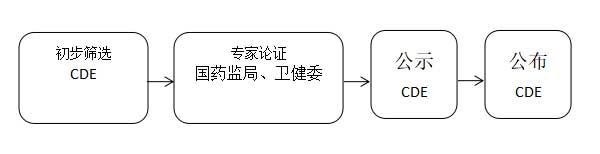
(三)审评审批程序
凡列入专门通道审评审批品种名单的,其在美国、欧盟或日本首次上市的持证商经研究认为不存在人种差异的,可按以下程序开展注册工作:
1、沟通交流。申请人应按照《药物研发与技术审评审批沟通交流管理办法》要求向药审中心提出Ⅰ类会议申请。
2、申请。经沟通交流形成一致意见的,申请人应按申报资料要求(见附)准备资料并根据以下情况提出申请:
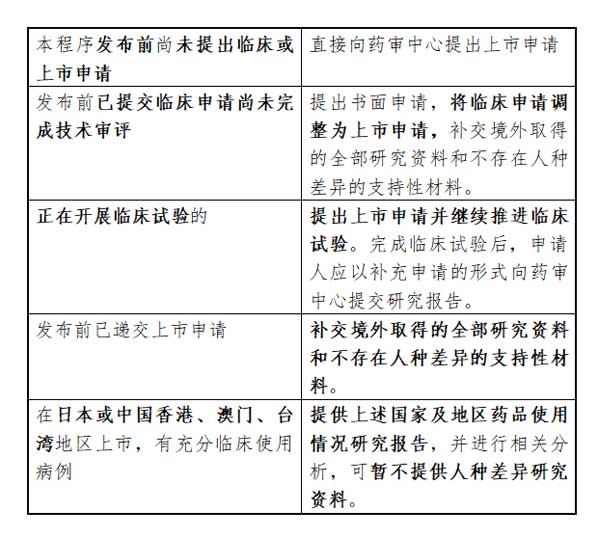
申请人应按要求同步向中国食品药品检定研究院提交用于药品标准复核检验的相关资料、检验用样品、标准物质、实验材料等。具体要求由中国食品药品检定研究院另行制定。
3、审评。药审中心建立专门通道开展审评,审评期限:
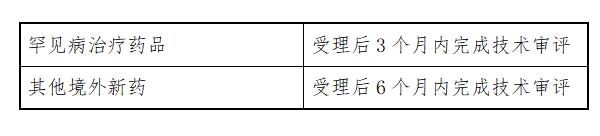
【注】上述时限不包括申请人补充资料所占用的时间
审评期间需要申请人补充资料的,可在专业审评阶段通知企业补充资料;申请人也可在进行沟通交流后,采取滚动式提交资料的方式,通过申请人之窗及时补充资料。
4、审批。国家药品监督管理局在接到药审中心报送的审核材料后10个工作日作出审批决定。
详见链接:
http://www.nmpa.gov.cn/WS04/CL2138/331475.html
