发布时间:2018年09月30日 11:01:36 来源:振东健康网
公告要求药品上市许可持有人(包括持有药品批准文号的药品生产企业,以下简称持有人)做到以下几点:
1、持有人应当建立健全药品不良反应监测体系。
(1)自建专门机构:指定药品不良反应监测负责人,设立专门机构,配备专职人员,建立健全相关管理制度,直接报告药品不良反应,持续开展药品风险获益评估,采取有效的风险控制措施。
(2)委托第三方机构:持有人委托其他公司或者机构开展药品不良反应监测工作,双方应当签订委托协议。持有人应当配备专职人员做好对受托方的监督和管理等工作,相应法律责任由持有人承担。
(3)进口药品委托代理人:进口药品持有人应当指定在我国境内设立的代表机构或者指定我国境内企业法人作为代理人,具体承担进口药品不良反应监测、评价、风险控制等工作。持有人及其代理人应当接受药品监督管理部门的监督检查。
2、持有人应当及时报告药品不良反应。
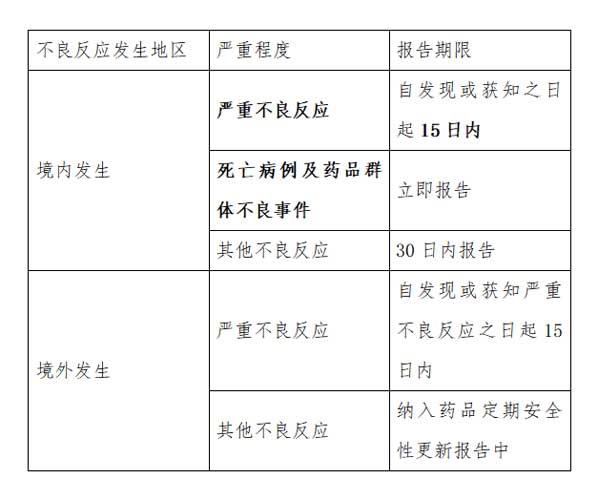
3、持有人应当报告获知的所有不良反应。
持有人应当按照可疑即报原则,直接通过国家药品不良反应监测系统报告发现或获知的药品不良反应。
报告范围包括患者使用药品出现的与用药目的无关且无法排除与药品存在相关性的所有有害反应,其中包括因药品质量问题引起的或者可能与超适应症用药、超剂量用药、禁忌症用药等相关的有害反应。
4、持有人应当加强不良反应监测数据的分析评价。
持有人应当汇总年度情况,包括企业年度药品不良反应监测体系运行情况、不良反应报告情况、风险识别与控制情况、上市后研究情况等信息,并于每年3月31日前向省级药品不良反应监测机构提交上一年度总结报告。此外,持有人应当按规定要求做好药品定期安全性更新报告的撰写及上报工作。
5、持有人应当主动采取有效的风险控制措施。
(1)发现说明书未载明的不良反应,应当及时进行分析评价。
(2)对需要提示患者和医务人员的安全性信息及时修改说明书和标签,开展必要的风险沟通;
(3)对存在严重安全风险的品种,应当制定并实施风险控制计划,采取限制药品使用,主动开展上市后研究,暂停药品生产、销售、使用或者召回等风险控制措施;
(4)对评估认为风险大于获益的品种,应当主动申请注销药品批准证明文件。
(5)风险控制措施应当向省级药品监督管理部门报告,
(6)对于持有人采取的修改说明书,以及暂停药品生产、销售、使用或者召回等风险控制措施,持有人应当主动向社会公布。
6、违规处罚标准
持有人未建立有效的药品不良反应监测体系,未指定药品不良反应监测负责人,未依规定建立专门机构、配备专职人员,未建立健全相关管理制度的,由省级药品监督管理部门依法予以查处。持有人严重违反相关规定、不能控制药品安全风险的,由省级药品监督管理部门责令暂停销售;持有人完成整改、经省级药品监督管理部门确认符合要求后,方可恢复销售。
持有人隐瞒不报、逾期未报告、提供虚假报告的,相关不良反应通过其他途径报告并经规定的程序核实,由省级药品监督管理部门依法采取警告、罚款等措施;隐瞒不报、逾期未报告造成严重人身伤害、死亡或者造成恶劣影响的,责令暂停相关产品销售,直至依法撤销药品批准证明文件。
持有人风险信息公布不及时、不完整、不准确的,由省级药品监督管理部门责令其完整准确公布信息。情节严重导致不能控制药品安全风险的,由省级药品监督管理部门责令其暂停相关产品销售。持有人整改后完整准确公布信息的,经省级药品监督管理部门检查确认符合要求,方可恢复销售。
详见链接:
http://www.nmpa.gov.cn/WS04/CL2138/331214.html
