发布时间:2018年11月23日 17:14:04 来源:振东健康网
11月23日,CDE发布消息,为落实国家药品监督管理局党组进一步加快一致性评价工作的要求,服务企业开展一致性评价的工作,国家局仿制药质量与疗效一致性评价办公室及药审中心、各省局共同于2018年10月29日-30日举办了仿制药一致性评价沟通交流讨论会。
针对当前一致性评价相关工作进展、企业研究存在的问题、一致性评价研究与申报资料整理规范、一致性评价审评品种技术问题及案例分析、企业一致性评价组织管理经验分享、通过一致性评价品种上市后持续合规等问题进行了沟通交流。
12个视频文件如下:
1.一致性评价工作介绍
2.一致性评价品种合规工作
3.一致性评价品种说明书撰写与审核
4.一致性评价品种受理审查工作
5.一致性评价生产现场检查工作
6.仿制药口服固体制剂质量和疗效一致性评价药学研究关键技术要求和常见问题
7.仿制药口服固体制剂质量和疗效一致性评价药学审评案例分析
8.BE审评工作
9.一致性评价BE案例分析
10.高变异品种BE指导原则介绍
11.一致性评价经验分享(1)
12.一致性评价经验分享(2)
限于篇幅,以下是部分内容(含截图):
1、目前的成绩
(1)现已完成评价127个品种,其中289基药品种61个。
(2)289基药品种涉及的1694家药品生产企业均已不同程度地开展了研究,现有112个品种完成了生物等效性试验备案,企业完成试验后将提出一致性评价申请。
(3)批准文号较多的品种,企业有意愿放弃评价的有2335个批准文号。
2、289品种下一步计划

3、药品管理法修订计划
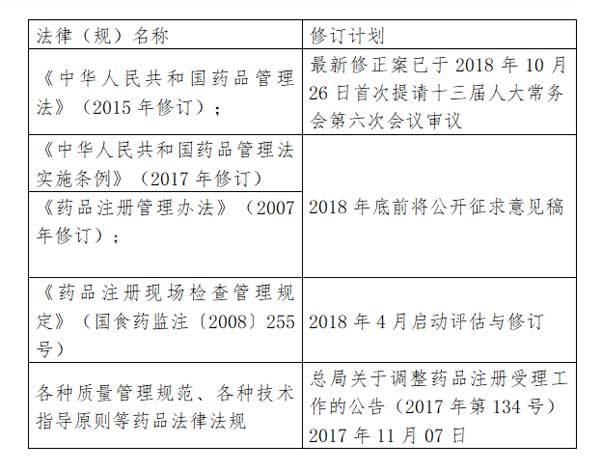
4、现场检查情况
截至2018年10月19日,已受理一致性评价申请447件(177个品种),其中289品种申请181件(64个品种)。已完成九批现场检查,正在进行第十批现场检查。检查共涉及109个品种、131个受理号、76家企业。
前九批检查共对72个品种(91个受理号)进行了抽样,其中18个品种检验报告已到达CDE,其余品种抽样样品仍在企业封存。
详见链接:
http://www.cde.org.cn/news.do?method=largeInfo&id=314756
