发布时间:2018年08月24日 09:30:38 来源:振东健康网
乳腺癌是女性常见的恶性肿瘤之一,发病率位居女性恶性肿瘤的首位,严重危害妇女的身心健康。目前,通过采用综合治疗手段,乳腺癌已成为疗效最佳的实体肿瘤之一。
为进一步规范我国乳腺癌诊疗行为,提高医疗机构乳腺癌诊疗水平,改善乳腺癌患者预后,保障医疗质量和医疗安全,特制定本规范。
一、乳腺癌筛查
乳腺癌筛查是指通过有效、简便、经济的乳腺检查措施,在无症状妇女中识别和发现具有进展潜能的癌前病变患者以及早期浸润性癌患者,以期早期发现、早期诊断及早期治疗,其最终目的是降低人群乳腺癌的死亡率。
筛查分为群体筛查(mass screening)和机会性筛查(opportunistic screening)。群体筛查是指在辖区或机构有组织、有计划地组织适龄妇女进行筛查;机会性筛查是指医疗保健机构结合门诊常规工作提供乳腺癌筛查服务。
妇女参加乳腺癌筛查的起始年龄:机会性筛查一般建议40岁开始,但对于乳腺癌高危人群可将筛查起始年龄提前到40岁以前。群体筛查国内暂无推荐年龄,国际上推荐40~50岁开始,目前国内开展的群体筛查采用的年龄均属于研究或探索性质,缺乏严格随机对照研究的不同年龄成本效益分析数据。
(一)一般风险人群妇女乳腺癌筛查策略
1.20~39岁
(1)每月1次乳腺自我检查。
(2)每1-3年1次临床检查。
2.40~69岁
(1)适合机会性筛查和群体性筛查。
(2)每1~2年1次乳腺X线检查(条件不具备时,可选择乳腺超声检查)。
(3)对致密型乳腺(腺体为c型或d型)推荐与超声检查联合。
(4)每月1次乳腺自我检查。
(5)每年1次临床检查。
3.70岁以上
(1)机会性筛查(有症状或可疑体征时进行影像学检查)。
(2)每月1次乳腺自我检查。
(3)每年1次临床检查。
(二)高危人群乳腺癌筛查策略
建议对乳腺癌高危人群提前进行筛查(小于40岁),筛查间期推荐每年1次,筛查手段除了应用一般人群乳腺X线检查之外,还可以应用MRI等影像学手段。
乳腺癌高危人群符合以下3个条件,即①有明显的乳腺癌遗传倾向者(见下段基因检测标准)②既往有乳腺导管或小叶不典型增生或小叶原位癌的患者③既往行胸部放疗。
遗传性乳腺癌-卵巢癌综合征基因检测标准如下[a,b]。
(1)具有血缘关系的亲属中有BRCA1/BRCA2基因突变的携带者。
(2)符合以下1个或多个条件的乳腺癌患者[c]:①发病年龄≤45岁;②发病年龄≤50岁并且有1个及以上具有血缘关系的近亲[d]也为发病年龄≤50岁的乳腺癌患者,和(或)1个及以上的近亲为任何年龄的卵巢上皮癌/输卵管癌/原发性腹膜癌患者;③单个个体患2个原发性乳腺癌[e],并且首次发病年龄≤50岁;④发病年龄不限,同时2个或2个以上具有血缘关系的近亲患有任何发病年龄的乳腺癌和(或)卵巢上皮癌、输卵管癌、原发性腹膜癌;⑤具有血缘关系的男性近亲患有乳腺癌;⑥合并有卵巢上皮癌、输卵管癌、原发性腹膜癌的既往史。
(3)卵巢上皮癌、输卵管癌、原发性腹膜癌患者。
(4)男性乳腺癌患者。
(5)具有以下家族史:①具有血缘关系的一级或二级亲属中符合以上任何条件;②具有血缘关系的三级亲属中有2个或2个以上乳腺癌患者(至少1个发病年龄≤50岁)和(或)卵巢上皮癌/输卵管癌/原发性腹膜癌患者。
注:a.符合1个或多个条件提示可能为遗传性乳腺癌-卵巢癌综合征,有必要进行专业性评估。当审查患者的家族史时,父系和母系亲属的患癌情况应该分开考虑。早发性乳腺癌和(或)任何年龄的卵巢上皮癌、输卵管癌、原发性腹膜癌提示可能为遗传性乳腺癌-卵巢癌综合征。在一些遗传性乳腺癌-卵巢癌综合征的家系中,还包括前列腺癌、胰腺癌、胃癌和黑素瘤。b.其他考虑因素:家族史有限的个体,例如女性一级或二级亲属<2个,或者女性亲属的年龄>45岁,在这种情况下携带突变的可能性往往会被低估。对发病年龄≤40岁的三阴性乳腺癌患者可考虑进行BRCA1/2基因突变的检测。c.乳腺癌包括浸润性癌和导管内癌。d.近亲是指一级、二级和三级亲属。e.2个原发性乳腺癌包括双侧乳腺癌或者同侧乳腺的2个或多个明确的不同来源的原发性乳腺癌。
二、诊断
应当结合患者的临床表现、体格检查、影像学检查、组织病理学等进行乳腺癌的诊断和鉴别诊断。
(一)临床表现
早期乳腺癌不具备典型症状和体征,不易引起患者重视,常通过体检或乳腺癌筛查发现。以下为乳腺癌的典型体征,多在癌症中期和晚期出现。
1.乳腺肿块
80%的乳腺癌患者以乳腺肿块首诊。患者常无意中发现肿块,多为单发,质硬,边缘不规则,表面欠光滑。大多数乳腺癌为无痛性肿块,仅少数伴有不同程度的隐痛或刺痛。
2.乳头溢液
非妊娠期从乳头流出血液、浆液、乳汁、脓液,或停止哺乳半年以上仍有乳汁流出者,称为乳头溢液。引起乳头溢液的原因很多,常见的疾病有导管内乳头状瘤、乳腺增生、乳腺导管扩张症和乳腺癌。单侧单孔的血性溢液应进一步行乳管镜检查,若伴有乳腺肿块更应重视。
3.皮肤改变
乳腺癌引起皮肤改变可出现多种体征,最常见的是肿瘤侵犯乳房悬韧带(库珀韧带,Cooper ligament)后与皮肤粘连,出现酒窝征。若癌细胞阻塞了真皮淋巴管,则会出现橘皮样改变。乳腺癌晚期,癌细胞沿淋巴管、腺管或纤维组织浸润到皮内并生长,形成皮肤卫星结节。
4.乳头、乳晕异常
肿瘤位于或接近乳头深部,可引起乳头回缩。肿瘤距乳头较远,乳腺内的大导管受到侵犯而短缩时,也可引起乳头回缩或抬高。乳头乳晕湿疹样癌即佩吉特病(Paget disease),表现为乳头皮肤瘙痒、糜烂、破溃、结痂、脱屑、伴灼痛,甚至乳头回缩。
5.腋窝淋巴结肿大
隐匿性乳腺癌乳腺体检摸不到肿块,常以腋窝淋巴结肿大为首发症状。医院收治的乳腺癌患者1/3以上有腋窝淋巴结转移。初期可出现同侧腋窝淋巴结肿大,肿大的淋巴结质硬、散在、可推动。随着病情发展,淋巴结逐渐融合,并与皮肤和周围组织粘连、固定。晚期可在锁骨上和对侧腋窝摸到转移的淋巴结。
(二)乳腺触诊
进行乳腺触诊前应详细询问乳腺病史、月经婚姻史、既往肿瘤家族史(乳腺癌、卵巢癌)。绝经前妇女最好在月经结束后进行乳腺触诊。
受检者通常采用坐位或立位,对下垂型乳房或乳房较大者,亦可结合仰卧位。乳腺体检应遵循先视诊后触诊,先健侧后患侧的原则,触诊时应采用手指指腹侧,按一定顺序,不遗漏乳头、乳晕区及腋窝部位,可双手结合。
大多数乳腺癌触诊时可以触到肿块,此类乳腺癌容易诊断。部分早期乳腺癌触诊阴性,查体时应重视乳腺局部腺体增厚变硬、乳头糜烂、乳头溢液,以及乳头轻度回缩、乳房皮肤轻度凹陷、乳晕轻度水肿、绝经后出现乳房疼痛等,应提高警惕。诊断时要结合影像学和组织病理学检查结果,必要时可活检行细胞学诊断。
(三)影像学检查
乳腺的影像学检查主要包括乳腺X线检查、乳腺超声以及乳腺磁共振等。
1.乳腺X线摄影
乳腺疾病的最基本检查方法,在检出钙化方面,具有其他影像学方法无可替代的优势,但对致密型乳腺、近胸壁肿块的显示不佳,且有放射性损害,对年轻女性患者不作为首选检查方法。
常规体位包括双侧内外侧斜位(MLO)及头尾位(CC)。对常规体位显示不佳或未包全乳腺实质者,可根据病灶位置选择补充体位。为使病灶显示效果更佳,必要时可开展一些特殊摄影技术,如局部加压摄影、放大摄影或局部加压放大摄影等。
(1)适应证:适用于筛查性人群及诊断性患者的乳腺检查
1)无症状人群的筛查。
2)适龄女性筛查或其他相关检查发现乳腺异常改变。
3)有乳腺肿块、局部增厚、异常乳头溢液、乳腺皮肤异常、局部疼痛或肿胀症状。
4)良性病变的短期随诊。
5)乳腺癌保乳术后的随诊。
6)乳房修复重建术后。
7)引导定位及活检。
对40岁以下、无明确乳腺癌高危因素或临床查体未见异常的妇女,不建议首先进行乳腺X线检查。妊娠期女性通常不进行乳腺X线摄影。
(2)诊断报告基本规范见附件1。
2.乳腺超声
超声检查因其简便易行、灵活直观、无创无辐射等特点,适用于所有疑诊乳腺病变的人群。可同时进行乳腺和腋窝淋巴结的检查。乳腺超声扫描体位常规取仰卧位,扫描范围自腋窝顶部至双乳下界,包括全乳及腋窝。
常规超声检查可以早期、敏感的检出乳腺内可疑病变,通过对病变形态、内部结构及周围组织改变等特征的观察,结合彩色多普勒血流成像观察病变内血流情况,确定病变性质。超声造影可以显示病灶内微血管分布、走形、血流动力学差异以及病灶与周围正常组织的关系,对于良恶性病灶的鉴别具有一定的意义。弹性成像可以评价组织硬度,对于部分乳腺病变的良恶性判断有一定的辅助价值。
(1)适应证
1)有乳腺相关症状者:触诊发现乳腺肿物、乳头溢液、乳头内陷、局部皮肤改变等。
2)无症状的乳腺癌高危人群乳腺检查。
3)作为乳腺X线筛查的补充检查。
4)乳腺良性病变的随访;乳腺癌术后随访;绝经后激素替代治疗随访等。
5)介入性超声:超声引导细针/空芯针穿刺活检及术前定位等。
(2)诊断报告基本规范见附件1。
3.乳腺磁共振成像(MRI)检查
乳腺MRI检查的优势在于敏感度高,能显示多病灶、多中心或双侧乳腺癌病灶,并能同时显示肿瘤与胸壁的关系、腋窝淋巴结转移情况等,为制订手术方案提供更可靠的依据。缺点在于特异度中等,假阳性率高,对微小钙化性病变显示不满意,此外检查时间长、费用昂贵。不作为首选检查方法。建议使用高场强MR设备及乳腺专用相控阵线圈,扫描体位为俯卧位,扫描序列包括T1WI序列(包括不抑脂序列,以及与增强序列相同的抑脂序列)、T2WI(加抑脂序列)、增强扫描序列(包括横断位动态增强扫描及矢状位扫描)。
(1)适应证
1)乳腺X线摄影和超声对病变检出或确诊困难者。
2)乳腺癌术前分期及筛查对侧乳腺肿瘤。
3)评价新辅助化疗疗效。
4)寻找腋窝淋巴结转移患者的原发灶。
5)乳腺癌术后鉴别治疗后瘢痕与肿瘤复发。
6)评估肿块切除术后切缘阳性患者的残留病灶。
7)乳腺假体植入术后评价。
8)高危人群的乳腺癌筛查。
9)引导乳腺病灶的定位及活检。
(2)禁忌证
1)体内有起搏器、外科金属夹等铁磁性物质及其他不得接近强磁场者。
2)具有对任何钆螯合物过敏史者。
3)幽闭恐惧症者。
4)妊娠期妇女。
(3)诊断报告基本规范:见附件1。
4.正电子发射计算机断层成像(PET-CT)
根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南、欧洲肿瘤内科学会(European Societyfor Medical Oncology,ESMO)指南、日本乳腺癌学会(Japanese Breast Cancer Society,JBCS)指南及中国抗癌协会指南。
(1)PET-CT检查适应证
1)临床局部晚期、分子分型预后差、或有症状可疑存在远处转移的患者疗前分期(尤其是常规影像检查对是否存在远处转移难以判断或存在争议时)。
2)术后患者随访过程中可疑出现局部复发或转移,包括查体或常规影像检查出现异常、肿瘤标志物升高等(对于鉴别复发和放射性纤维化,PET-CT较其他常规影像检查具有优势)。关于PET-CT在乳腺癌骨转移方面的应用,虽有临床研究提示,其具有与骨显像相似的灵敏度,更高的特异度,对乳腺癌骨转移治疗后病情的跟踪优于骨显像,但目前尚未获得各个指南的常规推荐。
(2)PET-CT检查的相对禁忌证
1)妊娠和哺乳期妇女。
2)严重心、肝、肾功能衰竭及对含碘对比剂过敏者不能行增强PET-CT检查。
3)病情危重难以配合、不能平卧15分钟、尿便失禁或有幽闭恐惧症的患者。
4)颅脑转移颅内压增高患者。
5.骨显像
(1)浸润性乳腺癌治疗前分期
1)对于临床Ⅰ~ⅡB期浸润性乳腺癌患者,有局部骨痛或碱性磷酸酶升高时,可行骨显像检查评估是否有骨转移。
2)临床Ⅲ期浸润性乳腺癌患者,可行骨显像检查或氟化钠PET-CT检查,评估是否有骨转移(2B类)。
3)复发或临床Ⅳ期乳腺癌患者,可行骨显像检查或氟化钠PET-CT检查,评估是否有骨转移。
若患者已行的FDGPET-CT检查中明确提示有骨骼转移,且PET及CT的部分均提示有骨骼转移,那么骨显像或氟化钠PET-CT检查可能不再需要。
(2)随访
若患者出现骨痛或碱性磷酸酶升高时,可行骨显像检查评估是否有骨转移;当缺乏临床信号和症状提示复发时,不建议影像学的转移筛查。
(四)实验室检查
1.生化检查:早期无特异性血生化改变,晚期累及其他脏器时,可出现相应的生化指标的变化。如多发骨转移时,可出现碱性磷酸酶升高。
2.肿瘤标志物检测:CA15-3、CEA是乳腺癌中应用价值较高的肿瘤标志物,主要用于转移性乳腺癌患者的病程监测。CA15-3和CEA联合应用可显著提高检测肿瘤复发和转移的敏感度。由于其对局部病变的敏感度低,且在某些良性疾病和其他器官的恶性肿瘤中也可升高,因此不适合用于乳腺癌的筛查和诊断。
三、组织病理学诊断
病理学诊断是乳腺癌确诊和治疗的依据。规范化的乳腺癌病理诊断不仅需要提供准确的病理诊断,还需要提供正确、可靠的与乳腺癌治疗方案选择、疗效预测和预后判断相关的标志物检测结果。进行病理学诊断时,临床医师需提供完整、确切的临床情况,以及合格、足量、完整的组织标本。
(一)标本类型及固定
1.标本类型
乳腺标本类型主要包括空芯针穿刺活检标本、真空辅助活检标本和各种手术切除标本(金属丝定位活检标本、乳腺肿块切除术、乳腺病变保乳切除术、乳腺单纯切除术和乳腺改良根治术标本)。
2.标本固定
穿刺或切除后的乳腺组织应立即固定(不得超过1小时为宜)。应选择足够的磷酸缓冲液配制的4%中性甲醛固定液。固定时间6~48小时为宜。对于切除标本,应将其每隔5mm切开,宜用纱布或滤纸将相邻的组织片分隔开,以保障固定液的充分渗透和固定。固定时间12~72小时为宜。
(二)取材及大体描述规范
接受标本后,首先必须核对姓名、床位号、住院号、标本名称及部位。
(1)空芯针穿刺活检标本
1)大体检查及记录:标明穿刺组织的数目,每块组织的大小,包括直径和长度。
2)取材:送检组织全部取材。空芯针穿刺活检标本不宜行术中病理诊断。
(2)真空辅助活检标本
1)大体检查及记录:标明活检组织的总大小。
2)取材:送检组织全部取材。如临床送检组织标记钙化及钙化旁,需记录注明,并将其分别置于不同的包埋盒中。真空辅助活检标本不宜行术中病理诊断。
(3)乳腺肿块切除标本
1)大体检查及记录
按外科医师的标示确定送检标本的部位。若未标记,应联系外科医师明确切除标本所在的位置。测量标本三个径线的大小;若带皮肤,应测量皮肤的大小。测量肿瘤或可疑病变三个径线的大小。记录肿瘤或可疑病变的部位和外观。记录每块组织所对应的切片总数及编号。
2)取材
术中冰冻取材:沿标本长轴每隔5mm做一个切面,如有明确肿块,在肿块处取材。如为钙化灶,宜对照X线摄片对可疑病变取材或按标记探针位置取材。如无明确肿块,对可疑病变处取材
常规石蜡取材:若肿块或可疑病变最大径小于或等于5cm,应至少每1cm取材1块,必要时(如导管原位癌)宜将病变全部取材后送检。若肿块或可疑病变最大径大于5cm,应每1cm至少取材1块,如6cm的肿块至少取材6块;如已诊断为导管原位癌,建议将病灶全部取材。乳腺实质的其他异常和皮肤均需取材。
(4)乳腺病变保乳切除标本
1)大体检查及记录。冻单送切缘者除外切缘检查及记录。
a.按外科医师的标示确定送检标本的部位。若未标记,应联系外科医师明确切除标本所在的位置。
b.测量标本三个径线的大小,若附带皮肤,则测量皮肤的大小。
c.根据临床标记,正确放置标本,建议将标本各切缘(表面切缘、基底切缘、上切缘、下切缘、内切缘、外切缘)涂上不同颜色的染料。待色标略干后,吸干多余的染料。
d.按从表面到基底的方向,沿标本长轴每隔5mm做一个切面,将标本平行切分为若干块组织,并保持各块组织的正确方向和顺序。
e.仔细查找病灶,并测量肿瘤三个径线的大小;若为化疗后标本,则测量瘤床大小;若为局切后标本,则描述残腔大小及有无残留病灶。
f.测量肿瘤、瘤床或残腔距各切缘的距离,观察最近切缘。
g.记录每块组织所对应的切片编号及对应取材内容
2)取材
a.切缘取材
冰冻单送切缘者除外切缘取材。
保乳标本切缘取材主要有2种方法:垂直切缘放射状取材(radial sections perpendicular to the margin)和切缘离断取材(shave sections of the margin)。2种切缘取材方法各有优缺点。无论采取何种取材方法,建议在取材前将六处标本切缘涂上不同颜色的墨水,以便在镜下观察时能根据不同颜色对切缘作出准确的定位,并正确测量肿瘤和切缘的距离。保乳标本病理报告中需明确切缘状态(阳性或阴性)。“阳性切缘”是指墨染切缘处有导管原位癌或浸润性癌侵犯。“阴性切缘”的定义并不一致,但多数指南或共识中将“墨染切缘处无肿瘤”定义为“阴性切缘”。对于切缘阴性者,建议报告切缘与肿瘤的距离,应尽量用客观的定量描述,而不建议用主观描述(如距切缘近等)。
垂直切缘放射状取材:根据手术医师对保乳标本做出的方位标记,垂直于基底将标本平行切成多个薄片(建议间隔5mm),观察每个切面的情况。描述肿瘤大小、所在位置及肿瘤距各切缘的距离,取材时将大体离肿瘤较近处的切缘与肿瘤一起全部取材,大体离肿瘤较远处的切缘抽样取材,镜下观察时准确测量切缘与肿瘤的距离。“垂直切缘放射状取材”的优点是能正确测量病变与切缘的距离,缺点是工作量较大,且对大体离肿瘤较远的切缘只抽样取材。
切缘离断取材:将六处切缘组织离断,离断的切缘组织充分取材,镜下观察切缘的累犯情况。“切缘离断取材”的优点是取材量相对较少,能通过较少的切片对所有的切缘情况进行镜下观察,缺点是不能准确测量病变与切缘的距离。
b.肿瘤及周围组织取材
若肿块或可疑病变最大径小于或等于5cm,应沿肿瘤或可疑病变的最大切面至少每1cm取材1块,必要时(如导管原位癌)宜全部取材后送检。若肿块或可疑病变最大径大于5cm,则每1cm至少取材1块;如已诊断为导管原位癌,建议将病灶全部取材。若为新辅助化疗后标本,则参照乳腺癌新辅助治疗后病理诊断规范(2015版)进行取材。若为手术残腔:送检代表性的切面,包括可疑的残留病灶。
乳腺实质的其他异常。
皮肤。
c.补充切缘取材
若首次切除时为阳性切缘,需再次送检切缘。补充切缘亦可作为单独的标本同切除组织一同送检。若外科医师已对补充切缘中真正的切缘做了标记,可用染料对真正切缘处进行涂色,并垂直于标记处切缘将标本连续切开并送检。如果标本较小,所有组织应全部送检。
(5)乳腺切除术(包括单纯切除术和改良根治术)
1)大体检查及记录
按正确的方向摆放标本以便识别肿瘤所在的象限:改良根治术标本可通过识别腋窝组织来正确定位(腋窝组织朝向外上方)。单纯切除术标本,需根据外科医师的标记来定位,若未标记方向,则与外科医师联系以确定标本的正确方向。建议标本的基底切缘涂上染料以便镜下观察切缘情况。
测量整个标本及附带皮肤、腋窝组织的大小。描述皮肤的外观,如有无手术切口、穿刺点、瘢痕、红斑或水肿等。
从基底部水平切开乳头,取乳头水平切面组织一块以观察输乳管的横断面,而后垂直于乳腺表面切开乳头其他组织。描述乳头、乳晕的外观,如有无破溃及湿疹样改变等。
垂直于基底将标本切成连续的薄片。
仔细查找病灶,记录病灶所在象限位置,描述肿瘤(质地、颜色、边界、与皮肤及深部结构的关系)的特征。若有明确肿块,则测量肿瘤3个径线的大小;若为化疗后标本,则测量瘤床大小;若为局切后标本,则描述手术残腔大小及有无残留病灶。测量肿瘤、残腔、瘤床距最近表面切缘及基底切缘的距离。
描述非肿瘤乳腺组织的情况。
将腋窝脂肪组织同标本离断后,仔细寻找淋巴结,对规范的腋窝清扫标本宜至少找及15枚淋巴结。描述淋巴结的总数目及最大径范围、有无融合、有无与周围组织粘连。注意需附带淋巴结周围的结缔组织。
2)取材
a.原发肿瘤和手术残腔的取材
若为肿瘤:送检肿瘤的最大切面;若肿块或可疑病变最大径≤5cm,应至少每1cm取材1块,必要时(如导管原位癌)宜全部取材后送检。若标本肿块或可疑病变最大径>5cm,则每1cm至少取材1块,如已诊断为导管原位癌,应将病灶全部取材。
若为化疗后瘤床:参照乳腺癌新辅助治疗后病理诊断规范(2015年版)取材。
若为手术残腔:送检代表性的切面,包括可疑的残留病灶。
b.其余组织的异常病灶
乳头:距肿瘤最近处表面被覆皮肤;距肿瘤最近处基底切缘,尽可能取切缘的垂直切面;周围象限乳腺组织每个象限代表性取材1块。
腋窝淋巴结:若淋巴结肉眼观察为阴性,则送检整个淋巴结行组织学检查;若淋巴结肉眼阳性,则沿淋巴结最大径剖开后取组织送检,注意需附带淋巴结周围的结缔组织,以识别淋巴结被膜外的肿瘤转移灶。
(6)前哨淋巴结活检
乳腺癌前哨淋巴结活检已逐渐取代传统的腋窝淋巴结清扫来评估早期乳腺癌患者的区域淋巴结情况,前哨淋巴结活检阴性者可避免腋窝淋巴结清扫。
1)前哨淋巴结转移灶的定义
a.孤立肿瘤细胞(isolated tumor cells,ITC):淋巴结中的肿瘤病灶直径≤0.2mm:淋巴结中,或单张切片上的肿瘤细胞<200个。AJCC定义其为pN0(i+)。目前大部分临床乳腺癌诊疗指南认为ITC无临床意义,推荐按腋窝淋巴结阴性处理。
b.微转移:肿瘤转移灶最大径>0.2mm,但不超过2mm。AJCC定义其为pN1mi。ITC与微转移有着本质的不同,前者为pN0,后者为pN1,两者的鉴别非常重要。本标准中推荐将前哨淋巴结间隔2mm切成若干片组织,主要目的是为了最大程度检测出微转移病灶。
c.宏转移:肿瘤转移灶最大径>2mm。
2)术中病理评估
前哨淋巴结中术中病理评估的主要目的是检测出淋巴结中的转移病灶,从而进行腋窝淋巴结清扫,以避免二次手术。但目前对前哨淋巴结术中病理评估是否必要存在争议。术中病理评估的方法主要包括术中细胞印片和术中冷冻切片。
a.术中细胞印片:将淋巴结每间隔2mm切成若干片组织,仔细检查每片组织上是否存在肉眼可见的转移灶,对每个切面行细胞印片。推荐巴氏染色和HE染色。术中细胞印片的优点是可保全整个淋巴结组织,对组织无损耗,可对淋巴结的不同切面取材,价廉,所需时间短,制作流程简单;缺点是在印片的高细胞背景下辨认出分散的癌细胞(如小叶癌)有一定难度。术中细胞印片有很好的诊断特异度,但其诊断敏感度受多种因素的影响。
b.术中冷冻切片:将淋巴结每间隔2mm切成若干片组织,仔细检查每片组织上是否存在肉眼可见的转移灶,每片组织制成冷冻切片行病理评估。术中冷冻切片的优点是诊断特异度好,能够避免因假阳性而造成不必要的腋窝淋巴结清扫;缺点是组织损耗,用时长,费用较高,且难以评估脂肪化的淋巴结等。
3)术后常规石蜡病理评估
术后石蜡切片是前哨淋巴结诊断的“金标准”,可明显减少微小转移的漏诊。但是关于如何切分淋巴结、是否需要连续切片、切多少张连续切片、连续切片之间间隔多少尚无统一意见。推荐石蜡切片方案:①将淋巴结每间隔2mm切成若干片组织;②每片组织均包埋成石蜡组织块;③每个蜡块至少切一张切片;有条件的单位推荐连续切片,间隔150~200m,切6个切面。
(三)病理诊断分类、分级和分期方案(附件2,附件3,附件4)
1.组织学分型
参见附件2,组织学分型主要依据2003和2012版世界卫生组织(WHO)乳腺肿瘤分类,某些组织学类型的准确区分需行免疫组化后确定。
对乳腺浸润性癌进行准确的组织学分型对患者的个体化治疗具有非常重要的临床意义。在NCCN乳腺癌临床实践指南有关乳腺浸润性癌的术后辅助治疗方案中,针对小管癌、黏液腺癌这两类预后较好的乳腺癌,制定了与其他类型的浸润性癌不同的内分泌治疗及放化疗方案,因此要严格掌握这些特殊类型乳腺癌的诊断标准。对于炎性乳癌这类预后较差的乳腺癌,NCCN乳腺癌临床实践指南也制定了有别于其他浸润性癌的手术及术前术后辅助治疗方案。过去认为髓样癌预后较好,但目前的研究表明其转移风险与其他高度恶性的浸润性癌相当,其诊断重复性在不同观察者之间的差异也很明显。因此NCCN指南建议,对髓样癌患者应根据其临床和病理分期接受与浸润性导管癌一样的治疗。某些特殊类型的乳腺癌具有较特殊的临床特征,如浸润性微乳头状癌较易出现淋巴结转移,即使出现较少比例的浸润性微乳头状癌,也应在病理报告中注明。对于混合性癌,建议报告不同肿瘤类型所占的比例,并分别报告2种成分的肿瘤分子生物标记的表达情况。
2.组织学分级
(1)浸润性乳腺癌(参见附件3)
组织学分级是重要的预后因素,多项研究显示在浸润性乳腺癌中,组织学分级与预后明确相关。目前应用最广泛的浸润性癌病理分级系统是改良Scarff-Bloom-Richardson分级系统,根据腺管形成的比例、细胞的异型性和核分裂象计数三项重要指标,每项指标分别独立评估,各给予1~3分,相加后根据总分将浸润性癌划分为高、中、低3个级别。乳腺浸润性癌的危险评估体系中,低级别是低度危险指标,中级别和高级别是中度危险指标。
腺管分化程度的评估针对整个肿瘤,需要在低倍镜下评估。只计数有明确中央腺腔且由有极向肿瘤细胞包绕的结构,以腺管/肿瘤区域的百分比表示。
细胞核多形性的评估要选取多形性最显著的区域。该项评估参考周围正常乳腺上皮细胞的核大小、形状和核仁大小。当周边缺乏正常细胞时,可用淋巴细胞作为参照。当细胞核与周围正常上皮细胞的大小和形状相似、染色质均匀分布时,视为1分;当细胞核比正常细胞大,形状和大小有中等程度差异,可见单个核仁时,视为2分;当细胞核的大小有显著差异,核仁显著,可见多个核仁时应视为3分。
只计数明确的核分裂象,不计数核浓染和核碎屑。核分裂象计数区域必须要根据显微镜高倍视野的直径进行校正。核分裂象计数要选取增殖最活跃的区域,一般常见于肿瘤边缘,如果存在肿瘤中的异质性,要选择核分裂象多的区域。
(2)乳腺导管原位癌的分级
对于导管原位癌,病理报告中应该包括分级,并建议报告是否存在坏死,组织学结构、病变大小或范围、切缘状况。目前乳腺原位癌的分级主要是细胞核分级,诊断标准如下
低核级导管原位癌:由小而一致的癌细胞组成,呈僵直搭桥状、微乳头状、筛状或实体状结构。细胞核大小一致,染色质均匀,核仁不明显,核分裂象少见。
中核级导管原位癌:形态介于低级别和高级别导管原位癌之间,细胞的大小、形状、极性有轻-中等差异。染色质粗细不等,可见核仁,核分裂象可见,可出现点状坏死或粉刺样坏死。
高核级导管原位癌:由高度不典型的细胞组成,形成微乳头状、筛状或实体状。细胞核多形性明显,缺乏极性排列,染色质粗凝块状,核仁明显,核分裂象较多。管腔内常出现伴有大量坏死碎屑的粉刺样坏死。但腔内坏死不是诊断高级别导管原位癌的必要条件,有时导管壁衬覆单层细胞,但细胞高度异型,也可以诊断为高级别导管原位癌。
3.乳腺癌的分期方案
参见附件4。肿瘤分期包括了肿瘤的大小、累及范围(皮肤和胸壁受累情况)、淋巴结转移和远处转移情况。正确的肿瘤分期是指导患者个体化治疗决策的基础。乳腺癌患者要进行临床分期和病理分期。
第8版AJCC乳腺癌分期对肿瘤大小的测量做出了详尽的规定。肿瘤大小的测量有多种方法,包括临床体检、影像学评估、病理大体测量和显微镜下测量。乳腺癌分期中涉及到的肿瘤大小是指浸润癌的大小。由于体检、影像学及大体检查均无法区分浸润性癌和导管内癌,因此显微镜下测量应该是最准确的测量方式。如果浸润性癌范围较大,无法用1个蜡块全部包埋,则以巨检时的肿瘤大小为准。若浸润性癌病灶局限,可以用1个蜡块全部包埋,则肿瘤大小以显微镜下测量的大小为准。①如果肿瘤组织中有浸润性癌和原位癌2种成分,肿瘤的大小应该以浸润性成分的测量值为准。②原位癌伴微浸润:出现微浸润时,应在报告中注明,并测量微浸润灶最大径;如为多灶微浸润,浸润灶大小不能累加,需在报告中注明多灶微浸润,并测量最大浸润灶的最大径。③对于肉眼能确定的发生于同一象限的2个以上多个肿瘤病灶,应在病理报告中注明为多灶性肿瘤,并分别测量大小。④对于肉眼能确定的发生于不同象限的2个以上多个肿瘤病灶,应在病理报告中注明为多中心性肿瘤,并分别测量大小。(5)如果肿瘤组织完全由导管原位癌组成,应尽量测量其范围。淋巴结状态是决定乳腺癌患者治疗和预后的重要因素,对于淋巴结转移数位于分期临界值(如1、3和10个转移)附近时,要特别仔细观察淋巴结的转移数目,从而做出准确的pN分期。
新辅助治疗后标本的分期需结合临床检查、影像学检查和病理检查信息,根据手术切除标本的情况对治疗后的yT和yN进行判定。
4.免疫组化和肿瘤分子病理检测及其质量控制
应对所有乳腺浸润性癌病例进行ER(雌激素受体)、PR(孕激素受体)、HER2免疫组化染色,HER22+病例应进一步行原位杂交检测。评估ER、PR状态的意义在于确认内分泌治疗获益的患者群体以及预测预后,ER和(或)PR阳性患者可采用他莫昔芬和芳香化酶抑制剂等内分泌治疗。ER、PR的规范化病理报告需要报告阳性细胞强度和百分比。ER及PR阳性定义:≥1%的阳性染色肿瘤细胞。评估HER2状态的意义在于确认适合HER2靶向治疗的患者群体以及预测预后。HER2阳性定义:经免疫组织化学检测,超过10%的细胞出现完整胞膜强着色(3+)和(或)原位杂交检测到HER2基因扩增(单拷贝HER2基因>6或HER2/CEP17比值>2.0)。ER、PR检测参考《中国乳腺癌ER、PR检测指南》(参见附件5)。HER2检测参考《中国乳腺癌HER2检测指南》(参见附件6)。
Ki-67增殖指数在乳腺癌治疗方案选择和预后评估上起着越来越重要的作用,应对所有乳腺浸润性癌病例进行Ki-67检测,并对癌细胞中阳性染色细胞所占的百分比进行报告。对于Ki-67计数,目前尚缺乏相关共识。建议按下述方法进行计数。首先在低倍镜下评估整张切片,观察阳性细胞分布是否均匀。①若肿瘤细胞中阳性细胞分布较均匀,可随机选取3个或3个以上浸润性癌高倍视野计数,得出一个平均的Ki-67增殖指数。②若肿瘤细胞中阳性细胞分布不均匀,出现明显的Ki-67增殖指数高表达区域(hotspot)。主要有2种情况:(a)在肿瘤组织边缘与正常组织交界处出现hotspot,而肿瘤组织内Ki-67增殖指数相对较低,推荐选取肿瘤边缘区域hotspot≥3个浸润性癌高倍视野进行Ki-67增殖指数评估;(b)在肿瘤组织内出现hotspot,可对整张切片的Ki-67增殖指数进行平均评估,选取视野时应包括hotspot区域在内的≥3个浸润性癌高倍视野。当Ki-67增殖指数介于10%~30%的临界值范围时,建议尽量评估500个以上的浸润性癌细胞,以提高结果的准确度。
开展乳腺癌免疫组化和分子病理检测的实验室应建立完整有效的内部质量控制,不具备检测条件的单位应妥善地保存好标本,以供具有相关资质的病理实验室进行检测。
具有合格资质的病理实验室应满足以下条件。
(1)应建立完善的标准操作程序(standard operation procedure,SOP),并严格遵照执行,做好每次检测情况的记录和存档工作。应开展同一组织不同批次染色结果的重复性分析。检测相关的仪器和设备应定期维护、校验。任何操作程序和试剂变化均应重新进行严格的验证。
(2)从事乳腺癌免疫组化和分子病理检测的实验技术人员和病理医师应定期进行必要的培训、资格考核和能力评估。
(3)实验室外部质控可通过参加有关外部质控活动来实现。外部质控的阳性和阴性符合率应达到90%以上。外部质控活动推荐每年参加1~2次。
5.病理报告内容及规范
乳腺浸润性癌的病理报告(参见附件7)应包括与患者治疗和预后相关的所有内容,如肿瘤大小、组织学类型、组织学分级、有无并存的导管原位癌、有无脉管侵犯、切缘和淋巴结情况等。还应包括ER、PR、HER2、Ki-67等指标的检测情况。若为治疗后乳腺癌标本,则应对治疗后反应进行病理评估。导管原位癌的病理诊断报告应报告核级别(低、中或高级别)和有无坏死(粉刺或点状坏死)、手术切缘情况以及ER和PR表达情况。对癌旁良性病变,宜明确报告病变名称或类型。对保乳标本的评价宜包括大体检查及显微镜观察中肿瘤距切缘最近处的距离、若切缘阳性,应注明切缘处肿瘤的类型(原位癌或浸润性癌)。淋巴管/血管侵犯(lymphovascular invasion,LVI)需要与乳腺癌标本中经常出现的组织收缩引起的腔隙鉴别。相对而言,收缩腔隙在肿瘤组织内更常见,而在肿瘤主体周围寻找脉管侵犯更可靠。
四、鉴别诊断
乳腺癌需与乳腺增生、纤维腺瘤、囊肿、导管内乳头状瘤、乳腺导管扩张症(浆细胞性乳腺炎)、乳腺结核等良性疾病,与乳房恶性淋巴瘤以及其他部位原发肿瘤转移到乳腺的继发性乳腺恶性肿瘤进行鉴别诊断。鉴别诊断时需要详细地询问病史和仔细地体格检查,并结合影像学检查(乳腺超声、乳腺X线摄影及乳腺磁共振等),最后还需要细胞学和(或)病理组织学检查明确诊断。
临床查体可触及肿块的乳腺癌约占80%,可以进行外科手术活检行病理组织学诊断,在有条件的医院可借助穿刺尽快明确诊断。但临床触诊阴性的乳腺癌增加了鉴别诊断的困难,需借助影像学检查定位病灶进行穿刺,或在乳腺X线技术引导下放置金属定位线,再经外科切除活检明确诊断。
少数乳腺癌患者伴有乳头溢液,需与乳腺增生、导管扩张、乳汁潴留、导管内乳头状瘤及乳头状瘤病等鉴别。有条件的医院可借助乳头溢液细胞学涂片查找癌细胞,通过乳管内镜检查,了解乳管内有无占位性病变,需要时再经活检明确诊断。
五、治疗
(一)治疗原则
乳腺癌应采用综合治疗的原则,根据肿瘤的生物学行为和患者的身体状况,联合运用多种治疗手段,兼顾局部治疗和全身治疗,以期提高疗效和改善患者的生活质量。
1.非浸润性乳腺癌的治疗
(1)小叶原位癌(lobular carcinoma in situ,LCIS)
经典型LCIS中的小叶内终末导管或腺泡呈实性膨大,其中充满均匀一致的肿瘤细胞。肿瘤细胞体积小而一致,黏附性差。细胞核呈圆形或卵圆形,染色质均匀,核仁不明显。细胞质淡染或淡嗜酸性,可含黏液空泡致细胞核偏位呈印戒细胞样,细胞质也可透亮。LCIS包括多种亚型:多形性型、旺炽型、透明型、肌样细胞型等。其中较为重要的是多形性亚型。多形性LCIS中的肿瘤细胞黏附性差,细胞核显著增大,有明显的多形性,可有显著的核仁和核分裂象,有时可见粉刺样坏死或钙化,需与高级别DCIS相鉴别。非典型性小叶增生(atypical lobular hyperplasia,ALH)和LCIS在形态学上具有相似之处,但累犯终末导管小叶单位(terminal ductal lobular unit,TDLU)的程度不同。当TDLU单位中≥50%的腺泡被诊断性细胞所充满并扩张时可诊断为LCIS,小于50%时则诊断为ALH。根据AJCC(第8版),将LCIS当做乳腺良性病变,然而专家团认为仍需谨慎适用,推荐对非经典型LCIS需积极处理。
LCIS发展为浸润性癌的风险相对较小,具有癌变间期长、双侧乳房和多个象限发病的特点。一些研究发现,在诊断为ALH和LCIS的妇女中,终生发生癌变的概率为5%~32%,平均癌变率为8%。LCIS癌变发生于双侧乳房的机会均等,而不仅仅局限于原发LCIS部位。多数观点认为,LCIS是癌变的危险因素,有些研究则认为LCIS是癌前病变。有研究显示,LCIS多数进展为浸润性小叶癌,但是也可进展为浸润性导管癌(invasive ductal carcinoma,IDC)。这是一个值得重视的癌前病变,对其治疗需要更有效而确切的方法。
LCIS可无任何临床症状,亦可没有乳房肿块、乳头溢液、乳头肿胀及皮肤改变等体征,有时仅有类似增生样改变。依据中国女性乳腺特点,应完善乳腺X线、乳腺超声检查,必要时可行乳腺MRI;拟行保乳手术患者,术前必须行乳腺X线检查检查。在乳腺X线检查发现有钙化、肿块、结构紊乱后,其通过穿刺活检(包括空芯针穿刺以及真空辅助穿刺活检)或开放活检均可被诊断。如穿刺活检提示为经典型LCIS患者,则可以进行常规的影像学随访而不行开放活检。若穿刺活检提示为多形性LCIS或穿刺结果与影像学检查不符,需行开放活检以除外DCIS及浸润癌。LCIS亦有因其他乳房病变进行手术活检时发现。典型的LCIS与低级别的DCIS很相似,可采用E-钙黏蛋白及P120免疫组织化学染色来鉴别。
小叶原位癌:如果行广泛切除后,绝经前可予他莫昔芬(三苯氧胺)治疗5年;绝经后口服他莫昔芬或雷洛昔芬降低风险;若不能排除多形性小叶原位癌可行全乳切除术,视情况进行乳房重建。
(2)导管原位癌(ductal carcinoma in situ,DCIS)
DCIS又称导管内癌,为非浸润性癌,多数发生于TDLU,也可发生于大导管,是局限于乳腺导管内的原位癌。典型的DCIS在乳腺X线检查上多表现为不伴肿块的簇状微小钙化灶,恶性钙化还可表现为细小点样、线状、分支状钙化等。在实际工作中,多采用以核分级为基础,兼顾坏死、核分裂象及组织结构的分级模式,将DCIS分为3级,即低级别、中级别和高级别。高级别DCIS往往由较大的多形性细胞构成,核仁明显、核分裂象常见。管腔内常出现伴有大量坏死碎屑的粉刺样坏死,但腔内坏死不是诊断高级别DCIS的必要条件。低级别DCIS由小的单形性细胞组成,细胞核圆形,大小一致,染色质均匀,核仁不明显,核分裂象少见。肿瘤细胞排列成僵直搭桥状、微乳头状、筛状或实体状。中级别DCIS结构表现多样,细胞异型性介于高级别和低级别DCIS之间。
DCIS可能是浸润性导管癌(invasive ductal carcinoma,IDC)的前驱病变,DCIS不经治疗最终可能会发展为IDC。对最初误诊为良性病变而导致未能获得治疗的DCIS研究显示,从DCIS进展为IDC的比例为14%~53%。
依据中国女性乳腺特点,应完善乳腺X线检查、乳腺超声检查,必要时可行乳腺MRI。拟行保乳手术的患者,术前必须行乳腺X线检查诊断。至少有90%的DCIS是在乳腺X线检查筛查中被发现,多数表现为微小钙化灶,部分表现为微小钙化灶伴肿块影或致密影,约10%患者有可触及的肿块,约6%患者乳腺X线检查表现为假阴性。DCIS的典型MRI表现为沿导管分布的导管样或段样成簇小环状强化,也可表现为局灶性、区域性或弥漫性强化,孤立性或多发性肿块。超声下DCIS多表现为边界不清的肿块,内部呈低回声,肿块内多具有弥漫、成堆或簇状分布的针尖样、颗粒状钙化,肿块内血流多较丰富。空芯针穿刺活检及开放活检都是获取DCIS组织学诊断的手段,但穿刺活检提示为DCIS患者,可选择开放活检以明确有无浸润癌。在穿刺结果为DCIS患者中,25%有IDC成分;在穿刺结果为LCIS患者中,开放活检后有17%~27%病理升级为DCIS或浸润性癌。因此建议穿刺活检后行开放活检。DCIS的病理诊断,推荐完整取材、规范取材。
1)局部扩大切除并全乳放射治疗。
2)全乳切除,视情况进行前哨淋巴结活检和乳房重建。
对于单纯原位癌患者,在未获得浸润性乳腺癌证据或者未证实存在肿瘤转移时,不建议行全腋窝淋巴结清扫。然而,仍有一小部分临床诊断为单纯原位癌的患者在进行手术时被发现为浸润性癌,应按浸润癌处理。单纯小叶原位癌的确诊必须依据手术活检结果。
3)以下情形考虑采用他莫昔芬治疗5年以降低保乳手术后同侧乳腺癌复发风险。
①接受保乳手术(肿块切除术)加放疗的患者,尤其是ER阳性的DCIS患者;ER阴性的DCIS患者他莫昔芬治疗效果尚不确定。
②对于接受全乳切除术的DCIS患者术后可通过口服他莫昔芬或雷洛昔芬来降低对侧乳腺癌风险,但需权衡化学预防的临床获益与不良反应。
2.浸润性乳腺癌的治疗
(1)保乳手术加放射治疗。
(2)乳腺癌全乳切除联合腋窝淋巴结清扫手术(改良根治术),视情况进行乳房重建。
(3)全乳切除并前哨淋巴结活检,视情况进行乳房重建。
(4)老年人乳腺癌:局部扩大切除或全乳切除(根据手术及麻醉风险),受体阳性患者需进行内分泌治疗,视情况做前哨淋巴结活检。
(二)手术治疗
1.手术治疗原则
乳腺癌手术范围包括乳腺和腋窝淋巴结两部分。乳腺手术有肿瘤扩大切除和全乳切除。腋窝淋巴结可行前哨淋巴结活检和腋窝淋巴结清扫,除原位癌外均需了解腋窝淋巴结状况。选择手术术式应综合考虑肿瘤的临床分期和患者的身体状况。
2.乳腺手术
(1)乳房切除手术
适应证:TNM分期中0、Ⅰ、Ⅱ期及部分Ⅲ期且无手术禁忌,患者不具备实施保乳手术条件或不同意接受保留乳房手术;局部进展期或伴有远处转移的患者,经全身治疗后降期,亦可选择全乳切除术。Halsted传统根治术中采用的乳房切除术需同时切除胸大小肌,创伤大,并发症发生率高,目前已被改良根治术所取代。其切除范围包括上至锁骨下、下至腹直肌前鞘、内至胸骨旁、外至背阔肌的解剖边界内,连同胸大肌筋膜完整切除乳腺组织及乳头乳晕复合体,只有当胸肌受累时才需切除部分或全部胸肌。部分学者认为可保留胸大肌筋膜,尤其是需要进行术中即刻假体/扩张器重建时。
目前的乳房切除术已由改良根治术发展为保留皮肤的乳房切除+乳腺重建手术,两者治疗效果类似,但后者美容效果更好。此外,保留乳头乳晕的乳房切除术在临床上的应用也日趋广泛,但还缺乏长期研究数据,需进一步完善患者选择问题。
(2)保留乳房手术
严格掌握保乳手术适应证。实施保乳手术的医疗单位应具备保乳手术切缘的组织学检查设备与技术,保证切缘阴性;保乳术后放射治疗的设备与技术。保留乳房手术后美容效果评价标准见附件7。
保乳手术适用于患者有保乳意愿,乳腺肿瘤可以完整切除,达到阴性切缘,并可获得良好的美容效果、同时可接受术后辅助放疗的患者。年轻不作为保乳手术的禁忌,≤35岁的患者有相对高的复发和再发乳腺癌的风险,在选择保乳时,应向患者充分交待可能存在的风险。
保乳手术的绝对禁忌证包括病变广泛或弥漫分布的恶性特征钙化灶,且难以达到切缘阴性或理想外形;T4期乳腺癌,包括侵犯皮肤、胸壁及炎性乳腺癌;肿瘤经局部广泛切除后切缘阳性,再次切除后仍不能保证病理切缘阴性者;妊娠期乳腺癌,预估术后放疗无法等到分娩后者;患者拒绝行保留乳房手术。相对禁忌证包括肿瘤直径大于3cm和累及皮肤的活动性结缔组织病,尤其是硬皮病和红斑狼疮等。
3.腋窝淋巴结的外科手术
处理腋窝淋巴结是浸润性乳腺癌标准手术中的一部分。其主要目的是为了了解腋窝淋巴结的状况,以确定分期,选择最佳治疗方案。
(1)乳腺癌前哨淋巴结活检。前哨淋巴结活检(Sentinel lymph node biopsy,SLNB)具有创伤小且相关并发症少等优点,是指对最早接受乳腺癌区域淋巴引流和发生肿瘤转移的1个(或几个)淋巴结进行切除活检,以评估腋窝淋巴结状态,NCCN乳腺癌临床实践指南推荐临床腋窝淋巴结阴性的早期乳腺癌患者选择SLNB作为腋窝淋巴结处理的优选手术方式。在前哨淋巴结活检手术前,需进行前哨淋巴结示踪,目前SLNB常用的示踪方法有染料法(专利蓝、异硫蓝、亚甲蓝和纳米炭)、核素法、染料联合核素法及荧光示踪法,运用最广泛的示踪方法为蓝染法联合核素法。SLNB技术能够准确的进行乳腺癌腋窝淋巴结分期,对于临床检查腋窝淋巴结无明确转移的患者,进行SLNB后,淋巴结阴性的患者可以免除腋窝淋巴结清扫,以减少上肢水肿等并发症的发生;若前哨淋巴结活检阳性,可进行腋窝淋巴结清扫。
(2)腋窝淋巴结清扫。腋窝淋巴结清扫的指征包括:①临床腋窝淋巴结阳性且经穿刺/手术活检证实有转移的患者;②前哨淋巴结阳性,且不符合ACOSOGZ0011入组标准的患者如T3、超过2枚前哨阳性以及需全部乳腺切除者;③近期不充分的腋窝淋巴结清扫;④前哨淋巴结验证试验;⑤前哨淋巴结活检失败;⑥前哨淋巴结活检发现临床可疑的淋巴结;⑦T4;⑧不能施行前哨淋巴结活检;⑨前哨淋巴结活检后腋窝复发。
通常情况下,腋窝淋巴结清扫范围应包括背阔肌前缘至胸小肌外侧缘(LevelⅠ)、胸小肌外侧缘至胸小肌内侧缘(LevelⅡ)的所有淋巴结。清扫腋窝淋巴结要求在10个以上,以保证能真实地反映腋窝淋巴结的状况。只有当LevelⅠ~Ⅱ明显转移或者LevelⅢ(胸小肌内侧缘至腋静脉入口处)探及增大转移的淋巴结时才需进行Ⅰ~Ⅲ水平的全腋窝淋巴结清扫。
4.乳房修复与重建
乳腺癌改良根治手术后的乳房缺损与保乳术后的乳房畸形均需要整形外科进行再造和修复,且已成为乳腺癌完整治疗方案中不可或缺的一个重要组成部分。乳房再造提高术后患者的生活质量及心理满意度。我国乳房再造的数量逐年增加,方法越来越完善,乳房再造的理念和意识被越来越多的肿瘤外科医师所认识和接受。
乳房再造的肿瘤学安全性是肯定的。是否行乳房再造、再造的时机及再造方式不影响乳腺癌患者术后的生存率和生存时间。乳房再造对外科手术或肿瘤复发、转移的检出没有影响。
正常情况下,乳房再造不影响术后化疗的进行。除非即刻再造术后出现较严重并发症(如感染、切口裂开等),否则不会对化疗的临床应用及治疗效果造成显著影响。即刻乳房再造术后辅助化疗不会增加再造术后并发症发生率,不会降低即刻乳房再造成功率,不会影响伤口愈合,也不会影响再造效果。但新辅助化疗会增加即刻乳房再造术后皮瓣感染及坏死的发生率。化疗可造成人体免疫功能下降、抗感染能力降低,化疗期间不适合做任何乳房再造手术。
无论自体组织再造,还是假体再造,均不是放射治疗的禁忌证,也不会对放疗效果产生明显影响。即刻乳房再造增加了术后放疗野设计的技术难度,但周密设计的放疗方案不影响放疗效果。放疗会影响再造的远期美学满意度及总体满意度。
乳腺癌切除乳房再造的基本原则如下。
(1)必须将肿瘤治疗放在首位。乳房再造的任何整形外科治疗都不应推迟乳腺癌辅助治疗的时间,不应影响乳腺癌辅助治疗的进行。
(2)必须将乳房再造纳入乳腺癌的整个治疗方案,医师有义务告知患者有选择进行乳房再造的权利。
(3)在乳腺切除过程中,应在不违反肿瘤学原则的前提下,尽可能保留乳房的皮肤、皮下组织以及重要的美学结构(如乳房下皱襞等),最大限度地为乳房再造保留条件,提高再造乳房美学效果和患者满意度。
(4)乳腺癌的治疗应当在多学科团队合作框架下进行,包括放射科、乳腺外科、整形外科、影像科、病理科、心理科、核医学科、免疫科等。
乳房再造的术前检查、评估和教育:术前应对患者的条件进行检测与评估,分析肿瘤学情况、内科情况、组织条件、对侧乳房情况等,综合这些条件选择创伤小、手术简化、费用少、并发症发生率低且效果良好的手术方案。
禁忌行乳房再造的乳腺癌类型与分期:Ⅳ期浸润性乳腺癌、复发转移性乳腺癌。通常认为放化疗期间、放疗后半年内禁行乳房再造,对于接受过放疗或准备进行放疗的患者,应谨慎选择乳房再造的时机和手术方式。严重肥胖和吸烟、严重内科疾病、外周血管疾病都是术后出现并发症的重要风险因素,是乳房再造术的相对禁忌证。
治疗周期及费用:①乳房再造是一个序列化的治疗,通常需要多次手术才能达到理想的效果。采用组织扩张法进行乳房再造。②即刻乳房再造在总体治疗时间和费用上较二期乳房再造具有优势。
乳房再造的基本方法:包括皮肤覆盖的再造和乳房体积的再造。皮肤覆盖的再造方法包括组织扩张和自体皮瓣移植等,乳房体积的再造方法包括:应用假体、皮瓣组织瓣移植、游离自体脂肪移植等。自体组织乳房再造常用的皮瓣包括:背阔肌肌皮瓣、腹直肌肌皮瓣、腹壁下动脉穿支皮瓣等。
随访时间:乳房再造的随访时间应从术后开始,至术后5年以上,根据乳房再造方式不同,定期进行随访。观察指标:包括乳腺癌的肿瘤学随访、乳房外形与对称性、切口瘢痕、供区功能、假体完整性、包膜挛缩、其他并发症。必要时还应包括心理变化、生活质量变化等。检查项目:肿瘤学检查、乳房体表测量值、照相、供区运动功能测定、乳房假体包膜挛缩分级,必要时行超声、磁共振等特殊检查。建议指导:乳房再造术后,应给患者进行详细的术后指导,包括日常注意事项、运动、肿瘤学检查、复查时间等。
(三)放射治疗
1.早期乳腺癌保乳术后放射治疗
(1)适应证
原则上,所有接受保乳手术的患者均需接受放射治疗。对年龄>70岁、乳腺肿瘤≤2cm、无淋巴结转移、ER受体阳性、能接受规范内分泌治疗的女性患者,可以考虑省略保乳术后放疗。
(2)照射范围
1)在有条件的单位,对经严格选择的低危患者,可以考虑行部分乳腺照射,具体的患者选择标准及治疗方式参见“1.(5)部分乳腺照射”章节。
2)腋窝淋巴结清扫或前哨淋巴结活检未发现淋巴结转移的患者,照射范围为患侧乳腺。
3)前哨淋巴结活检发现淋巴结微转移,或转移淋巴结1~2个,未行淋巴结清扫的患者,可考虑行全乳腺高切线野放疗。预测非前哨淋巴结转移风险>30%者,则应考虑照射全乳腺+腋窝+/-锁骨上淋巴引流区。
4)接受腋窝淋巴结清扫且淋巴结转移1~3个的患者,照射范围需包括患侧乳腺及锁骨上/下淋巴引流区。但对其中的无任何高危复发因素,即年龄≥50岁、肿瘤分级Ⅰ~Ⅱ级、无脉管瘤栓、腋窝淋巴结阳性比例<20%、激素受体阳性的患者,可考虑只行患侧乳腺照射。
5)接受腋窝淋巴结清扫且淋巴结转移≥4个的患者,照射靶区需包括患侧乳腺、锁骨上/下淋巴引流区。
6)对腋窝淋巴结转移1~3个,且肿瘤位于内象限,或腋窝淋巴结转移≥4个的患者,在保证心肺安全的前提下,可考虑将内乳引流区包括在照射范围内。
7)腋窝前哨淋巴结转移≥3个而未做腋窝淋巴结清扫者,照射靶区需包括患侧乳房,腋窝和锁骨上/下淋巴引流区。
8)对接受全乳放疗的患者,原则上均推荐进行乳腺瘤床加量,特别是切缘阳性,或≤50岁,或51~70岁且高分级患者。对于DCIS则为年龄≤50岁,核分级为高级别,切缘阳性或者阴性切缘≤2mm患者建议瘤床加量。对低危患者,如年龄>70岁,且中低级别,且激素受体阳性且有足够的阴性切缘(≥3mm)患者,可考虑省略瘤床加量。
(3)照射技术
保乳术后放疗可以通过三维适形放疗、固定野或旋转调强等照射技术进行。无论采取何种技术,推荐采用CT定位并勾画靶区,将CT图像导入三维计划治疗系统上进行计划评估,以准确评估靶区及危及器官的剂量分布。CT定位时,应采用铅丝标记患侧乳腺外轮廓及乳腺原发灶手术瘢痕,以利于确定全乳腺及瘤床补量照射范围。呼吸控制技术,如深吸气屏气、俯卧定位等,可能进一步降低正常器官,主要是心肺的照射剂量,推荐在有条件的单位中开展。
与二维放疗相比,三维适形及调强照射有助于改善靶区内的剂量均匀性,降低正常组织的受照剂量,更好的处理乳腺与区域淋巴结照射野的衔接,在乳腺体积大、需要进行区域淋巴结照射的情况下更有优势,但增加了计划设计的复杂程度。推荐根据患者的病情、照射范围及合并症情况等个体化的选择照射技术。
乳腺瘤床补量可采用术中放疗、组织间插植、电子线或X线外照射等方式实现。推荐外科医师在肿瘤切缘放置钛夹,为瘤床补量提供参照。
(4)照射剂量及分割模式推荐的全乳+/-区域淋巴结的照射剂量为50Gy/2Gy/25f。外照射瘤床补量可序贯于全乳放疗后,序贯照射剂量:10-16Gy/2Gy/5~8f。在有经验的单位,可以考虑瘤床同步加量照射,如瘤床同步照射剂量:60Gy/2.4Gy/25f。对仅行全乳照射的患者,推荐可给予大分割放疗:40Gy/15f或42.5Gy/16f。在有经验的单位,也可采用43.5Gy/15f/3w的分割模式。外照射瘤床补量序贯于全乳大分割放疗后,可采用常规分割模式:10~16Gy/2Gy/5~8f或大分割模式10-12.5Gy/4~5f。在有经验的单位,也可采用大分割序贯补量模式:8.7Gy/3f。推荐开展针对瘤床同步大分割加量模式的临床研究,如瘤床同步照射剂量:49.5Gy/15f。
在有经验的单位,对于行全乳+区域淋巴结照射的患者,可考虑采用大分割照射模式,照射剂量与全乳大分割照射相同。
(5)部分乳腺照射
数项研究提示,在低危乳腺癌保乳术后患者中,部分乳腺照射可能获得与全乳照射相同的疗效。鉴于不同研究的入组人群、部分乳腺照射技术不同,且缺乏长期随访结果,推荐针对此问题开展更多高质量的临床研究。
除临床研究外,在有经验的单位中,在符合以下条件的乳腺癌保乳术后患者中,可考虑行部分乳腺照射:①年龄≥50岁;乳腺浸润性导管癌单灶病变且肿瘤直径≤2cm;手术切缘阴性≥2mm;经腋窝清扫或前哨淋巴结活检证实无腋窝淋巴结转移;无脉管瘤栓;且ER受体阳性。②低中级别导管内癌;且肿瘤直径≤2cm;手术切缘阴性≥3mm。
部分乳腺照射可以通过术中放疗、近距离插植或外照射进行。照射范围为乳腺瘤床。推荐的照射剂量包括:术中放疗:20Gy,单次完成;近距离插植:34Gy/3.4Gy/10f每日2次,间隔至少6小时,总治疗时间5天,或者其他等效生物分割剂量模式;外照射:38.5Gy/10f,bid,5天完成。RAPID研究的随访结果提示,外照射这种分割方式进行部分乳腺放疗的晚期美容效果相对较差,考虑到国内加速器相对不足的实际情况,也可采用38.5Gy/10fqd,或40Gy/10fqd的照射模式。
2.改良根治术后放射治疗
(1)适应证
符合以下任一条件的改良根治术后患者,应考虑给予术后辅助放疗
1)原发肿瘤最大直径>5cm,或肿瘤侵及乳腺皮肤、胸壁。
2)腋窝淋巴结转移≥4个;或存在锁骨上或内乳淋巴结转移。
3)原发肿瘤分期T1~2且腋窝淋巴结转移1-3个的患者,推荐在改良根治术后接受放射治疗。但对其中的无明显高危复发因素,即年龄≥50岁、肿瘤分级Ⅰ~Ⅱ级、无脉管瘤栓、腋窝淋巴结转移数1~2个、激素受体阳性的患者,可考虑省略放疗。
4)对改良根治术前接受新辅助化疗的患者,术后放疗指证参见“三、1.新辅助化疗后术后放射治疗”章节。
(2)照射范围
1)需要接受改良根治术后放疗的患者,照射范围应包括胸壁及锁骨上下区。
2)对腋窝淋巴结转移1~3个,且肿瘤位于内象限;或腋窝淋巴结转移≥4个的患者,在保证心肺安全的前提下,可考虑将内乳引流区包括在照射范围内。
3)对腋窝淋巴结清扫彻底的患者,放疗靶区不推荐包括患侧腋窝;对前哨淋巴结活检后发现淋巴结转移,但未行腋窝清扫或腋窝清扫不彻底的患者,放疗靶区应考虑包括腋窝。
(3)照射技术
改良根治术后放疗可以通过二维照射、三维适形放疗、固定野或旋转调强等照射技术进行。无论采取何种技术,均推荐采用CT定位并勾画靶区及危及器官,将CT图像导入三维计划治疗系统上进行个体化计划评估,以准确评估靶区及危及器官的剂量分布。同时,无论采取何种照射技术,应注意在胸壁表面增加组织补偿物(40%~60%照射剂量),以确保足够的皮肤剂量。
可参照传统二维照射方式设计照射野,如:锁骨上照射可采用单前野或前后对穿野照射,内乳淋巴引流区可采用电子线野照射,但要求锁骨上、内乳区90%的靶体积应达到90%的照射剂量。胸壁可采用切线野或电子线野照射,采用电子线照射时,照射范围可参照传统二维布野方式,包全手术疤痕和游离皮瓣范围。
与二维放疗相比,三维适形及调强放疗有助于保证靶区达到处方剂量、改善靶区内的剂量均匀性,降低正常组织的受照剂量,更好的处理胸壁与区域淋巴结照射野的衔接,个体化地治疗患者,但增加了计划设计的复杂程度。推荐根据患者的病情、照射范围及合并症情况等个体化的选择照射技术。采用适形调强放疗时,应准确勾画靶区,确保心肺安全,不显著增加其他正常器官,如甲状腺、健侧乳腺、患侧肩关节等的受照剂量。
(4)照射剂量及分割模式
推荐的改良根治术后的射剂量为50Gy/2Gy/25f。在有经验的单位,可考虑给予大分割放疗:40~43.5Gy/15f/3w。
(5)放射治疗与全身治疗的时序安排
对于有辅助化疗指征的患者,术后放射治疗应该在完成辅助化疗后开展;如果无辅助化疗指征,在切口愈合良好的前提下,术后8周内开始放射治疗。辅助赫塞汀治疗可以和术后放射治疗同期开展。放射治疗开始前,要确认左心室射血分数(LVEF)大于50%,同时尽可能降低心脏的照射剂量,尤其是患侧为左侧。辅助内分泌治疗可以与术后放射治疗同期开展。
3.特殊情况下的放射治疗
(1)新辅助化疗后术后放射治疗
新辅助化疗后放射治疗指证及照射范围应参照化疗前及术后的肿瘤分期决定,并参考患者的年龄和肿瘤特征。照射技术及剂量与未接受新辅助化疗的患者相同。
对新辅助化疗后接受保乳手术的患者,均应接受术后全乳放疗。对新辅助化疗前cN2~3或术后病理证实存在腋窝淋巴结转移的患者,放疗范围还应包括锁骨上下区+/-内乳淋巴结引流区。
对新辅助化疗后接受改良根治术的患者,如新辅助化疗前临床分期III期术后病理证实存在腋窝淋巴结转移,均应接受术后辅助放疗。放疗范围包括胸壁+锁骨上/下区+/-内乳淋巴结引流区。
(2)乳腺重建术后放射治疗
鉴于放疗显著增加植入物包膜挛缩、破裂的风险,影响乳腺自体或异体重建术后的美容效果,对预计需要接受改良根治术后放疗的患者,放疗专业医师应在术前即参与其重建术式选择的决策过程。
对于接受自体重建的患者,推荐自体重建手术在放疗后进行。对于接受假体植入的患者,可采用同期扩张器植入,后期更换永久假体的手术模式,放疗在永久性假体植入前进行。
接受乳腺重建术的患者,其术后放疗指证、放疗范围及剂量与未接受乳腺重建术的改良根治术后患者相同,可参照“2.改良根治术后放射治疗”章节。对放疗时已行乳腺重建的患者,推荐采用调强放疗技术,以更好的保证靶区内剂量分布的均匀性,避免对植入物的高剂量照射。
(3)局部区域复发后的放射治疗
胸壁和锁骨上淋巴引流区是乳腺癌根治术或改良根治术后复发最常见的部位。胸壁单个复发原则上手术切除肿瘤后进行放射治疗;若手术无法切除,应先进行放射治疗。既往未做过放射治疗的患者,放射治疗范围应包括全部胸壁和锁骨上/下区域。锁骨上复发的患者如既往未进行术后放射治疗,照射靶区需包括患侧全胸壁及锁骨上淋巴引流区。如腋窝或内乳淋巴结无复发,无需预防性照射腋窝和内乳区。预防部位的放射治疗剂量为DT45~50Gy/25f/5w,复发部位缩野补量至DT60~66Gy/30~33f/6~6.5w。既往做过放射治疗的复发患者,需要参考肿瘤复发间隔时间、首程放疗的剂量范围和副反应程度、以及再程放疗的可能疗效和副反应,来决定是否进行再程放疗。再程放疗时,仅照射复发肿瘤部位,不推荐大范围预防照射。
局部区域复发患者在治疗前需取得复发灶的细胞学或组织学诊断。
(四)化疗
1.乳腺癌辅助化疗
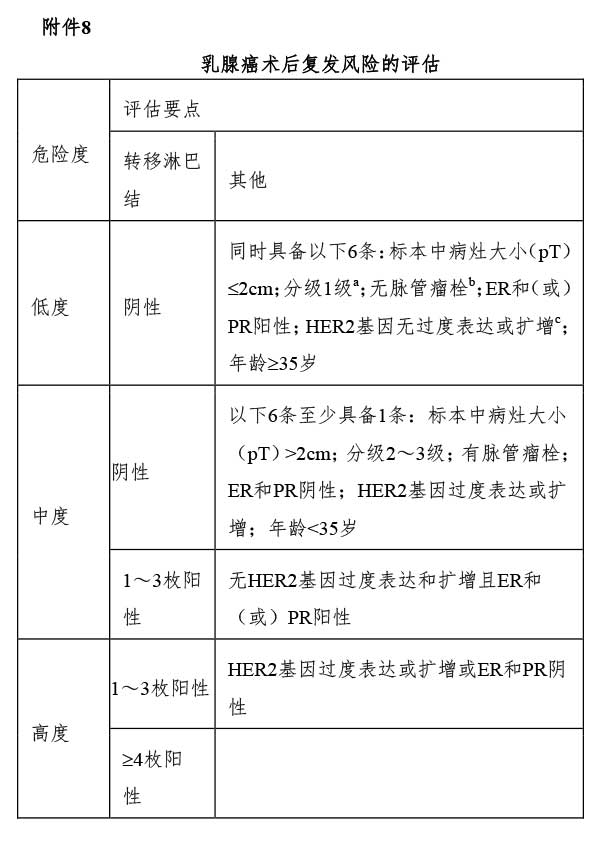
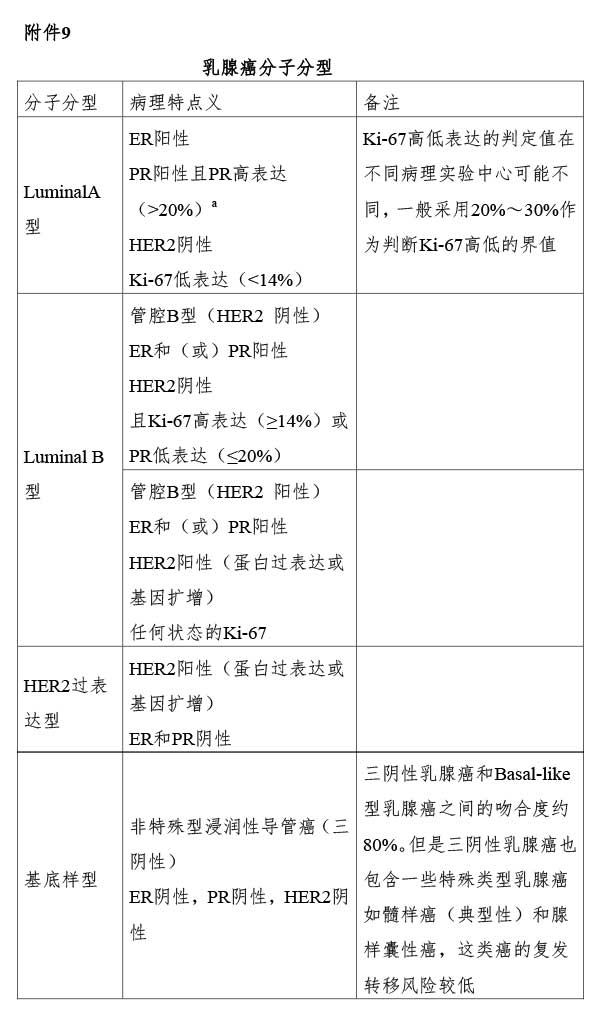
对患者基本情况(年龄、月经状况、血常规、重要器官功能、有无其他疾病等)、肿瘤特点(病理类型、分化程度、淋巴结状态、HER2及激素受体状况、有无脉管瘤栓等)、治疗手段(如化疗、内分泌治疗、靶向药物治疗等)进行综合分析,医师根据治疗的耐受性、术后复发风险、肿瘤分子分型和治疗敏感度选择相应治疗,并权衡治疗给患者带来的风险-受益,若接受化疗的患者受益有可能大于风险,可进行术后辅助化疗。乳腺癌术后复发风险的分层见附件8;乳腺癌分子分型的判定见附件9。
(1)适应证
1)腋窝淋巴结阳性。
2)对淋巴结转移数目较少(1~3个)的绝经后患者,如果具有受体阳性、HER2阴性、肿瘤较小、肿瘤分级Ⅰ级等其他多项预后较好的因素,或者患者无法耐受或不适合化疗,也可考虑单用内分泌治疗。
3)对淋巴结阴性乳腺癌,术后辅助化疗只适用于那些具有高危复发风险因素的患者(患者年龄<35岁、肿瘤直径>2cm、肿瘤、分级Ⅱ~Ⅲ级、脉管瘤栓、HER2阳性、ER/PR阴性等)。
(2)相对禁忌证
1)妊娠期:妊娠早、中期患者应慎重选择化疗。
2)年老体弱且伴有严重内脏器质性病变患者。
(3)辅助化疗方案的选择(常用的辅助化疗方案见附件10)
1)首选含蒽环类药物联合或序贯化疗方案,常用的有:①以蒽环类为主的方案,如CA(E)F、A(E)C、FEC方案(C:环磷酰胺,A:多柔比星,E:表柔比星,F:氟尿嘧啶)。虽然吡柔比星(THP)在欧美少有大规模的循证医学证据,但在我国临床实践中,可用吡柔比星代替多柔比星。②蒽环类与紫杉类联合方案,例如TAC(T:多西他赛)。③蒽环类与紫杉类序贯方案,例如AC→T/P(P:紫杉醇)或FEC→T。
2)不含蒽环类的联合化疗方案,适用于老年、低复发风险、存在蒽环类禁忌或不能耐受的患者,常用TC方案。
3)一般根据术后复发风险,选择不同的辅助化疗方案。高危患者,倾向于选择含蒽环和紫杉的方案,例如:AC-T、FEC-T、TAC、密集化疗AC-P等;中危患者,倾向于单含蒽环或单含紫杉的方案,例如:CAF、CEF、TC(6周期)等;需要化疗的低危患者,可选择4-6周期的单含蒽环或非蒽环方案,例如AC、EC、TC等。
4)三阴性乳腺癌,除部分肿瘤负荷较小的患者外(如T1,N0),一般推荐A(E)C-T(P)的化疗方案,剂量密集型A(E)C-T(P)方案可优选用于部分可耐受的三阴性乳腺癌患者。大多数Lumina1B乳腺癌患者需要接受术后辅助化疗,方案应包含蒽环和(或)紫杉类。LuminalA型乳腺癌对化疗反应较差,如淋巴结1-3个阳性可选择4~6周期的A(E)C或TC方案,但对淋巴结转移≥4个的高危患者,可推荐A(E)C-T(P)方案。
(4)注意事项
1)早期乳腺癌辅助化疗的目的是争取治愈,所以强调标准、规范的化疗。
2)化疗时应注意化疗药物的给药顺序、输注时间和剂量强度,严格按照药品说明和配伍禁忌使用。
3)根据患者的复发风险、耐受程度、患者意愿及循证医学证据选择化疗方案,并制定预防呕吐、骨髓抑制的支持方案
4)不同化疗方案的周期数不同,一般为4~8周期。若无特殊情况,不建议减少周期数和剂量。70岁以上患者需个体化考虑辅助化疗。
5)辅助化疗一般不与内分泌治疗或放疗同时进行,化疗结束后再开始内分泌治疗,放疗与内分泌治疗可先后或同时进行。
6)一般推荐首次给药剂量应按推荐剂量使用,若有特殊情况需调整时,通常不低于推荐剂量的85%,后续给药剂量应根据患者的具体情况和初始治疗后的不良反应,可以1次下调20%~25%。每个辅助化疗方案一般仅允许剂量下调2次。
7)激素受体阴性的绝经前患者,在辅助化疗期间可考虑使用卵巢功能抑制药物保护患者的卵巢功能。推荐化疗前1~2周给药,化疗结束后2周给予最后一剂药物。
8)蒽环类药物有心脏毒性,使用时须评估LVEF,一般每3个月1次。
9)所有化疗患者均需要先行签署化疗知情同意书。
2.新辅助化疗
新辅助化疗是指为降低肿瘤临床分期,提高切除率和保乳率,在手术或手术加局部放射治疗前,首先进行全身化疗。
(1)适应证
1)不可手术降期为可手术,临床分期为ⅢA(不含T3、N1、M0)、ⅢB、ⅢC。
2)期望降期保乳患者,临床分期为ⅡA、ⅡB、ⅢA(仅T3、N1、M0)期,除了肿瘤大小以外,符合保乳手术的其他适应证。对希望缩小肿块、降期保乳的患者,也可考虑新辅助治疗。
(2)禁忌证
1)未经组织病理学确诊的乳腺癌。推荐进行组织病理学诊断,并获得ER、PR、HER2及Ki-67等免疫组化指标,不推荐将细胞学作为病理诊断标准。
2)妊娠早期女性、妊娠中期女性患者应慎重选择化疗。
3)年老体弱且伴有严重心、肺等器质性病变,预期无法耐受化疗者。
4)原发肿瘤为广泛原位癌成分,未能明确浸润癌的存在。
5)肿瘤临床无法触及或无法评估。
(3)新辅助化疗方案的选择
原则上术后辅助化疗方案均可应用于新辅助化疗,推荐含蒽环类和(或)紫杉类药物的联合化疗方案,常用的化疗方案包括
1)蒽环类与紫杉类联合方案:A(E)T、TAC(T多西他赛)。
2)蒽环类与紫杉类序贯方案:剂量密集型AC(多柔比星/环磷酰胺)→紫杉醇,2周;剂量密集型AC(多柔比星/环磷酰胺)→单周紫杉醇;AC→多西他赛,3周;AC→单周紫杉醇。
3)其他含蒽环类方案:CAF、FAC、AC、CEF、FEC(C环磷酰胺、A阿霉素、E表阿霉素、F氟脲嘧啶)。
4)其他可能对乳腺癌有效的化疗方案。
5)HER2阳性患者化疗时应联合曲妥珠单克隆抗体治疗。
(4)注意事项。
1)化疗前必须对乳腺原发灶行空芯针活检明确组织学诊断及免疫组化检查,区域淋巴结转移可以采用细胞学诊断。
2)明确病理组织学诊断后实施新辅助化疗。
3)不建议Ⅰ期患者选择新辅助化疗。
4)一般周期数为4~8周期,在治疗有反应或疾病稳定的患者中,推荐手术前用完所有的既定周期数。
5)应从体检和影像学2个方面评价乳腺原发灶和腋窝淋巴结转移灶疗效,按照实体肿瘤疗效评估标准RECIST或WHO标准评价疗效。
6)无效时暂停该化疗方案,改用手术、放射治疗或者其他全身治疗措施(更换化疗方案或改行新辅助内分泌治疗)。
7)新辅助化疗后,即便临床上肿瘤完全消失,也必须接受既定的后续手术治疗,根据个体情况选择乳腺癌根治术、乳腺癌改良根治术或保留乳房手术。
8)术后辅助化疗应根据术前新辅助化疗的周期、疗效及术后病理检查结果确定治疗方案。
9)推荐根据化疗前的肿瘤临床分期来决定是否需要辅助放疗及放疗范围。
3.晚期乳腺癌化疗
晚期乳腺癌的主要治疗目的不是治愈患者,而是提高患者生活质量、延长患者生存时间。治疗手段以化疗和内分泌治疗为主,必要时考虑手术或放射治疗等其他治疗方式。根据原发肿瘤特点、既往治疗、无病生存期、转移部位、进展速度、患者状态等多方面因素,因时制宜、因人制宜,选择合适的综合治疗手段,个体化用药。
有转移或复发表现的乳腺癌患者的分期评估检查包括病史、体格检查、实验室检查、胸部X线或CT、腹部超声、骨显像等。对疼痛或骨显像异常患者行骨的放射学检查,还可考虑腹部诊断性CT或MRI、头颅CT或MRI。通常不建议使用PET-CT对患者进行评估,在其他检查结果不确定或可疑时PET-CT是可选择的。肿瘤转移灶或第一复发灶的活检应作为晚期乳腺癌患者病情评估的一部分,同时检测ER、PR、HER2、Ki-67等分子标志物,以制订针对性治疗方案。
(1)符合下列某一条件的患者首选化疗。
1)年龄小于35岁。
2)疾病进展迅速,需要迅速缓解症状。
3)ER/PR阴性或低表达。
4)无病生存期较短(<2年)。
5)广泛或有症状的内脏转移。
6)ER/PR阳性内分泌治疗失败者。
(2)化疗药物与方案(晚期乳腺癌常用化疗方案见附件11)。
晚期乳腺癌常用的化疗药物包括蒽环类、紫杉类、长春瑞滨、卡培他滨、吉西他滨、铂类等。应根据疾病的范围、肿瘤的分子特征、既往治疗及患者的特点来制订个体化的化疗方案。制订方案时应充分考虑患者的意愿,疾病的不可治愈性,平衡生活质量和生存期。在疾病发展的不同阶段合理选择单药或联合化疗。
1)单药化疗
对肿瘤发展相对较慢,肿瘤负荷不大,无明显症状,特别是老年耐受性较差的患者优选单药化疗。
常用的单药包括:紫杉醇、多西他赛、白蛋白结合型紫杉醇、卡培他滨、长春瑞滨、吉西他滨、多柔比星脂质体等;依托泊苷胶囊、环磷酰胺片等口服方便,可以作为后线治疗的选择。
2)联合化疗
适合病情进展较快,肿瘤负荷较大或症状明显的患者。联合化疗方案的选择应参考既往辅助化疗用药,化疗结束时间,目前患者的身体和经济条件等因素综合考量。
a.对既往未用过化疗者,首先考虑蒽环联合紫杉类药物。蒽环类治疗失败或达累积剂量者,优先选择紫杉类为基础的药物。辅助治疗用过紫杉类,距离复发时间大于1年者,可以再次使用,优选未用过的药物。紫杉类联合吉西他滨或卡培他滨是一线治疗最常用的方案。既往使用过蒽环及紫杉类治疗失败者,可考虑含卡培他滨、长春瑞滨或吉西他滨等的联合方案。
b.一线化疗进展后,可以根据患者的耐受性,病变范围,既往治疗的疗效和毒性个体化的选择没有交叉耐药的单药或联合方案。对既往治疗有效,疾病控制时间较长的药物,后线治疗仍然可以再次应用。
c.对多程化疗失败的患者无标准治疗,鼓励患者参加新药临床试验或对症支持治疗。
d.对HER2阳性患者,化疗同时应联合抗HER2靶向药物,如曲妥珠单抗,拉帕替尼等。
3)维持化疗
对完成了4~6周期化疗,治疗有效、耐受性较好的患者,可以持续治疗至病情进展或出现不能耐受的毒性。维持治疗可以是原有效方案,也可以是其中的一个药物。维持治疗中应该加强患者管理,定期评估疗效和不良反应。
对不能耐受维持化疗的患者,也可以停药休息,定期监测病情变化,疾病再次进展后重新治疗。ER阳性的患者也可以改用内分泌药物作为维持治疗。
(五)内分泌治疗
1.辅助内分泌治疗
(1)适应证
1)激素受体ER和或PR阳性的浸润性乳腺癌患者。
2)原位癌患者如出现以下情况可考虑行5年内分泌治疗:①保乳手术后需要放疗患者,特别是其中激素受体阳性的导管原位癌;②仅行局部切除导管原位癌患者;③行乳腺全切患者,用于预防对侧乳腺癌发生。
(2)禁忌证
1)使用内分泌药物有禁忌的患者:有深部静脉血栓或肺栓塞史者。
2)严重肝肾功能损伤者慎用。
3)孕妇及既往应用内分泌治疗药物过敏者。
(3)药物选择
1)绝经前患者辅助内分泌治疗首选他莫昔芬。
2)对于中高复发风险的绝经前患者(年轻乳腺癌患者,高组织学分级及淋巴结受累者)可考虑在辅助内分泌治疗中应用卵巢抑制剂,他莫昔芬或芳香化酶抑制剂加卵巢切除或卵巢抑制治疗5年。
3)他莫昔芬治疗期间,如果患者已经绝经,可以换用芳香化酶抑制剂。
4)绝经后患者优先选择第三代芳香化酶抑制剂,建议起始使用。
5)不能耐受芳香化酶抑制剂的绝经后患者,仍可选择他莫昔芬。
(4)注意事项
1)患者应在化疗之前进行激素水平的测定,判断月经状态,绝经定义见附件12。
2)术后辅助内分泌治疗的治疗期限为5年,延长内分泌治疗需要根据患者的具体情况个体化处理,需要结合肿瘤复发的高危因素和患者的意愿综合决策;对于高危绝经前患者,若在他莫昔芬治疗满5年后患者仍未绝经,可以根据情况增加至10年,如果患者在治疗过程中绝经,可考虑延长芳香化酶抑制剂治疗,直至完成10年的内分泌治疗。
3)辅助内分泌治疗(LHRHa除外)不建议与辅助化疗同时使用,一般在化疗之后使用,可以和放疗及曲妥珠单抗治疗同时使用
4)ER和PR阴性的患者,不推荐进行辅助内分泌治疗。
5)内分泌治疗中常见不良反应的监测和管理:①在应用他莫昔芬过程中应注意避孕,需要对子宫内膜进行超声监测,每6~12个月进行1次妇科检查。②对于应用芳香化酶抑制剂患者应监测骨密度和补充钙剂及维生素D。对于严重骨质疏松患者可进行正规抗骨质疏松治疗。③患者在接受芳香化酶抑制剂治疗期间应监测血脂,必要时应给予血脂异常患者相应的治疗。对于在内分泌治疗中严重的不良反应需要考虑停药或者更换治疗方案。
2.晚期乳腺癌的内分泌治疗
(1)首选内分泌治疗的适应证
1)患者年龄大于35岁。
2)无病生存期大于2年。
3)仅有骨和软组织转移。
4)无症状的内脏转移。
5)ER和(或)PR阳性。
6)受体不明或受体为阴性的患者,如临床病程发展缓慢,也可以试用内分泌治疗。
(2)药物选择
1)没有接受过内分泌治疗或无病生存期较长的绝经后复发或转移的患者,可以选择氟维司群、第三代芳香化酶抑制剂、他莫昔芬、CDK4/6抑制剂联合第三代芳香化酶抑制剂。
2)一般绝经前患者优先选择他莫昔芬,亦可联合药物或手术去势。绝经后患者优先选择第三代芳香化酶抑制剂,通过药物或手术达到绝经状态的患者也可以选择芳香化酶抑制剂。
3)接受过他莫昔芬辅助治疗的绝经后患者可选第三代芳香化酶抑制剂、氟维司群。
4)既往接受过他莫昔芬和非甾体芳香化酶抑制剂辅助治疗失败的患者,可以选择氟维司群、依维莫司联合依西美坦、孕激素或托瑞米芬等,亦可考虑采用CDK4/6抑制剂联合内分泌治疗方案。
(3)注意事项
1)连续两线内分泌治疗后肿瘤进展,通常提示内分泌治疗耐药,应该换用细胞毒药物治疗或进入临床试验研究。
2)在内分泌治疗期间,应每2~3个月评估1次疗效,对达到治疗有效或疾病稳定患者应继续给予原内分泌药物维持治疗,如肿瘤出现进展,应根据病情决定更换其他机制的内分泌治疗药物或改用化疗等其他治疗手段。
(六)靶向治疗
目前,针对HER2阳性的乳腺癌患者可进行靶向治疗,国内主要药物是曲妥珠单克隆抗体。
1.HER2阳性的定义
(1)HER2基因扩增:免疫组化染色3+、FISH阳性或者色素原位杂交法(CISH)阳性。
(2)HER2免疫组化染色(2+)的患者,需进一步行FISH或CISH检测HER2基因是否扩增。
⒉注意事项
(1)治疗前必须获得HER2阳性的病理学证据。
(2)曲妥珠单克隆抗体6mg/kg(首剂8mg/kg)每3周方案,或2mg/kg(首剂4mg/kg)每周方案。
(3)首次治疗后观察4~8个小时。
(4)一般不与阿霉素化疗同期使用,但可以序贯使用。
(5)与非蒽环类化疗、内分泌治疗及放射治疗可同期应用。
(6)曲妥珠单克隆抗体开始治疗前应检测左心室射血分数(LVEF),使用期间每3个月监测1次LVEF。出现以下情况时,应停止曲妥珠单克隆抗体治疗至少4周,并每4周检测1次LVEF。
①LVEF较治疗前绝对数值下降≥16%。
②LVEF低于该检测中心正常值范围,并且LVEF较治疗前绝对数值下降≥10%。
③如果4~8周内LVEF回升至正常范围或LVEF较治疗前绝对数值下降≤15%,可恢复使用曲妥珠单克隆单抗。
④如果LVEF持续下降超过8周,或因心肌病而停止曲妥珠单克隆抗体治疗3次以上者,应永久停止使用曲妥珠单克隆抗体。
3.术后辅助靶向治疗
(1)适应证
1)原发浸润灶>1cm(T1c及以上)的HER2阳性乳腺癌患者推荐使用曲妥珠单抗。
2)原发浸润灶在0.6-1cm的HER2阳性淋巴结阴性乳腺癌患者(T1bN0)及肿瘤更小、但腋窝淋巴结有微转移的患者(pN1mi)建议使用曲妥珠单抗。
3)原发浸润灶<0.5cm(T1a)的HER2阳性淋巴结阴性乳腺癌患者一般不推荐使用曲妥珠单抗,但伴有高危因素的患者,例如激素受体阴性、分级较高、Ki-67高等可以考虑使用。
(2)相对禁忌证
1)治疗前LVEF<50%。
2)同期正在进行蒽环类药物化疗。
(3)治疗方案选择(常用治疗方案见附件13)
1)可选择TCH或AC-TH方案,对于心脏安全要求较高的患者可选择TCH方案;对于高危复发风险患者,尤其是淋巴结阳性数≥4个患者可优先考虑AC-TH方案。
2)小肿瘤患者(肿瘤直径≤1cm)患者可以选择紫杉醇周疗加曲妥珠单抗(wPH)方案治疗。
3)辅助化疗联合曲妥珠单抗基础上加用帕妥珠单抗可以带来进一步的生存获益,因此有条件的患者可考虑联合帕妥株单抗治疗。
(4)注意事项
1)不与蒽环类药物同时使用,但可以与紫杉类药物同时使用。紫杉类辅助化疗期间或化疗后开始使用曲妥珠单克隆抗体。
2)曲妥珠单克隆抗体辅助治疗期限为1年。
3)曲妥珠单克隆抗体治疗期间可以进行辅助放射治疗和辅助内分泌治疗。
4.术前新辅助靶向治疗
HER2阳性乳腺癌对抗HER2靶向治疗敏感度高,在这部分患者的新辅助治疗方案中应包含抗HER2靶向治疗。
(1)新辅助靶向治疗药物的选择与原则
1)曲妥珠单抗是目前新辅助靶向治疗的“金标准”。
2)辅助治疗中含曲妥珠单抗方案均可用于新辅助治疗,但有新辅助治疗指征者多为相对高危患者,如无药物使用禁忌,首选初始联合使用含紫衫类化疗与抗HER2靶向治疗。
3)在新辅助靶向治疗中加入帕妥珠单抗可以显著提高病理完全缓解率,因此对于有条件的HER2阳性患者,在新辅助治疗方案中可以加入帕妥珠单抗。
4)有蒽环类药物使用禁忌、高龄或其他心脏疾病隐患的患者可以使用不含蒽环方案如TCH方案。
(2)注意事项
1)新辅助治疗期间应严密监测疗效,按照RECIST或WHO标准评价原发灶和(或)淋巴结的疗效,应用曲妥珠单抗治疗期间进展的患者在后续新辅助治疗中可考虑保留曲妥珠单抗。
2)接受新辅助靶向治疗的患者辅助阶段应补足辅助曲妥珠单抗治疗至1年。
3)单独新辅助靶向治疗或与内分泌治疗联用尚缺乏足够的证据,应用应限制于临床研究。
5.晚期HER2阳性乳腺癌的靶向治疗(常用治疗方案见附件14)
(1)HER2阳性晚期肿瘤的一线治疗选择
1)既往蒽环类辅助化疗药物治疗失败的HER2阳性复发转移乳腺癌,首选曲妥珠单抗联合紫杉类药物作为一线方案。
2)紫杉类化疗药物治疗失败的HER2阳性乳腺癌,曲妥珠单抗也可与长春瑞滨、卡培他滨、吉西他滨等化疗药物联合。
3)在曲妥珠单抗联合紫杉类药物的基础上加用帕妥珠单抗进一步延长患者生存,但目前帕妥珠单抗尚未在国内批准上市。
4)辅助治疗使用过曲妥珠单抗治疗的晚期乳腺癌患者,建议所有患者仍应继续抗HER2治疗。对停用曲妥珠单抗至复发间隔时间>12个月以上的患者,仍推荐选用曲妥珠单抗联合细胞毒药物作为一线方案;而停用曲妥珠单抗至复发间隔时间≤12个月患者则建议选用二线抗HER2方案治疗。
5)辅助治疗未使用过曲妥珠单抗患者,一线首选曲妥珠单抗联合化疗,一般不推荐一线使用拉帕替尼联合化疗。
6)对于HER2阳性/HR阳性的患者,如不适合化疗或病情进展缓慢者可以考虑抗HER2治疗联合内分泌药物作为一线治疗选择。
(2)经曲妥珠单抗治疗后疾病进展的治疗选择
1)曲妥珠单抗治疗病情进展后,仍应持续使用抗HER2靶向治疗。
2)当一线治疗后病情进展时可选择以下治疗策略。
①继续使用曲妥珠单抗,更换其他化疗药物:除紫杉类药物外,可更换的化疗药包括长春瑞滨、卡培他滨、吉西他滨、白蛋白紫杉醇、多柔比星脂质体等。
②换用其他抗HER2靶向药物:拉帕替尼联合卡培他滨是曲妥珠单抗治疗病情进展后的首选方案之一。此外,拉帕替尼还可与紫杉醇或长春瑞滨周疗方案联合使用。
③T-DM1单药治疗是目前国际上曲妥珠单抗治疗失败后的二线首选治疗方案,但在国内T-DM1尚未上市。
(3)注意事项
1)晚期患者建议使用曲妥珠单克隆抗体联合化疗。
2)激素受体阳性HER2阳性晚期乳腺癌
a.一般首选抗HER2治疗联合化疗。
b.针对高选择包括部分不适合化疗、肿瘤进展缓慢、单纯骨转移或软组织患者可首先考虑抗HER2治疗联合芳香化酶抑制剂治疗作为绝经后激素受体阳性HER2阳性晚期乳腺癌患者一线治疗选择。
c.对治疗有效或稳定患者,一般不采用单纯内分泌药物作为维持治疗方案,临床应采用抗HER2治疗联合内分泌治疗药物作为维持治疗方案。
d.若治疗后肿瘤完全缓解时限较长,也可暂时中断抗HER2治疗,待复发后再行抗HER2治疗,以减轻患者经济负担。
(七)中医治疗
中医药有助于减轻放疗、化疗、内分泌治疗的副作用和不良反应,调节患者免疫功能和体质状况,改善癌症相关症状和生活质量,可能延长生存期,可以作为乳腺癌治疗的重要辅助手段。
内伤情志、痰瘀互结、正气亏虚是乳腺癌的主要病因、病机,疏肝解郁、化痰散瘀、调补气血、滋补肝肾是相应主要治法。在辩证论治法则基础上,采用中药汤剂治疗是中医治疗的主要方式。此外,秉承中医外科治疗思想,以“阴证”“阳证”论治乳腺癌是临床常用方法。小金丸和西黄丸是治疗乳腺癌“阴证”“阳证”的代表性中成药,临床中得到广泛应用。在中医师指导下正确使用中成药,患者的安全性和耐受性均较好。
六、诊疗流程
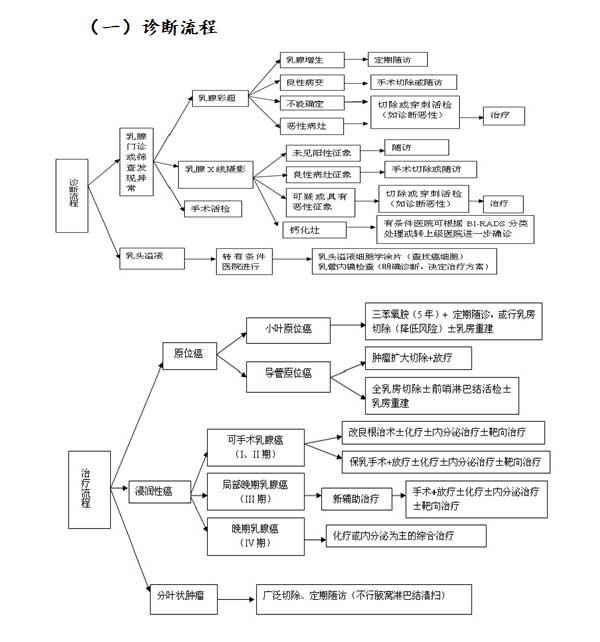
七、随访
(一)临床体检:最初2年每4~6个月1次,其后3年每6个月1次,5年后每年1次。
(二)乳腺超声:每6个月1次。
(三)乳腺X线照相:每年1次。
(四)胸片或胸部CT:每年1次。
(五)腹部超声:每6个月1次,3年后改为每年1次。
(六)存在腋窝淋巴结转移4个以上等高危因素的患者,行基线骨显像检查,全身骨显像每年1次,5年后可改为每2年1次。
(七)血常规、血液生化、乳腺癌标志物的检测每6个月1次,3年后每年1次。
(八)应用他莫昔芬的患者每年进行1次盆腔检查。
附件:
1.乳腺影像学诊断报告基本规范
2.乳腺癌的组织学分型
3.乳腺浸润性癌组织学分级
4.乳腺癌的TNM分期(AJCC第8版)
5.乳腺癌病理报告内容及基本格式
6.乳腺癌HER2/neuFISH检测报告基本格式
7.保留乳房手术后美容效果评价标准
8.绝经的定义
附件1
乳腺影像学诊断报告基本规范
一、X线部分
报告内容包括以下5方面:检查适应证证;乳腺构成成分的简要描述;重要征象的清晰描述;与既往片比较;评估分类及处理。
(一)检查适应证证
无症状筛查;筛查召回;临床有症状;良性病变或乳腺癌保乳术后的随访;假体植入。
(二)乳腺构成成分的简要描述
主要根据乳腺构成的纤维腺体组织密度高低和分布范围分为四种类型:a,脂肪型;b,散在纤维腺体型;c,不均匀致密型;d,极度致密型。
(三)重要征象的清晰描述
采用乳腺X线专业词汇对病灶进行描述。
1.肿块:大小、形态、边缘、密度
2.钙化:形态、分布
3.结构扭曲
4.不对称致密
5.其他少见的重要征象:乳房内淋巴结,皮肤病变,孤立性扩张导管。
6.伴随征象:皮肤回缩,乳头回缩,皮肤增厚,小梁结构增厚,腋窝淋巴结增大,结构扭曲,钙化。
病灶的位置:左侧/右侧;象限和钟面;深度;距乳头的距离。
(四)与既往片比较
(五)评估分类及处理建议
1.评估是不完全的
0类:现有影像未能完成评估,需要结合既往片或其他影像检查,包括加压点片、加压放大、加拍其他体位,或行超声检查。
2.最终类别
1类:阴性,乳腺X线摄片无异常发现,恶性可能性0,建议常规随诊。
2类:良性发现,存在明确的良性改变,无恶性征象,恶性可能性0,建议常规随诊。包括钙化的纤维腺瘤、皮肤钙化、多发的分泌性钙化、含脂肪的病变(脂性囊肿、脂肪瘤及混合密度的错构瘤)、乳腺内淋巴结、血管钙化、植入体、有手术史的结构扭曲等。
3类:良性可能大,恶性可能性0~2%,建议短期随访。期望此病变在短期(小于1年,一般为6个月)随访中稳定或缩小来证实判断。触诊阴性的无钙化边界清晰的肿块、局灶性的不对称、簇状圆形和(或)点状钙化这三种征象被归于此类。建议6个月后对病灶侧乳腺进行X线摄影复查,第12个月与24个月时对双侧乳腺进行X线摄影复查,如果病灶保持稳定2~3年,则将原先的3类判读为2类;若病灶有进展,应考虑活检。
4类:可疑异常,但不具备典型的恶性征象,恶性可能性2%~95%,应考虑活检。这一类包括了一大类需临床干预的病变,缺乏特征性的乳腺癌形态学改变,但有恶性的可能性。再继续分成4A、4B、4C,临床医师和患者可根据其不同的恶性可能性对病变的处理做出最后决定。
4A:恶性可能性2%~10%。对活检或细胞学检查为良性的结果比较可以信赖,可以常规随访或6个月后随访。可扪及的部分边缘清晰的实性肿块,如超声提示的纤维腺瘤、可扪及的复杂囊肿或可扪及的脓肿均归于此类。
4B:恶性可能性10%~50%。需要对病理结果和影像表现严格对照,良性病理结果的决策取决于影像和病理的一致性。对边界部分清晰、部分浸润的肿块穿刺为纤维腺瘤或脂肪坏死的可以接受,并予随访。而对穿刺结果为乳头状瘤或不典型增生的则需要进一步切取活检。
4C:恶性可能性50%~95%。形态不规则、边缘浸润的实性肿块或新出现的簇状分布的细小多形性钙化可归于此类。
5类:高度怀疑恶性,恶性可能性≥95%。有典型乳腺癌的影像学特征,临床应采取适当措施。形态不规则、毛刺状边缘的高密度肿块、段或线样分布的细线状和分支状钙化、不规则带毛刺的肿块伴多形性钙化均归于此类。
6类:已活检证实为恶性,临床应采取积极的治疗措施。这一分类用于活检已证实为恶性但还未进行治疗的影像评价。主要是评价活检后的影像改变,或监测术前治疗的影像改变。
二、超声部分
超声的报告内容包括
(一)临床病史、检查指征
(二)是否有相关的既往超声进行比较
(三)超声扫查范围及检查技术
(四)病变描述
1.简要描述扫描范围乳腺组织类型。
2.病灶大小测量(至少测量2个径线),小的单纯性囊肿不必全部测量。
3.病灶位置(采用钟面描述,还需描述病灶距离乳头的深度)。
4.采用超声专业词汇对病灶进行简要描述。
(五)结合相关的临床体检、X线摄影、MRI或其他影像检查
(六)总体评估及处理建议
乳腺病灶的超声评估分类参照NCCN筛查及诊断指南提出的BI-RADS(Breast imaging reporting and data system)分类标准。
1.评估不完全
0类:现有影像未能完成评估,需要其他影像检查进一步评估或与既往检查比较。
2.评估完全。
1类:阴性,无异常所见(如有发现乳内、腋前正常形态淋巴结,亦属于1类)。建议常规体检(每年1次)。
2类:良性病变,包括单纯性囊肿、积乳囊肿;乳房内移植物;稳定的术后改变;随访后无变化的纤维腺瘤。建议定期随访(每6个月至1年1次)。
3类:良性可能大。包括边缘光整、呈圆形或椭圆形、横径大于高径的实性肿块,很可能是纤维腺瘤;还包括触诊阴性的复杂囊肿和簇状微囊肿。建议短期随访(每3-6月一次),2年随访无变化者可降为2类。
4类:可疑恶性
4A:低度可疑恶性(≥3%-≤10%)。病理报告结果一般为非恶性,在获得良性的活检或细胞学检查结果后应进行6个月或常规的随访。例如可扪及的、局部界限清楚的实质性肿块,超声特征提示为纤维腺瘤;可扪及的复杂囊肿或可能的脓肿。
4B:中度可能恶性的病灶(>10%至≤50%)。需综合影像学检查与病理学结果。部分界限清楚部分界限不清的纤维腺瘤或脂肪坏死可进行随访,但乳头状瘤则可能需要切除活检。
4C:恶性可能较大(>50%至≤94%),但不象5级那样典型的恶性。例如边界不清的不规则实质性肿块或新出现的簇状细小多形性钙化。该级病灶很可能会是恶性的结果。建议行病理学检查(如细针抽吸细胞学检查、空芯针穿刺活检、手术活检)以明确诊断。
5类:高度可疑恶性,临床应采取适当措施(几乎肯定的恶性)。超声有特征性的异常征象,恶性的危险性大于95%。应开始进行确定性治疗。考虑前哨淋巴结显像和新辅助化疗时,宜进行影像导引下空芯针穿刺活检,以取得组织学诊断。
6类:已行活检证实为恶性,临床应采取适当措施。这一分类用于活检已证实为恶性但还未进行治疗的影像评价上。主要是评价活检后的影像改变,或监测手术前新辅助化疗的影像改变。
三、乳腺MR部分
报告内容包括以下6方面:检查适应证;扫描技术;乳腺构成成分的简要描述;征象的描述;与既往检查片对比;评估分类和处理建议。
(一)检查适应证
1.检查指征:如筛查,新辅助化疗疗效评估,术前分期等。
2.临床病史:患者的症状,体征,月经史及月经周期,有无激素替代治疗或抗激素治疗史,有无胸部放疗史,乳腺手术史及病理结果。
(二)扫描技术
除了只进行假体植入物的评价外,乳腺MRI检查均需进行增强扫描。扫描序列至少包括:①增强扫描序列:增强前的蒙片,注入对比剂后至少连续扫描3次,时间上至少达到4min以上。成像参数:扫描层厚≤3mm,层面内的分辨率小于1.5mm,单次扫描时间不应超过2分钟。②T2WI序列(加抑脂序列)。③DWI序列。图像后处理包括绘制时间-信号强度增强曲线,ADC值测量,图像减影和三维重建。
(三)乳腺构成成分的简要描述
1.乳腺的纤维腺体构成:四种类型:a,脂肪型;b,散在纤维腺体型;c,不均匀致密型;d,极度致密型。
2.乳腺背景实质强化:四种类型,几乎无背景强化、轻度背景强化、中度背景强化和明显背景强化。
(四)征象的描述
采用乳腺MRI专业词汇对病灶进行描述。
1.点状强化
2.肿块:形态、边缘、内部强化特征
3.非肿块样强化:分布、内部强化特征
4.乳腺内淋巴结
5.皮肤病变
6.无强化病变:囊肿、术后血肿、治疗后皮肤增厚
7.相关征象:乳头回缩、皮肤回缩,腋窝增大淋巴结
8.时间-信号强度曲线:分为2部分,早期强化和延迟强化。早期强化指注入对比剂后最初2分钟或曲线开始变化时的强化率,分为缓慢强化(强化率小于50%)、中等强化(50%~100%)和快速强化(大于100%)。曲线后面部分称为延迟强化,分为持续上升型,平台型和廓清型。
9.植入物
病灶的位置:左侧/右侧;象限和钟面;距乳头的距离。
(五)与既往片比较
(六)评估分类及处理建议
1.评估是不完全的
0类:现有影像未能完成评估,需要结合既往片或其他影像检查。一般MR检查后较少用这个分类。
2.最终类别
1类:阴性,恶性可能性0,建议常规随诊。
2类:良性发现,恶性可能性0,建议常规随诊。包括无强化的纤维腺瘤,囊肿、无强化的陈旧瘢痕、乳腺假体、含脂肪的病变(脂性囊肿、脂肪瘤及错构瘤)等。
3类:可能是良性的病变,恶性可能性小于2%,建议短期随访。需通过随访确定其稳定性。较可疑者可3个月后随访,一般6个月后复查。
4类:可疑异常,但不具备典型的恶性征象,恶性可能性2%-95%,应考虑活检。此类病变无特征性的乳腺癌形态学改变,但有恶性的可能性。
5类:高度怀疑恶性,恶性可能性≥95%,临床应采取适当措施。
6类:已活检证实为恶性,临床应采取积极的治疗措施。
附件2

附件3

附件4
乳腺癌的pTNM分期
原发肿瘤(浸润性癌)(pT)
___pTX:原发肿瘤不能被估量
___pT0:无原发肿瘤证据#
___pTis(DCIS):导管原位癌#(小叶原位癌已从此分类中去除)
___pTis(Paget’s):乳头Paget病,不伴随乳腺实质中的浸润性癌和(或)原位癌(DCIS和(或)LCIS)成分#
___pT1:肿瘤最大径≤20mm(根据5mm、10mm可细分为T1a、T1b、T1c)
___pT1mi:肿瘤最大径≤1mm(微小浸润性癌)
pT1a:1mm<肿瘤最大径≤5mm(1.0-1.9mm之间的肿瘤均计为2mm)。
pT1b:5mm<肿瘤最大径≤10mm。
pT1c:10mm<肿瘤最大径≤20mm。
___pT2:20mm<肿瘤最大径≤50mm
___pT3:肿瘤最大径>50mm
___pT4:任何大小肿瘤直接侵犯胸壁和(或)皮肤(形成溃疡或肉眼肿块);仅有肿瘤侵及真皮不诊断T4
___pT4a:侵犯胸壁(不包括单纯胸大、小肌受累)
___pT4b:皮肤溃疡,和(或)同侧肉眼可见的卫星结节,和(或)皮肤水肿(包括橘皮征)但不到炎性乳癌的诊断标准(仅有镜下可见的皮肤卫星结节,且无皮肤溃疡或水肿,不诊断T4b)
___pT4c:T4a和T4b
___pT4d:炎性乳癌##
(注:新辅助化疗后ypT应根据残余的最大肿瘤灶计算,浸润癌旁治疗相关的纤维化区域不计入肿瘤最大径;多灶残留应标注m)
注:肿瘤大小精确到mm
为了列表的目的,这些项目应当只用于先前确诊为浸润性癌,经术前(新辅助)治疗后无残留浸润癌的情况
炎性乳癌是一个临床-病理学名词,特征是弥漫红肿和水肿(橘皮),累及乳腺皮肤1/3或更多。皮肤的改变归因于淋巴水肿,是由皮肤淋巴管内瘤栓引起的,这在小块皮肤活检中可以不明显。然而,对于确定乳腺组织中或至少是皮肤淋巴管内浸润性癌以及其生物学指标如ER,PR,HER2状态,组织学诊断仍是必须的。具有皮肤淋巴管内瘤栓而无皮肤的上述临床改变不能定义为炎性乳癌。局部乳腺癌直接侵犯真皮或溃破皮肤而无上述皮肤的临床改变以及真皮淋巴管瘤栓也不能定义为炎性乳癌。因此,炎性乳癌这个词不应该误用于局部晚期乳腺癌。罕见病例表现炎性乳癌的所有特征,但其皮肤病损累及范围小于1/3,应该根据潜在癌的大小和尺寸来分类。
同时性同侧多发癌(多中心):按最大的癌灶进行T分期,并记录其他癌灶的大小;注意除外癌灶伴卫星结节和复杂形状癌灶(病理取材结合临床影像)
区域淋巴结(pN)
___pNX:不能评估区域淋巴结
___pN0:无区域淋巴结转移或仅有ITCs
___pN0(i-):组织学无转移,IHC阴性
___pN0(i+):仅有ITCs:肿瘤细胞簇≤0.2mm(单个淋巴结中可有多灶ITC,最大者必须≤0.2mm;若ITCs细胞总数大于200,则应诊断为微转移)
___pN0(mol-):组织学无转移,RT-PCR阴性
___pN0(mol+):未检测到ITCs,但RT-PCR阳性
___pN1mi:微转移(约200个细胞,>0.2mm,≤2.0mm)
___pN1a:1-3个淋巴结有转移,至少一个肿瘤灶>2.0mm
___pN1b:转移至同侧内乳前哨淋巴结(胸骨旁,转移灶>0.2mm),腋窝淋巴结阴性。
___pN1c:N1a和N1b
___pN2a:4-9个腋窝淋巴结转移(至少1个肿瘤灶>2.0mm)
___pN2b:临床检测到内乳(胸骨旁)淋巴结转移(有或无病理证实),不伴腋窝转移
___pN3a:≥10个腋窝淋巴结有转移(至少1个肿瘤灶>2.0mm)或锁骨下淋巴结(腋顶部)转移
___pN3b:pN1a或pN2a伴有cN2b(影像学证实的内乳淋巴结转移);或pN2a伴有pN1b。
___pN3c:转移至同侧锁骨上淋巴结
分期:T1包括T1mi,而N1mi对分期有意义;如果淋巴结只有前哨,则标记NX(sn)
远处转移(M)
___不适用
___cM0(i+):无临床或影像学证据证实远处转移;但在没有转移症状和体征的患者中,分子生物学或显微镜下检测到循环血中、骨髓中或其他非区域淋巴结组织中有≤0.2mm的肿瘤细胞群
___pM1:临床和影像学手段检查到远处转移和(或)组织学证实转移灶>0.2mm

附件5

肉眼所见
(1)左乳癌改良根治标本,大小25cm×16cm×5.4cm,附梭皮,面积12.5cm×4cm,乳头皮肤未见异常。切面于外上现象距乳头3.5cm见一肿物,大小3.4cm×2.5cm×1.2cm,切面灰白质硬,界欠清,距胸肌筋膜0.5cm,未累及乳头皮肤。周围乳腺部分区灰白质韧。(5)腋窝找到结节数枚,直径0.2~1.8cm。
病理诊断
乳腺癌新辅助治疗后
(1)(左乳癌改良根治标本)
乳腺浸润性癌,非特殊类型,III级(3+3+2=8分),伴少许高级别导管原位癌(约5%),可见脉管瘤栓及神经侵犯,部分肿瘤细胞退变,伴间质纤维化及局灶淋巴细胞、组织细胞浸润,符合轻度治疗后改变(Miller&Payne分级,2级)。肿瘤大小3.4cm×2.5cm×1.2cm(浸润癌成分),未累及乳头、皮肤及胸肌筋膜。周围乳腺呈腺病改变,伴部分导管上皮普通型增生。
淋巴结转移性癌(4/22),部分淋巴结伴轻度治疗后改变。

附件6
乳腺癌HER2/neuFISH检测报告基本格式
病理号
病案号
FISH检测编号
姓名性别年龄民族
病房送检医师送检材料1:接收日期
病理诊断
检测结果附图
HE染色 免疫组化染色
FISHFISH对照
共计数肿瘤细胞()个。
HER2基因拷贝数目总计()个,每个细胞核平均HER2拷贝数()。
CEP17拷贝数目总计()个,每个细胞核平均CEP17拷贝数()。
HER2/CEP17比值=()
FISH检测结果:在以下相应()内画“√”
比值<1.8(不扩增)阴性()
比值=1.8~2.2(临界值)临界值()
比值>2.2(扩增)阳性()
无法判定()
CEP17非整倍体:无□整倍有□:单体□单体□多体□体()
HER2基因遗传异质性:无□因遗有□(%)
HER2基因扩增细胞的分布方式:片状2状扩增细胞的分布)散在分布□散在分布□的分
注
1.如检测样本为针吸组织标本,建议行手术标本的FISH检测或复检。
2.如为片状扩增,应注明该区域HER2/CEP17的比值。
附件7
保留乳房手术后美容效果评价标准
Ⅰ留很好:病侧乳腺外形与对侧相同。
Ⅱ.好:病侧乳腺与对侧稍有不同,差异不明显。
Ⅲ.一般:与对侧有明显不同,但无严重畸形。
Ⅳ.差:病侧乳腺有严重畸形。
附件10
常用的辅助化疗方案
TAC方案
多西他赛75mg/m2iv第1天
多柔比星50mg/m2iv第1天
环磷酰胺500mg/m2iv第1天
21天为1个周期,共6个周期(所有周期均用G-CSF支持)。
剂量密集AC→P方案
多柔比星60mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
14天为1个周期,共4个周期
序贯以紫杉醇175mg/m2iv3小时第1天
14天为1个周期,共4个周期(所有周期均用G-CSF支持)。
AC→P/T方案
多柔比星60mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
21天为1个周期,共4个周期
序贯紫杉醇80mg/m2iv1小时第1天,每周1次,共12周
或紫杉醇175mg/m2iv1小时第1天,每3周1次,共12周
或多西他赛100mg/m2iv第1天,每3周1次,共12周。
TC方案
多西他赛75mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
21天为1个周期,共4个周期。
AC方案
多柔比星60mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
21天为1个周期,共4个周期。
FAC方案
氟尿嘧啶500mg/m2iv第1、8天
多柔比星50mg/m2iv第1天
环磷酰胺500mg/m2iv第1天
21天为1个周期,共6个周期。
EC方案
表柔比星90~100mg/m2iv第1天
环磷酰胺600~830mg/m2iv第1天
21天为1个周期,共8个周期。
FEC→T方案
氟尿嘧啶500mg/m2iv第l天
表柔比星100mg/m2iv第1天
环磷酰胺500mg/m2iv第1天
21天为1个周期,共3个周期
序贯以多西他赛100mg/m2iv第1天
21天为1个周期,共3个周期。
FEC→P方案
氟尿嘧啶600mg/m2iv第1天
表柔比星90mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
21天为1个周期,共4个周期
序贯以紫杉醇100mg/m2iv第1天
每周1次,共8周。
附件11
晚期乳腺癌常用化疗方案
优选单药
紫杉醇80mg/m2,静滴,第1、8、15天,28天为一周期
或175mg/m2,静滴,第1天,21天为一周期。
卡培他滨1000-1250mg/m2,口服,每日2次,第1-14天,21天为一周期。
吉西他滨800-1200mg/m2,静滴,第1、8、15天,28天为一周期。
长春瑞滨25mg/m2静滴;或60mg/m2口服,第1、8、15天,28天为一周期。
多柔比星脂质体50mg/m2,静滴,第1天,28天为一周期。
其他单药方案
多西他赛60-100mg/m2,静滴,第1天,21天为一周期。
白蛋白结合型紫杉醇100mg/m2或125mg/m2,静滴,第1、8、15天,
28天为一周期。
或260mg/m2,静滴,第1天,21天为一周期。
卡铂AUC5~6,静滴,第1天,21-28天为一周期。
顺铂75mg/m2,静滴,第1天,21天为一周期。
表柔比星60-90mg/m2,静滴,第1天,21天为一周期。
多柔比星60mg/m2,静滴,第1天,21天为一周期。
或20mg/m2,静滴,第1天,每周一次。
环磷酰胺50~100mg,口服,每日1次,第1-21天,28天为一周期。
依托泊苷胶囊75-100mg口服,第1-10天,21天为一周期。
联合化疗方案
常用化疗方案
TX
多西他赛75mg/m2,静滴,第1天
卡培他滨950~1000mg/m2,口服,每日2次,第1-14天
21天为一周期。
GT
吉西他滨1000-1250mg/m2,静滴,第1、8天
紫杉醇175mg/m2,静滴,第1天。
或多西他赛75mg/m2,静滴,第1天
21天为一周期。
GC
吉西他滨1000mg/m2,静滴,第1、8天
卡铂AUC2,静滴,第1、8天
21天为一周期
ET
表柔比星60-75mg/m2,静滴,第1天
多西他赛75mg/m2,静滴,第2天
21天为一周期
其他方案
CAF
环磷酰胺500mg/m2,静滴,第1天
多柔比星50mg/m2,静滴,第1天
5-氟尿嘧啶500mg/m2,静滴,第1、8天
21天为一周期
FEC
5-氟尿嘧啶500mg/m2,静滴,第1、8天
表柔比星50mg/m2,静滴,第1、8天
环磷酰胺400mg/m2,静滴,第1、8天
28天为一周期
AC
多柔比星60mg/m2,静滴,第1天
环磷酰胺600mg/m2,静滴,第1天
21天为一周期
EC
表柔比星75mg/m2,静滴,第1天
环磷酰胺600mg/m2,静滴,第1天
21天为一周期
CMF
环磷酰胺100mg/m2,口服,第1-14天
甲氨蝶呤40mg/m2,静滴,第1、8天
5-氟尿嘧啶600mg/m2,静滴,第1、8天
28天为一周期
附件12
绝经的定义
绝经通常是生理性月经永久性终止,或是乳腺癌治疗引起的卵巢合成雌激素的功能永久性丧失。绝经标准如下
双侧卵巢切除术后。
年龄≥60岁。
年龄<60岁,且在没有化疗和服用他莫昔芬、托瑞米芬和卵巢功能抑制治疗的情况下停经1年以上,同时血FSH及雌二醇水平符合绝经后的范围;而正在服用他莫昔芬、托瑞米芬,年龄<60岁的停经患者,必须连续检测血FSH及雌二醇水平符合绝经后的范围。
另外,还需要注意
正在接受LH-RH激动剂或拮抗剂治疗的妇女无法判断是否绝经。
辅助化疗前没有绝经的妇女,停经不能作为判断绝经的依据,因为患者在化疗后虽然会停止排卵或无月经,但卵巢功能仍可能正常或有恢复可能。
对于化疗引起停经的妇女,如果考虑采用芳香化酶抑制剂作为内分泌治疗,则需要考虑有效地卵巢抑制(双侧卵巢完整切除或药物抑制),或者连续多次监测FSH/或雌二醇水平已确认患者处于绝经后状态。
附件13
术后辅助靶向治疗常用治疗方案
AC→PH方案
多柔比星60mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
21天为1个周期,共4个周期
序贯
紫杉醇80mg/m2iv1小时周疗,共12周
曲妥珠单抗首剂4mg/kgiv,第一周,以后每次曲妥珠单抗2mg/kg,iv每周,共完成1年。也可在紫杉醇化疗后,改变曲妥珠单抗给药方式为6mg/kgiv,每3周,共完成1年。
ddAC→PH方案
多柔比星60mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
14天为1个周期,共4个周期
序贯
紫杉醇175mg/m2iv3h,每14天为1个周期,共4个周期
曲妥珠单抗首剂4mg/kgiv,第一周,以后每次曲妥珠单抗2mg/kg,iv每周,共完成1年。也可在紫杉醇化疗后,改变曲妥珠单抗给药方式为6mg/kgiv,每3周,共完成1年。(所有周期均用G-CSF支持)。
TCH方案
多西他赛75mg/m2iv第1天
卡铂AUC=6iv第1天
21天为1个周期,共6个周期
曲妥珠单抗首剂4mg/kgiv,第一周,序贯曲妥珠单抗2mg/kgiv,每周,或曲妥珠单抗首剂8mg/kgiv,第一周,序贯曲妥珠单抗6mg/kgiv,每3周,完成1年。
AC→TH方案
多柔比星60mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
21天为1个周期,共4个周期
序贯
多西他赛100mg/m2iv第1天
21天为1个周期,共4个周期
曲妥珠单抗首剂4mg/kgiv,第1周,以后每次曲妥珠单抗2mg/kg,iv每周,共11周序贯曲妥珠单抗6mg/kgiv,每3周,完成1年。
TC4H
多西他赛75mg/m2iv第1天
环磷酰胺600mg/m2iv第1天
21天为1个周期,共4个周期
联合
曲妥珠单抗首剂4mg/kgiv,第1周,以后每次曲妥珠单抗2mg/kg,iv每周,共11周序贯曲妥珠单抗6mg/kgiv,每3周,完成1年。
PH
紫杉醇80mg/m2iv1小时周疗,共12周
联合
曲妥珠单抗首剂4mg/kgiv,第1周,序贯以后每次曲妥珠单抗2mg/kg,iv每周,共完成1年。也可
在紫杉醇化疗后,改变曲妥珠单抗给药方式为6mg/kgiv,每3周,共完成1年。
附件14
晚期HER2阳性乳腺癌的靶向治疗常用治疗方案
1)HER2阳性晚期乳腺癌一线治疗方案
曲妥珠单抗+多西他赛
多西他赛75~100mg/m2,IV,第1天
曲妥珠单抗8mg/kg(首剂)~6mg/kg,IV第1天
21天为1个周期。
曲妥珠单抗+多西他赛+卡培他滨
多西他赛75mg/m2,IV,第1天
卡培他滨1000mg/m2PO,每天2次,第1~14天
曲妥珠单抗8mg/kg(首剂)~6mg/kg,IV,第1天
21天为1个周期。
曲妥珠单抗+紫杉醇:
紫杉醇80mg/m2,IV,每周1次
或175mg/m2,IV,第1天,每3周1次
曲妥珠单抗4mg/kg(首剂)~2mg/kg,IV,每周1次,或曲妥珠单抗8mg/kg(首剂)~6mg/kg,IV,
第1天,每3周1次。
曲妥珠单抗+紫杉醇+卡铂周疗
紫杉醇80mg/m2,IV,第1、8、15天
卡铂AUC=2IV,第1、8、15天
曲妥珠单抗4mg/kg(首剂)~2mg/kg,IV,每周1次
28天为1个周期。
曲妥珠单抗+长春瑞滨
长春瑞滨25mg/m2,IV,第1、8、15天
曲妥珠单抗4mg/kg(首剂)~2mg/kg,IV,每周1次
每28天为1个周期。
曲妥珠单抗+帕妥珠单抗+多西他赛
多西他赛75~100mg/m2,IV,第1天
曲妥珠单抗8mg/kg(首剂)至6mg/kg,IV,第1天
帕妥珠单抗840mgIV(首剂)至420mg,IV,第1天
21天为1个周期。
2)使用过曲妥珠单抗的其他治疗方案
拉帕替尼+卡培他滨
拉帕替尼1250mg,PO,每天1次,第1~21天
卡培他滨1000mg/m2,PO,每天2次,第1~14天
每21天为1个周期。
曲妥珠单抗+拉帕替尼
拉帕替尼1000mg,PO,每天1次
曲妥珠单抗4mg/kg(首剂)至2mg/kg,IV,每周1次,或曲妥珠单抗8mg/kg(首剂)至6mg/kg,IV,第1天,每3周1次。
