发布时间:2021年01月13日 08:28:15 来源:振东健康网
唐迪1,左其明1,张佼1,李锋1,彭善君1,王田辉2
(1重庆市梁平区人民医院泌尿外科,重庆405200;2重庆市奉节县人民医院泌尿外科.)
【摘要】目的:探讨长链非编码RNA(long-chainnon-codingRNA,lncRNA)RP11-374M1.2在前列腺癌组织中的表达,以及其对前列腺癌DU-145细胞侵袭和增殖的影响及作用机制。方法:应用实时定量PCR(qPCR)检测RP11-374M1.2在37例前列腺癌患者肿瘤组织和癌旁组织中的差异表达。以携带RP11-374M1.2的慢病毒或阴性对照慢病毒感染DU-145细胞,定义为实验组和对照组。qPCR检测各组的感染效率。Transwell侵袭实验和四甲基偶氮唑蓝(MTT)法分别检测各组DU-145细胞的侵袭和增殖能力。qPCR和Westernblot检测各组DU-145细胞中肝激酶B1(liverkinaseB1,LKB1)在mRNA和蛋白水平的表达。结果:RP11-374M1.2在前列腺癌患者肿瘤组织和癌旁组织中的表达分别为0.84±0.23和5.71±1.43(P<0.01)。与对照组相比,实验组DU-145细胞中RP11-374M1.2的表达明显增加(P<0.01)。对照组和实验组中DU-145穿膜细胞数分别为(93.15±10.05)个和(24.50±7.82)个。与对照组相比,实验组DU-145细胞的侵袭能力明显降低(P<0.01)。与对照组相比,实验组DU-145细胞的增殖能力从第3天开始明显降低(P<0.05)。与对照组相比,实验组DU-145细胞中LKB1基因mRNA和蛋白水平的表达量均明显升高(P<0.01)。结论:RP11-374M1.2在前列腺癌组织中呈低表达,上调其表达可抑制前列腺癌DU-145细胞的侵袭和增殖能力,其作用机制可能是促进LKB1基因的表达。
【关键词】长链非编码RNA;前列腺癌;肝激酶B1;细胞侵袭;细胞增殖
[中图分类号]R737.25 [文献标志码]A [文章编号]1007-6611(2020)10-1042-05
The lncRNA RP11-374M1.2 inhibits invasion and proliferation of prostate cancer cells by upregulating LKB1 gene expression
TANG Di1,ZUO Qiming1,ZHANG Jiao1,LI Feng1,PENG Shanjun1,WANG Tianhui2
(1 Department of Urology,Liangping District People's Hospital of Chongqing,Chongqing 405200,China;2 Department of Urology,Fengjie County People's Hospital)
【Abstract】Objective:To investigate the expression of long-chain non-coding RNA(lncRNA)RP11-374M1.2 in prostate cancer tissues and its effect on the invasion and the proliferation of prostate cancer DU-145 cells.Methods:Real-time quantitative PCR(qPCR)was used to detect the differential expression of RP11-374m1.2 in tumor tissues and adjacent tissues of 37 patients with prostate cancer.DU-145 cells were infected with a lentivirus carrying RP11-374M1.2 or a negative control lentivirus,defined as experimental group and control group.The qPCR was used to detect the infection efficiency.Transwell invasion assay and MTT assay were used to detect the invasion and the proliferation of DU-145 cells.The expression levels of liver kinase B1(LKB1)mRNA and protein were detected by qPCR and Western blot.Results:The expression of RP11-374m1.2 in tumor tissues and adjacent tissues of prostate cancer patients was 0.84±0.23 and 5.71±1.43,respectively(P<0.01).Compared with control group,the expression of RP11-374M1.2 in DU-145 cells was significantly increased in experimental group(P<0.01).The number of DU-145 transmembrane cells was 93.15±10.05 and 24.50±7.82 in control group and experimental group,respectively.Compared with control group,the invasive ability of DU-145 cells in experimental group was significantly decreased(P<0.01).Compared with control group,the proliferative capacity of DU-145 cells in the experimental group was significantly decreased from the third day(P<0.05).Compared with control group,the expression of LKB1 gene in DU-145 cells in experimental group was significantly increased at the mRNA and protein levels(P<0.01).Conclusion:RP11-374M1.2 is lowly expressed in prostate cancer tissues,and its up-regulation can inhibit the invasion and the proliferation of prostate cancer DU-145 cells by promoting the expression of LKB1 gene.
【Key words】long-chain non-coding RNA;prostate cancer;liver kinase B1;invasion;proliferation
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一,严重威胁男性居民健康[1]。前列腺癌的发病率逐年增加,呈年轻化趋势,前列腺癌细胞的恶性生物学行为造成部分前列腺癌患者的生存率很低[2]。深入研究前列腺癌细胞侵袭和增殖的作用机制,对了解前列腺癌发生、发展及确定新的分子治疗靶点具有重要临床意义。长链非编码RNA(long-chain non-coding RNA,lncRNA)长度大于200个核苷酸,主要定位于细胞质和细胞核,属于非编码RNA,在细胞发育、新陈代谢等各项生命活动中发挥重要调控作用[3]。越来越多的研究表明,lncRNA可在表观遗传学水平影响肿瘤细胞的基因表达,参与调控肿瘤细胞的恶性生物学行为[4]。近年来的研究发现,lncRNA在前列腺癌发生、发展中发挥抑癌基因或癌基因的作用[5]。研究前列腺癌相关lncRNA,有望明确前列腺癌细胞恶性生物学行为的病理、生理机制。RP11-374M1.2是一个尚未被报道研究的lncRNA,长度为1407nt。本研究检测了37例前列腺癌手术患者的肿瘤组织和对应癌旁组织中RP11-374M1.2的表达,通过在前列腺癌DU-145细胞中过表达RP11-374M1.2,观察RP11-374M1.2对前列腺癌细胞恶性生物学行为的影响,并探讨其作用机制。
1、材料与方法
1.1组织样本来源
收集重庆市梁平区人民医院泌尿外科自2017年5月至2019年3月手术切除的组织标本37例,液氮中保存。所有前列腺癌组织和癌旁组织均经术后病理证实,前列腺癌组织学类型均为腺癌。所有患者术前均未接受放射治疗、化学治疗和抗雄激素药物治疗。本研究经重庆市梁平区人民医院伦理委员会批准,患者均签署知情同意书。
1.2细胞株和主要试剂
DMEM培养基购于美国Hyclone公司;前列腺癌细胞株DU-145购于上海信然生物技术有限公司;四甲基偶氮唑蓝(MTT)试剂盒购于美国sigma公司;阴性对照慢病毒、携带RP11-374M1.2的慢病毒购于南京诺唯赞生物科技有限公司;胎牛血清购于美国Gibco公司;逆转录试剂盒和实时定量聚合酶链反应(qPCR)试剂盒购于日本TaKaRa公司;Transwell小室购于美国Corning公司;一抗ZEB-1、LKB1、GAPDH、CDK4、nail及Cyclin D2购于美国Abcam公司;基质胶购于美国Life Technologies公司;超敏ECL发光试剂盒购于美国Thermo公司。
1.3细胞培养和感染
前列腺癌细胞株DU-145采用含10%胎牛血清的DMEM培养基培养,于37℃、体积分数为5%CO2培养箱中培养。将活力良好的对数生长期DU-145细胞种板,细胞汇合度为60%时感染慢病毒。设置感染复数为30,实验步骤严格按照说明书操作,分别感染携带RP11-374M1.2的慢病毒和阴性对照慢病毒,定义为实验组和对照组。慢病毒感染12h后,更换新鲜培养基。
1.4qPCR检测RP11-374M1.2和LKB1 mRNA的表达量
取150mg组织或相应各组细胞,根据说明书采用Trizol试剂提取总RNA,紫外分光仪检测RNA浓度和纯度后,逆转录RNA为cDNA。qPCR法检测RP11-374M1.2和LKB1mRNA的相对表达。以GAPDH作内参,计算RP11-374M1.2和LKB1的表达量,所得数据采用2-ΔΔCt方法计算。引物序列见表1。qPCR反应条件:95℃预变性60s,95℃变性15s,62℃退火20s,72℃延伸20s,共35个循环。

1.5Transwell侵袭实验检测感染DU-145细胞的侵袭能力
将基质胶均匀铺在Transwell上室,凝固1h。收集感染后48h的DU-145细胞,应用无血清DMEM培养基调整细胞密度为4×105个/ml。加入200μl细胞悬液至上室,加入700μl含10%胎牛血清的DMEM培养基至下室。24h后,采用多聚甲醛固定20min,采用结晶紫染液染色20min,采用流水冲洗残余染液,采用棉签轻轻擦去未穿膜细胞。室温晾干,高倍显微镜下统计每组穿过底膜的细胞数,表示DU-145细胞的侵袭能力。
1.6四甲基偶氮唑蓝(MTT)法检测感染DU-145细胞的增殖能力
收集感染后48h的DU-145细胞,应用DMEM培养基调整细胞密度,以每孔3000个接种于96孔板,每组4个复孔。分别于接种细胞后的第1-5天行MTT检测,每孔加入18μl MTT试剂,继续培养4h后,每孔加入180μl二甲基亚砜,振荡溶解结晶。采用酶标仪检测每孔在波长495nm处的吸光度(A)值。
1.7Westernblot检测靶基因的表达
收集感染后48h的DU-145细胞,采用蛋白提取缓冲液提取细胞总蛋白。每组的蛋白上样量均为60μg。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,采用PVDF膜转膜,采用5%脱脂牛奶在室温下封闭PVDS膜。分别孵育LKB1(稀释比为1:1000)、CDK4(稀释比为1:3000)、Cyclin D2(稀释比为1:2000)、Snail(稀释比为1:1000)、ZEB-1(稀释比为1:1000)和GAPDH一抗(稀释比均为1:2000),在4℃摇床孵育过夜。洗膜后,在室温下孵育二抗鼠抗(稀释比为1:10000)。配制超敏ECL发光试剂,在凝胶成像仪中显影、拍照。
1.8统计学分析
所有计量数据均以均数±标准差(x±s)表示,应用SPSS 18.0统计学软件分析,两组间计量数据比较采用t检验,多组间计量数据比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2、结果
2.1、前列腺癌组织中RP11-374M1.2的表达
qPCR结果显示,37例前列腺癌组织和癌旁组织中RP11-374M1.2的相对表达量分别为0.84±0.23和5.71±1.43,癌旁组织RP11-374M1.2的相对表达量是前列腺癌组织的4.08倍,差异有统计学意义(t=23.93,P<0.01)。2.2DU-145细胞感染RP11-374M1.2病毒的效率
qPCR结果显示,对照组和实验组细胞中RP11-374M1.2的相对表达量分别为1.02±0.81和12.39±1.89,实验组RP11-374M1.2的相对表达量是对照组的12.12倍,差异有统计学意义(t=5.97,P<0.01)。
2.3RP11-374M1.2对DU-145细胞侵袭能力的影响
对照组和实验组细胞中穿膜DU-145细胞数分别为(93.15±10.05)个和(24.50±7.82)个。与对照组比较,实验组穿膜DU-145细胞数明显较少,差异有统计学意义(t=5.19,P<0.01,见图1),RP11-374M1.2具有抑制前列腺癌DU-145细胞侵袭的能力。

2.4RP11-374M1.2对DU-145细胞增殖能力的影响
MTT法结果显示,实验组DU-145细胞在感染后第3,4,5天的a值低于对照组,差异均有统计学意义(均P<0.05),表明RP11-374M1.2具有抑制前列腺癌DU-145细胞增殖的能力。在第1,2天的a值差异无统计学意义(t=0.18,P>0.05;t=2.19,P>0.05,见图2)。

2.5DU-145细胞感染RP11-374M1.2慢病毒对LKB1mRNA表达的影响
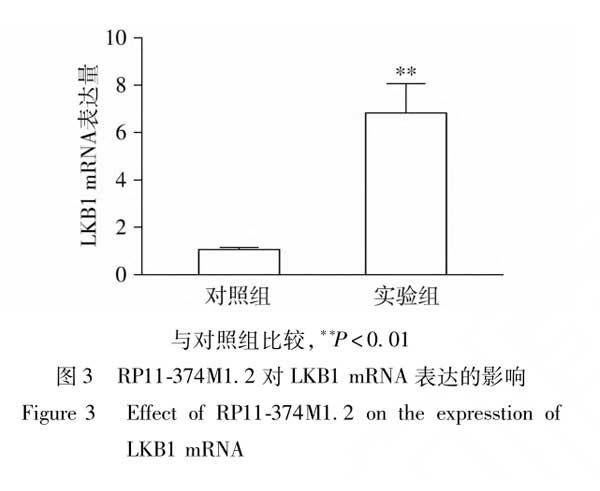
qPCR结果显示,感染RP11-374M1.2慢病毒后的实验组DU-145细胞中LKB1mRNA的相对表达量明显高于对照组,差异有统计学意义(7.37±2.14 vs 1.06±0.05,t=12.52,P<0.01,见图3),表明RP11-374M1.2可有效促进LKB1mRNA的相对表达。
2.6LKB1蛋白的表达水平
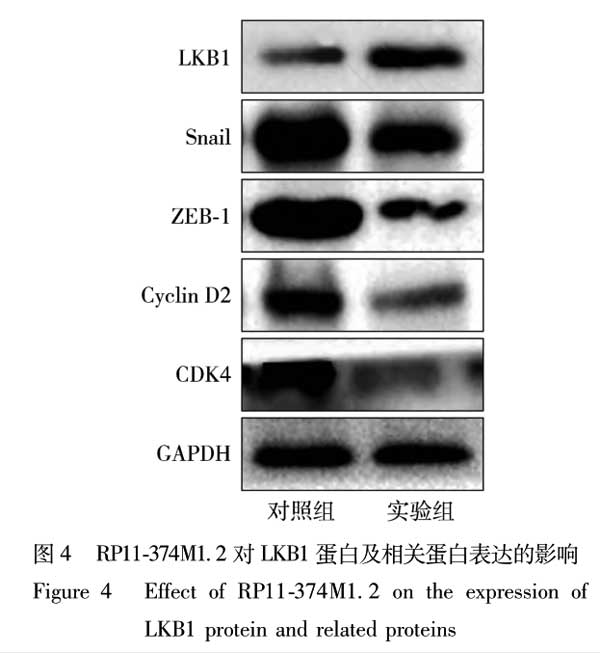
Westernblot结果表明,感染RP11-374M1.2慢病毒后的实验组DU-145细胞中,LKB1蛋白表达量明显升高,细胞侵袭相关蛋白Snail蛋白和ZEB-1蛋白表达明显减少,细胞增殖相关蛋白Cyclin D2蛋白和CDK4蛋白表达减少(见图4)。
3、讨论
长链非编码RNA(long-chain non-codingRNA,lncRNA)是继微小RNA后,非编码RNA领域的又一热点[6]。由于lncRNA不具备翻译蛋白的功能,起初被人们认为是“转录噪音”,不影响细胞的生命活动[7]。越来越多的研究发现,lncRNA可在表观遗传水平、转录水平、转录后水平等多水平影响基因的表达,具有明显的生物学功能[8]。随着研究深入,大量lncRNA被证实在包括前列腺癌在内的恶性肿瘤中异常表达,在肿瘤细胞的恶性转化、进展等过程起重要作用[9]。Wang等[10]研究发现lncRNA MYU在前列腺癌组织中明显上调,可促进前列腺癌细胞的增殖和迁移,lncRNA MYU主要通过miR-184/c-Myc分子轴发挥作用,在前列腺癌中起着类似癌因的作用。Zhao等[11]发现lncRNA ANRIL在前列腺癌组织和细胞株中高表达,其主要通过调节let-7a/TGFβ-1/Smad信号通路,促进前列腺癌细胞的增殖和迁移。Huang等[12]发现lncRNA TMPO-ASI与前列腺癌的进展和患者的不良预后密切相关,通过影响细胞周期促进细胞的增殖,并对前列腺癌细胞的迁移具有正向调控作用。lncRNA对于发现新的前列腺癌分子治疗靶点具有重要意义。RP11-374M1.2是一种尚未被报道研究的lncRNA,其在前列腺癌组织中的表达和作用机制尚不清楚。
本研究以RP11-374M1.2作为研究对象,通过qPCR法验证其在37例配对组织中的表达差异,结果显示,与癌旁组织相比,RP11-374M1.2在前列腺癌组织中的表达明显降低,RP11-374M1.2可能具有抑制前列腺癌发生、发展的作用。通过进一步研究RP11-374M1.2对前列腺癌侵袭和增殖的影响,将载有RP11-374M1.2的慢病毒感染前列腺癌DU-145细胞,通过Transwell侵袭实验和MTT法检测上调RP11-374M1.2后DU-145细胞的侵袭和增殖能力。结果显示,上调RP11-374M1.2可明显抑制前列腺癌DU-145细胞的侵袭能力和增殖能力,表明RP11-374M1.2可抑制前列腺癌细胞转移和生长。
肝激酶b1(LKB1)基因位于第19号染色体短臂13.3区,由10个外显子组成,可翻译为433个氨基酸组成的细胞内激酶[13]。LKB1几乎表达于人体所有组织,负责调控细胞增殖、新陈代谢等各种生理活动[14]。近年的研究发现,LKB1在多种恶性肿瘤如肺癌、乳腺癌、结直肠癌表达缺失或突变,导致细胞不可控性侵袭和增殖,参与调控肿瘤的发生、发展和转归[15]。研究发现,LKB1在前列腺癌组织和细胞株中的表达明显降低,在DU-145细胞株中的表达最低,与多西他赛的化疗敏感性显著相关[16,17]。上调LKB1可明显抑制前列腺癌细胞的增殖、迁移和侵袭,LKB1在前列腺癌中发挥抑癌基因作用[18]。qPCR和Westernblot显示,上调RP11-374M1.2在mRNA和蛋白水平上均可明显促进LKB1基因的表达。LKB1蛋白表达升高后,细胞侵袭相关蛋白Snail和ZEB-1蛋白表达明显降低,细胞增殖相关蛋白Cyclin D2和CDK4蛋白表达明显降低,表明细胞侵袭能力和增殖能力受到明显抑制。RP11-374M1.2是通过降低LKB1基因的表达,参与抑制前列腺癌细胞的侵袭和增殖能力。
综上所述,前列腺癌组织中RP11-374M1.2呈低表达,上调RP11-374M1.2明显抑制前列腺癌细胞的侵袭和增殖能力,其作用机制可能通过上调LKB1基因的表达。RP11-374M1.2在前列腺癌发生、发展中起着类似抑癌基因的作用,有望在未来成为前列腺癌分子治疗新的靶点。
参考文献
[1]Lingadahalli S,Jadhao S,Sung YY,et al.Novel lncRNA LINC00844 regulates prostate cancer cell migration and invasion through AR signaling[J].Mol Cancer Res,2018,16(12):1865-1878.
[2]Misawa A,Takayama KI,Inoue S.Long non-coding RNAs and prostate cancer[J].Cancer Sci,2017,108(11):2107-2114.
[3]Wu M,Huang Y,Chen T,et al.lncRNA MEG3 inhibits the
progression of prostate cancer by modulating miR-9-5p/QKI-5 axis[J].J Cell Mol Med,2019,23(1):29-38.
[4]Zhang Y,Pitchiaya S,Cieslik M,et al.Analysis of the androgen receptor-regulated lncRNA landscape identifies a role for ARLNC1 in prostate cancer progression[J].Nat Genet,2018,50(6):814-824.
[5]Li X,Wang X,Song W,et al.Oncogenic properties of NEAT1 in prostate cancer cells depend on the CDC5L-AGRN transcriptional regulation circuit[J].Cancer Res,2018,78(15):4138-4149.
[6]Dai X,Liu L,Liang Z,et al.Silencing of lncRNA MALAT1 inhibits cell cycle progression via androgen receptor signaling in prostate cancer cells[J].Pathol Res Pract,2019,215(4):712-721.
[7]Long B,Li N,Xu XX,et al.Long noncoding RNA LOXL1-AS1 regulates prostate cancer cell proliferation and cell cycle progression through miR-541-3p and CCND1[J].Biochem Biophys Res Commun,2018,505(2):561-568.
[8]Sun M,Geng D,Li S,et al.LncRNA PART1 modulates tolllike receptor pathways to influence cell proliferation and apoptosis in prostate cancer cells[J].Biol Chem,2018,399(4):387-395.
[9]Hua JT,Ahmed M,Guo H,et al.Risk SNP-mediated promoterenhancer switching drives prostate cancer through lncRNA PCAT19[J].Cell,2018,174(3):564-575e518.
[10]Wang J,Yang X,Li R,et al.Long non-coding RNA MYU promotes prostate cancer proliferation by mediating the miR-184/cMyc axis[J].Oncol Rep,2018,40(5):2814-2825.
[11]Zhao B,Lu YL,Yang Y,et al.Overexpression of lncRNA ANRIL promoted the proliferation and migration of prostate cancer cells via regulating let-7a/TGF-beta1/Smad signaling pathway[J].Cancer Biomark,2018,21(3):613-620.
[12]Huang E,Su X,Yan W,et al.Overexpression of AR-regulated lncRNA TOMP-AS1 correlates with tumor progression and poor prognosis in prostate cancer[J].Prostate,2018,78(16):1248-1261.
[13]Chen Y,Liu Y,Zhou Y,et al.Molecular mechanism of LKB1 in the invasion and metastasis of colorectal cancer[J].Oncol Rep,2019,41(2):1035-1044.
[14]Jin L,Chun J,Pan C,et al.The PLAG1-GDH1 axis promotes anoikis resistance and tumor metastasis through CamKK2-AMPK signaling in LKB1-deficient lung cancer[J].Mol Cell,2018,69(1):87-99e87.
[15]Lattouf H,Kassem L,Jacquemetton J,et al.LKB1 regulates PEMT5 activity in breast cancer[J].Int J Cancer,2019,144(3):595-606.
[16]Yan Y,Du C,Li G,et al.CO suppresses prostate cancer cell growth by directly targeting LKB1/AMPK/mTOR pathway in vitro and in vivo[J].Urol Oncol,2018,36(6):312.e311-312.e318.
[17]Zhang M,Li H,Zhang Y,et al.Oncogenic miR-744 promotes prostate cancer growth through direct targeting of LKB1[J].Oncol Lett,2019,17(2):2257-2265.
[18]Zeng J,Liu W,Fan Y Z,et al.PrLZ increases prostate cancer docetaxel resistance by inhibiting LKB1/AMPK-mediated autophagy[J].Theranostics,2018,8(1):109-123.
(山西医科大学学报,2020年10月,第51卷第10期)
