发布时间:2020年03月20日 13:24:27 来源:振东健康网
吕海栋a,周堤侠a,祁玉娟b
(青海省人民医院a.肿瘤外科;b.肿瘤内科,青海西宁810007)
【摘 要】目的:探讨长链非编码RNA 00707 (lncRNA 00707)和微小RNA-613(miR-613)对胃癌细胞增殖和转移的调控作用及其相关机制。方法:收集2014年1月至2018年6月青海省人民医院肿瘤外科89例原发性胃癌组织及癌旁组织标本以及胃癌MGC-803、SGC-790、BGC-823细胞,采用qPCR实验检测胃癌组织和细胞系中lncRNA 00707、miR-613的表达水平。分别建立lncRNA 00707低表达和过表达细胞模型,采用CCK-8实验检测MGC-803、SGC-7901细胞增殖能力,Transwell法检测MGC-803、SGC-7901细胞迁移和侵袭能力。用双荧光素酶基因报告实验验证lncRNA 00707与miR-613的靶向关系。结果:与癌旁组织相比,胃癌组织中lncRNA 00707呈明显高表达(P<0.01),lncRNA 00707表达水平与WHO分期呈正相关(P<0.05);与正常细胞系GES-1相比,胃癌细胞系中lncRNA 00707表达明显上调(P<0.05)。敲低lncRNA 00707可明显抑制SGC-7901细胞的增殖、侵袭和迁移能力(均P<0.05);lncRNA 00707过表达可明显提高MGC-803细胞的增殖和迁移能力(P<0.05)。与阴性对照组相比,lncRNA 00707过表达显著降低了miR-613荧光素酶报告载体的荧光素酶活性,而下调MGC-803和SCG-7901细胞中lncRNA 00707,miR-613的表达显著增加(均P<0.01)。结论:lncRNA 00707在胃癌组织和细胞系中发挥促癌效应,其可以通过抑制miR-613而促进胃癌MGC-803和SCG-7901细胞的增殖和转移。
【关键词】长链非编码RNA 00707;微小RNA-613;胃癌;MGC-803细胞;SCG-7901细胞;增殖;迁移
[中图分类号]R739.1;R735.1 [文献标识码]A [文章编号]1007-385X(2019)09-0999-07
lncRNA 00707 regulates malignant biological behavior of gastric cancer MGC-803
and SGC-7901 cells via miR-613
LYU Haidong a,ZHOU Dixia a,QI Yujuan b
(a.Department of Surgical Oncology;b.Interinal Medicine-Oncology,Qinghai
Provincial People's Hospital,Xining 810007,Qinghai,China)
【Abstract】Objective:To investigate the role of long chain non-coding RNA 00707(lncRNA 00707)and micro RNA-613(miR-613)in regulating the proliferation and metastasis of gastric cancer cells and its underlying mechanisms.Methods:Eighty-nine pairs of primary gastric cancer tissues and corresponding prar-cancerous tissues were collected from the Department of Surgical Oncology,Qinghai Provincial People's Hospital during January 2014 and June 2018 for this study.The expressions of lncRNA00707 and miR-613 in gastric cancer tissues and cells were detected by qPCR.The lncRNA00707 low expression and over-expression models of MGC-803 and SGC-7901 cells were established;The proliferation of gastric cancer cells was monitored by CCK-8 assay,and Transwell assay was performed to determine the migration and invasion of gastric cancer cells.Dual luciferase gene reporter assay was adopted to validate the relationship between lncRNA 00707 and miR-613.Results:Compared with para-cancerous tissues and normal cell line GES-1,the expression of lncRNA 00707 was significantly up-regulated in cancer tissues and cell lines,and the expression of lncRNA00707 was positively correlated with WHO stage(all P<0.05).Down-regulation of lncRNA 00707 significantly inhibited the proliferation and migration of SGC-7901 cells,while overexpression of lncRNA00707 exerted the opposite effect(all P<0.05).Compared with negative control group,lncRNA00707 over-expression significantly reduced the luciferase activity of miR-613;in the contrary,the luciferase activity of miR-163 was significantly increased in MGC-803 and SGC-7901 cells with lncRNA 00707 knockdown(all P<0.01).Conclusion:lncRNA 00707 facilitates the proliferation,migration and invasion of gastric cancer cells by inhibiting the function of miR-613,which exerts a protumorigenic effect in gastric cancer.
【Key words】long chain non-coding RNA(lncRNA 00707);miR-613;gastric carcinoma;MGC-830 cell;SCG-7091 cell;proliferation;metastasis
胃癌作为最常见的恶性肿瘤之一,是全球第三大癌症死亡原因[1]。随着现代医学水平的提高,胃癌患者的生存率显著提高[2]。然而,早期胃癌缺乏典型症状,相当一部分胃癌患者被明确诊断时已发生转移,目前对其缺乏根治性方法[3]。即使经过化疗,也仍有较高的病死率[4-5]。近年来研究[6-7]发现,非编码RNA与胃癌的发生、发展、侵袭、转移密切相关,在胃癌的诊断与治疗方面具有潜在的重大意义。长链非编码 RNA(long-chain non-coding RNA,lncRNA)和微小RNA(microRNA,miRNA)同属于非编码RNA,其异常表达及相互作用在肿瘤的发生和发展过程中发挥重要作用,可能是肿瘤新的治疗靶点[8]。有研究[9-10]发现,lncRNA 00707通过作用于miR-206增加CDK14促进肝细胞癌进展,同时,lncRNA 00707可以激活ERK/JNK/AKT通路促进肝细胞癌进展。此外,有研究[11]表明,miR-613通过靶向ATOH1促进结肠癌细胞增殖、侵袭和迁移。然而,目前关于lncRNA00707和miR-613的表达与胃癌关系的研究较少。本研究拟检测lncRNA 00707在胃癌组织和细胞中的表达水平,同时探究其对胃癌细胞增殖、迁移和侵袭的作用及下游机制,以期为临床上治疗胃癌提供新的实验依据。
1 资料与方法
1.1 组织标本、细胞系及主要试剂
收集2014年1月至2018年6月青海省人民医院肿瘤外科89例原发性胃癌组织及癌旁组织标本。其中男38例、女61例,年龄(60.25±6.21)岁。肿瘤分化程度依据Edmondson-Steiner分级标准确定。肿瘤分期参照美国肿瘤研究联合委员会(AJCC)第7版分期系统的标准。所有患者在采集标本前均未接受术前抗肿瘤治疗。组织样本的收集和使用征得患者同意并签署知情同意书,并获得青海省人民医院伦理委员会的批准。手术切除后,在-80°C下立即用液氮保存组织样本。
人胃癌细胞系 MGC-803、SGC-7901、BGC-823及人胃黏膜上皮细胞株GES-1购自中国科学院上海细胞库。
TRIzol购自美国Invitogen公司,DMEM和胎牛血清购自美国Biological Industries公司,CCK-8试剂盒购自武汉华美生物工程有限公司,Transwell小室购自美国Corning公司,Annexin V-FITC双染细胞凋亡检测试剂盒购自上海贝博生物有限公司,双荧光素酶检测试剂盒购自Promega公司,RNA提取试剂盒和定量PCR试剂盒SYBR premix Ex TaqTM购自日本TaKaRa公司。
1.2 细胞培养
所有细胞在10%胎牛血清、1%青霉素和链霉素、RPMI-1640培养基下培养,置于5% CO2、37 ℃培养箱中,每隔3 d换液1次,待细胞铺满培养瓶底进行传代。以下所有试验均取处于对数生长期的细胞。
1.3 细胞转染
使用PBS缓冲液将SGC-7901细胞清洗干净,重复3次,胰酶消化细胞2 min,转移至无菌15 ml离心管,离心并计数细胞,以每孔4×105个细胞接种于6孔板中,使汇合度达70%左右,使用无血清培养基按3μl/L进行稀释转染试剂,37 ℃孵育20 min,用无血清培养基分别将si-lncRNA 00707和对照组按50μmol/L浓度稀释,常温下孵育5 min,最后与转染试剂等体积分别混匀,37 ℃培养箱继续培养。12 h后,观察转染细胞状态,并将无血清培养基更换为完全培养基,继续培养,继续培养48 h后,提取细胞RNA,验证转染效率。同样方法把过表达lncRNA 00707和对照组转染到胃癌细胞系MGC-803中。lncRNA 00707敲除质粒和过表达质粒由GenePharma公司设计整合。空白质粒作为对照。根据协议用脂质体3000转染细胞MGC-803、SGC-7901。实验分为NC组、si-lncRNA 00707 组、lncRNA 00707组、lncRNA 00707+miR-613 mimics组。用Geneticin选出稳定转染的细胞。
1.4 qPCR实验检测胃癌组织及细胞中lncRNA 00707和miR-613的表达
所有RNA均根据使用说明用TRIzol试剂提取。用TaqMan miR-613 MicroRNA kits扩增miR-613。然后用SuperScript First Strand cDNA System逆转录为cDNA。用SYBRPremixExTaqkit在ABI Step One real-time PCR system上进行qRT-PCR分析。qPCR反应条件:95 ℃预变性10 min,95℃ 15s,60 ℃ 15s,45个循环,获取荧光信号温度为60 ℃。以GAPDH为检测lncRNA 00707表达水平内参,以 U6 为检测miR-613的内参。引物序列:lncRNA 00707 F为5'-TCACATCTGTGAAAAGAGTGCT-3,R为5'-CTGGACTGTGAGTACCAGGC-3';miR-613 F为5'-GTGAGTGCGTTTCCAAGTGT‐3',R为5'‐TGAGTGGCAAAGAAGGAACAT- 3';GAPDHF为5'-GAGTCAACGGATTTGGTCGT-3',R为5'-TTGATTTTGGAGGGATCTCG-3';U6 F为5'-TTGGTCTGATCTGGCACATATAC-3',R为5'-AAAAATATGGAGCGCTTCACG-3'。采用2-ΔΔCt 法进行计算lncRNA 00707和miR-613的表达水平。实验重复3次。
1.5 CCK-8实验检测胃癌MGC-803、SCG-7901细胞增殖能力
联合组转染细胞根据试剂盒说明书,然加入10μl增强CCK-8试剂,在37 ℃下孵育1 h。在450 nm处测定光密度(D)值。实验重复3次。
1.6 Transwell实验检测胃癌MGC-803、SCG-7901细胞迁移和侵袭
联合组转染细胞接种到Transwell的小室内(2.5×104细胞/孔),小室内细胞重悬在无血清的培养基中,而小室底部是含有20%血清的培养基。对于迁移实验,小室的内部不加Matrigel,而侵袭实验是预先在小室的内部铺上一层Matrigel模拟细胞外基质(Matrigel的终浓度为2 mg/ml,用不含血清的培养液稀释后,每个小室滴加40 μl,在37℃放置30 min到1 h至胶凝)。待细胞迁移和侵袭24 h后,将小室取出,甲醛和乙酸混合液固定15 min后,PBS清洗,然后用结晶紫进行染色,染色后用1×PBS冲洗,最后用棉签将小室内的细胞擦掉,在显微镜下对发生侵袭和迁移的细胞进行计数。
1.7 双荧光素酶基因报告实验验证miR-20a与TGF-BR2的靶向结合
用双荧光素酶报告分析系统实施荧光素酶报告基因检测实验。野生型lncRNA00707及突变型lncRNA 00707的目的片段被构建并整合入pGL3 vector以构建pGL3-lncRNA 00707-wild type (lncRNA 00707-Wt)和pGL3-lncRNA 00707-mutant (lncRNA 00707-Mut)reporter vector。将lncRNA00707-Wt或lncRNA00707-Mut与miR-613 mimics或阴性对照物共转染GES-1细胞。转染48 h后,移去细胞培养板中的培养液,用洗涤液进行洗涤,弃去洗涤液后在孔中加入1×细胞裂解液裂解细胞。室温下振荡器上振荡5~10 min,移入离心管中3000×g离心5min,弃上清。按照双荧光素酶报告基因试剂盒说明书,用酶标仪检测萤火虫和海肾荧光值,并以海肾荧光值作为内参。实验重复3次。
1.8 统计学处理
采用SPSS22.0统计学软件,计量数据以 x ˉ ± s 表示,2组间比较采用独立样本t检验和近似t检验;多组间的均数比较采用单因素方差分析,组内的两两比较采用SNK-q检验;以P<0.05或P<0.01表示差异有统计学意义。
2 结果
2.1 lncRNA00707在胃癌组织和细胞系中呈明显高表达
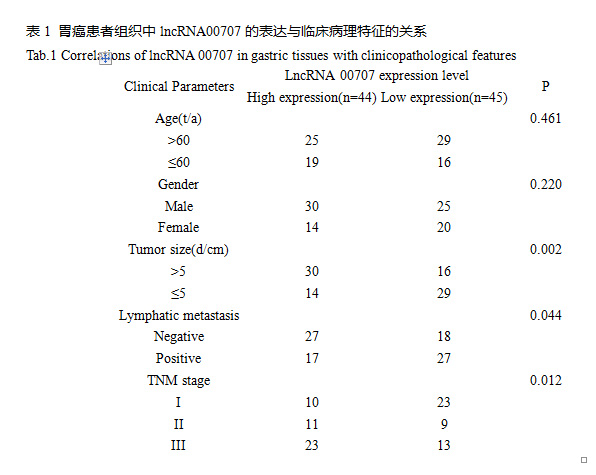
qPCR实验检测结果显示,与癌旁组织相比,胃癌组织中lncRNA 00707呈明显高表达(P<0.01,图1A);当89例胃癌标本按WHO分期分层时,lncRNA00707表达水平与WHO分期呈正相关(P<0.05或P<0.01,图1B);与正常细胞系GES-1相比,胃癌细胞系中lncRNA 00707表达明显上调(P<0.05或P<0.01,图1C)。为了进一步检测lncRNA 00707的表达水平与胃癌患者临床病理标之间的相关性,按照中位数方法将患者分为lncRNA 00707高表达组和lncRNA00707低表达组。结果显示,高表达lncRNA00707与肿瘤体积大、出现淋巴结转移、肿瘤分期高显著相关(P<0.05或P<0.01,表1)。
2.2 敲减lncRNA 00707抑制胃癌SGC-7901细胞增殖、迁移及侵袭
CCK-8实验检测结果显示,敲减lncRNA 00707可明显抑制SGC-7901细胞的增殖能力(P<0.05,图2A)。Transwell实验检测结果显示,lncRNA 00707敲减明显降低SGC-7901细胞迁移(P<0.05,图2B)和侵袭能力(P<0.05,图2C)。上述结果表明,下调lncRNA 00707的表达对胃癌细胞增殖和转移有明显的抑制作用。
2.3过表达lncRNA00707促进胃癌MGC-803细胞增殖、迁移及侵袭
CCK-8实验检测,lncRNA00707过表达可明显提高MGC-803细胞的增殖能力(P<0.05,图3A)。Transwell实验检测结果显示,lncRNA00707的过表达明显提高MGC-803细胞迁移能力(P<0.05,图3B)与细胞侵袭(P<0.05,图3C)。以上结果表明,lncRNA00707过表达对胃癌细胞增殖、迁移及侵袭有明显的促进作用。
2.4lncRNA00707直接靶向作用于miR-613
通过Starbase数据库中检索lncRNA00707潜在的目标基因,结果(图4A)显示,lncRNA00707包含miR-613的保守目标位点。qPCR实验检测胃癌组织中lncRNA00707和miR-613的表达相关性,结果(图4B)显示,lncRNA00707和miR-613之间呈明显负向调控关系(P<0.05)。为进一步验证lncRNA00707与miR-613的直接结合,双荧光素酶基因报告实验验证结果(图4C)显示,与阴性对照组相比,lncRNA00707过表达显著降低了miR-613荧光素酶报告载体的荧光素酶活性(P<0.05),而miR-613过表达对lncRNA00707-Mut的荧光素酶活性没有显著影响(P>0.05),表明miR-613是lncRNA00707的靶向miRNA。此外,下调胃癌细胞MGC-803和SCG-7901的lncRNA00707
2.5lncRNA00707通过靶向miR-613调控胃癌细胞增殖和迁移
CCK-8实验检测结果(图5A、B)显示,miR-613模拟物的转染降低了SCG-7901细胞增殖能力,而lncRNA00707的过表达抑制了miR-613的作用(P<0.05)。Transwell实验检测结果(图5C)显示,miR-613模拟物的转染降低了SCG-7901细胞迁移能力,但这种作用可被lncRNA00707的过表达抵消(P<0.05)。上述结果表明,lncRNA00707可以通过调节miR-613影响胃癌的进展。
3 讨论
lncRNA是一类定位于细胞核或细胞质中的单链RNA,其碱基序列长度大于200nt。lncRNA虽不参与蛋白质的表达,但在表观遗传学、转录及转录后等多种层面调控基因的表达[13]。例如,lncRNAMDC1-AS通过MDC1依赖机制抑制胃癌细胞的增殖和转移[14],lncRNAGNAT1-1通过Wnt/β-连环蛋白途径抑制胃癌细胞增殖和侵袭[15]。此外,有研究[16]发现,lncRNA00707在肝癌组织和细胞中发挥促癌效应,其可以通过抑制miR-206的功能而促进肝癌细胞的增殖、迁移和侵袭。然而目前没有研究充分证实lncRNA00707和胃癌的关系。本课题集中研究了ln-cRNA00707在胃癌细胞中的作用及其潜在机制,观察到lncRNA00707在胃癌组织中表达显著高于邻近正常组织,其上调与晚期恶性肿瘤指标的升高正相关。上调或下调的功能实验用于探索lncRNA00707对胃瘤细胞生物学行为的作用,数据显示lncRNA00707过表达对SCG-7901和MGC-803细胞的增殖、转移有明显的促进作用。此外,低表达lncRNA00707对SCG-7901和MGC-803细胞的增殖、转移有明显的抑制作用,提示lncRNA00707在胃癌的发展过程中发挥促癌效应。
作为内源性非编码RNA,mi-RNA是胃癌形成、转移中起作用的重要因素之一,其通过基因调控参与许多生物学过程(如细胞增殖、分化、凋亡、侵袭和发育)[17]。例如,有研究[18]发现,miRNA-96-5p通过靶向Fox1抑制胃癌细胞的增殖、侵袭和转移,而HU等[19]研究发现,miR-532通过靶向NKD1促进胃癌的迁移和侵袭。此外,miR-613是已被证实的具有抑癌效应的miRNA,在包括骨肉瘤、甲状腺乳头状癌等癌症中起抑癌的作用。有研究[20]发现,miR-613抑制趋化因子受体4(CXCR4)而抑制的骨肉瘤生长和肺转移。同时,miR-613通过调控鞘氨醇激酶2从而抑制甲状腺乳头状癌的增殖、迁移和侵袭[21],而在胃癌中,miR-613通过抑制脑源性神经营养因子(BDNF)抑制胃癌的扩散、迁移和入侵[22],表明miR-613在肿瘤中发挥抑癌效应。本研究也发现,相较于癌旁组织,miR-613在胃癌组织中表达下调,也提示miR-613在胃癌的发展过程中发挥抑癌效应。
有研究[23]发现,lncRNA通过与miRNA完全结合产生ceRNA或在转录后水平促进蛋白质稳定来调节胃癌的发生和发展。为进一步研究lncRNA00707调控胃癌生长的下游分子机制,本研究通过生物信息学分析发现,miR-613是lncRNA00707作用的靶点,且miR-613和lncRNA00707在胃癌组织中的表达存在负相关关系,且在胃癌细胞中,过表达lncRNA00707抑制了细胞内miR-613的表达。此外,miR-613模拟物的转染抵消了lncRNA00707对促进胃癌细胞增殖、迁移的效应。以上研究表明,miR-613在胃癌细胞中发挥抑癌效应,且lncRNA00707可以通过靶向抑制胃癌细胞中miR-613而发挥促癌效应。
综上所述,lncRNA00707可以促进胃癌的增殖、迁移和侵袭,可以作为胃癌诊断和治疗的潜在标志物;此外,miR-613在胃癌细胞中发挥抑癌效应,而lncRNA00707可以通过靶向抑制miR-613发挥促癌效应。总之,本研究探究了胃癌发展过程中的新的制,也为胃癌的诊断和治疗提供了新的实验依据。
参考文献
[1]DANIYAL M,AHMAD S,AHMAD M,et al.Risk factors and epidemiology of gastric cancer in Pakistan[J].Asian Pac J Cancer Prev,2015,16(12):4824824.DOI:10.7314/apjcp.2015.16.12.4821.
[2]GOTODA T.Endoscopic resection of early gastric cancer[J].Gastric Cancer,2007,10(1):1-11.DOI:10.1007/s10120-006-0408-1.
[3]Van C E,SAGAERT X,TOPAL B,et al.Gastric cancer[J].J Nat Cancer Instit,2016,57(1):2654-2664.
[4]FINKE J,ENGELHARDTR.Chemotherapy for advanced gastric cancer[J].Digest Surg,2010,11(2):118-120.DOI:10.1002/14651858.cd004064.pub2.
[5]YI J H,LEE J,LEE J,et al.Randomised phase II trial of docetaxel and sunitinib in patients with metastatic gastric cancer who were previously treated with fluoropyrimidine and platinum[J/OL].Br J Cancer,2012,106(9):1469-1474[2019-05-26].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3341944/.DOI:10.1038/bjc.2012.100.
[6]NICOLOSO M S,SPIZZO R S,MASAYOSHI R,et al.MicroRNAs-the micro steering wheel of tumour metastases[J].Nat Rev Cancer,2009,9(4):293-302.
[7]UEDA T,VOLINIA S,OKUMURA H,et al.Relation between microRNA expression and progression and prognosis of gastric cancer:a microRNA expression analysis[J].Lancet Oncol,2010,11(2):136-146.DOI:10.1016/s1470-2045(09)70343-2.
[8]LEI K C,LIANG X,GAO Y W,et al.Lnc-ATB contributes to gastric cancer growth through a MiR-141-3p/TGFβ2 feedback loop[J].Biochem Biophys Res Commun,2017,484(3):514-521.DOI:10.1016/j.bbrc.2017.01.094.
[9]TU J F,ZHAO Z W,XU M,et al.Lnc 00707 contributes to hepatocellular carcinoma progression via sponging miR-206 to increase CDK14[J].J Cell Physiol,2019,234(7):10615-10624.DOI:10.1002/jcp.27737.
[10]WANG J C,LUO Z J,YAO T W,et al.LINC00707 promotes hepatocellular carcinoma progression through activating ERK/JNK/AKT pathway signaling pathway[J].J Cell Physiol,2019,234(5):6908-6916.DOI:10.1002/jcp.27449.
[11]YANG X X,ZHANG L,SONG X,et al.MicroRNA-613 promotes colon cancer cell proliferation,invasion and migration by targeting ATOH1[J].Biochem Biophys Res Commun,2018,504(4):827-833.DOI:10.1016/j.bbrc.2018.09.054.
[12]FENG C,SHEN J M,LV P P,et al.Construction of implantation failure related lncRNA-mRNA network and identification of lncRNA biomarkers for predicting endometrial receptivity[J/OL].Int J Biol Sci,2018,14(10):1361-1377[2019-05-26].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6097487/.DOI:10.7150/ijbs.25081.
[13]CALEY D P,PINK R C,TRUJILLANO D,et al.Long noncoding RNAs,chromatin,and development[J].Sci World J,2010,10:90-102.DOI:10.1100/tsw.2010.7.
[14]QIN Y,ZHUANG S T,WEN J F,et al.Long non-coding RNA MDC1-AS inhibits human gastric cancer cell proliferation and metastasis through an MDC1-dependent mechanism[J/OL].Exp TherMed,2018,15(1):191-197[2019-005-26].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5763657/.DOI:10.3892/etm.2017.5370.
[15]LIU L P,SHUAI T K,LI B,et al.Long non-coding RNA lnc-GNAT1-1 inhibits gastric cancer cell proliferation and invasion through the Wnt/β-catenin pathway in helicobacter pylori infection[J].Mol Med Report,2018,18(4):4009-4015.DOI:10.3892/mmr.2018.9405.
[16]TU J F,ZHAO Z W,XU M,et al.LINC00707 contributes to hepatocellular carcinoma progression via sponging miR-206 to increaseCDK14[J].J Cell Physiol,2019,234(7):10615-10624.DOI:10.1002/jcp.27737.
[17]SHIN V Y,CHU K M.MiRNA as potential biomarkers and therapeutic targets for gastric cancer[J/OL].World J Gastroenterol,2014,20(30):10432-10439[2019-05-26].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4130850/.DOI:10.3748/wjg.v20.i30.10432.
[18]YANG X Y,LI N,DENG W Y,et al.MiRNA-96-5p inhibits the proliferation and migration of gastric cancer cells by targeting FoxQ1[J].Chin J Oncol,2019,41(3):193-199.DOI:10.3760 /cma.j.issn.0253-3766.2019.03.008.
[19]HU S B,ZHENG Q C,WU H S,et al.MiR-532 promoted gastric cancer migration and invasion by targeting NKD1[J].Life Sci,2017,177:15-19.DOI:10.1016/j.lfs.2017.03.019.
[20]ZHU Y,TANG L H,ZHAO S S,et al.CXCR4-mediated osteosarcoma growth and pulmonary metastasis is suppressed by MicroRNA-613[J/OL].Cancer Sci,2018,109(8):2412-2422[2019-05-26].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6113448/.DOI:10.1111/cas.13653.
[21]QIU W W,YANG Z L,FAN Y B,et al.MicroRNA-613 inhibits cell growth,migration and invasion of papillary thyroid carcinoma by regulating SphK2[J /OL].Oncotarget,2016,7(26):39907-39915[2019-05-26].https://www.ncbi.nlm.nih.Gov /pmc /articles/PMC5129980/.DOI:10.18632/oncotarget.9530.
[22]DING D Y,HOU R Z,GAO Y J,et al.MiR-613 inhibits gastric cancer progression through repressing brain derived neurotrophic factor[J/OL].Exp Ther Med,2018,15(2):1735-1741[2019-05-26].https://www.ncbi.nlm.nih.gov /pmc /articles /PMC5774479/.DOI:10.3892/etm.2017.5546.
[23]HAO N B,HE Y F,LI X Q,et al.The role of miRNA and lncRNA in gastric cancer[J/OL].Oncotarget,2017,8(46):81572-81582[2019-05-26].DOI:10.18632/oncotarget.19197.
(中国肿瘤生物治疗杂志,2019,26(9))