发布时间:2020年08月14日 08:50:30 来源:振东健康网
李三中,唐旭东
(1广东医科大学生物化学与分子生物学研究所,湛江524023;2广东医科大学
抗肿瘤活性物质研发协同创新中心,湛江524023)
【摘 要】三基序蛋白25(tripartite motif25,TRIM25)是一种E3泛素连接酶,其介导的维甲酸诱导基因Ⅰ(retinoic acid-inducible geneI,RIG-I)泛素化是启动细胞内抗病毒反应的重要步骤。近期研究发现,TRIM25还能通过其他途径调节宿主抗病毒能力,包括RIG-Ⅰ的负调节、黑色素瘤分化相关基因5(melanoma differentiation-associatedgene5,MDA5)的激活、增强锌指抗病毒蛋白(zinc-finger antiviral protein,ZAP)活性、抑制病毒RNA合成。与此同时,病毒与宿主能通过多种机制调节TRIM25,包括泛素化降解、与细胞和病毒RNA结合、与RIG-Ⅰ的结合、竞争TRIM25作用底物。TRIM25在肺癌、前列腺癌、肝癌、乳腺癌、胃癌、结直肠癌等恶性肿瘤的发生发展中也发挥重要作用。为了更好地了解TRIM25在抗病毒天然免疫与肿瘤发生发展中的作用及其机制,现对近年TRIM25在这两方面的研究进展进行总结。
【关键词】TRIM25;泛素化;病毒;天然免疫;肿瘤
[中图分类号]R382;R730.2 [文献标志码]A [文章编号]1004-0374(2020)04-0359-07
Research progress of TRIM25 in antiviral innate immunity and occurrence and
development of malignant tumors
LI San-Zhong1,2,TANG Xu-Dong1,2*
(1 Institute of Biochemistry and Molecular Biology,Guangdong Medical University,Zhanjiang 524023,China;
2 Collaborative Innovation Center for Antitumor Active Substance Research and Development,
Guangdong Medical University,Zhanjiang 524023,China)
[Abstract] Tripartite motif 25 (TRIM25),an E3 ubiquitin ligase,the retinoic acid-inducible geneⅠ(RIG-Ⅰ)ubiquitination mediated by TRIM25 is an important step in the initiation of antiviral response in the cells.Recent studies have found that TRIM25 can regulate the antiviral ability of hosts through other ways,including negative regulation of RIG-Ⅰ,activation of melanoma differentiation associated gene 5 (MDA5),enhancement of zinc-finger antiviral protein(ZAP)activity and inhibition of viral RNA synthesis.At the same time,viruses and hosts can regulate TRIM25 through a variety of mechanisms,including ubiquitination degradation,binding to cellular and viral RNA,binding to RIG-Ⅰ and competing for TRIM25 substrates.TRIM25 also plays an important role in malignant tumors including lung cancer,prostate cancer,liver cancer,breast cancer,gastric cancer and colorectal cancer.In order to better understand the roles and mechanisms of TRIM25 in the antiviral innate immunity and the occurrence and development of tumorigenesis,this paper summarizes the research progress of TRIM25 in these two aspects.
[Key words] TRIM25;ubiquitin;virus;innate immunity;tumor
现已在人类中发现80多个三基序蛋白(tripartite motif,TRIM)基因[1]。三基序蛋白25(tripartite motif 25,TRIM25)为TRIM家族成员之一,是Ⅰ型和Ⅱ型干扰素(interferon,IFN)诱导的E3连接酶,由RING结构域、两个B-box结构域、一个螺旋线圈域(coiled-coil domain,CCD)和C端SPRY域组成。TRIM25是第一个被证实的具有免疫调节作用的TRIM[2]。1993年,Inoue等[3]首次发现TRIM25并将其鉴定为雌激素反应性指蛋白,其在雌激素反应性受体阳性乳腺细胞中表达上调。随后的研究表明,TRIM25是雌激素受体α27的下游靶点,并且其作为主要反应基因介导雌激素对乳腺癌细胞生长的影响[4]。
在抗病毒天然免疫中,维甲酸诱导基因Ⅰ(retinoic acid-inducible geneⅠ,RIG-Ⅰ)通过识别病毒复制产生的RNA活化下游分子,最终产生Ⅰ型IFN和促炎因子,而TRIM25与RIG-Ⅰ的结合是启动RIG-Ⅰ识别病毒RNA的关键步骤[5]。近年来也发现,TRIM25在多种恶性肿瘤中表达上调,通过不同机制促进恶性肿瘤细胞的增殖与迁移,其作为双重调节因子在免疫反应和恶性肿瘤发生发展中发挥作用。因此,本文对TRIM25在抗病毒天然免疫、恶性肿瘤发生发展中作用的研究进展进行了总结。
1、TRIM25在抗病毒天然免疫中的作用
1.1 TRIM25调节宿主抗病毒能力的途径
RIG-Ⅰ在宿主抵御RNA病毒感染的反应中起着至关重要的作用,而TRIM25介导的RIG-Ⅰ的泛素化激活是启动细胞内抗病毒反应的重要步骤。然而,近年来发现,TRIM25还能通过其他途径调节宿主的抗病毒能力,包括RIG-Ⅰ的负调节、黑色素瘤分化相关基因5(melanoma differentiation-associatedgene5,MDA5)的激活、增强锌指抗病毒蛋白(zinc-finger antiviral protein,ZAP)的活性、抑制病毒RNA合成。
1.1.1 TRIM25调节RIG-Ⅰ与MDA5
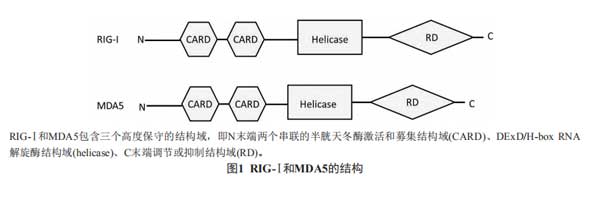
诱导RIG-Ⅰ的泛素化是TRIM25调节宿主抗病毒天然免疫能力的主要方式。RIG-Ⅰ和MDA5是模式识别受体RIG-Ⅰ样受体(RIG-Ⅰ-likereceptors,RLRs)家族的两个主要成员,在识别广谱RNA病毒以及某些DNA病毒中发挥重要作用。RIG-Ⅰ识别具有5'-三磷酸的病毒RNA以及较短的dsRNA,MDA5则识别较长的dsRNA或病毒多聚RNA[6]。RIG-Ⅰ和MDA5具有三个高度保守的结构域(图1):N末端两个串联的半胱天冬酶激活和募集结构域(caspase activation and recruitment domains,CARD)、DExD/H-boxRNA解旋酶结构域、C末端调节或抑制结构域(C terminal domain regulatory or repressed domain,CTD/RD),与病毒RNA结合需要解旋酶结构域和RD的参与,CARD则与下游信号传递相关[7]。
RIG-Ⅰ在未感染的细胞中处于抑制状态,其激活依赖于TRIM25的E3泛素连接酶活性[8]。RIG-Ⅰ识别病毒RNA后暴露其两个CARD,TRIM25的SPRY结构域与第一个CARD结合,催化第二个CARD172赖氨酸位点发生K63多聚泛素化,随后被激活的RIG-Ⅰ与线粒体抗病毒信号蛋白(mito chondrial antiviral signaling protein,MAVS)结合[5]。2018年,Lian等[9]研究还发现,TRIM25可以以类似的方式催化MDA5使之激活,在MDA5-MAVS抗病毒轴中发挥作用。TRIM25介导的泛素化激活是其对RIG-Ⅰ信号调节最具特征性的作用之一。
RIG-Ⅰ和MDA5在激活后发生构象变化,并被募集到它们的共同下游效应器MAVS,随后,MAVS激活TANK结合激酶1、干扰素调节因子(interferon regulatory factor,IRF)3/7以及典型的IKKα/β/γ复合物,IKKα/β/γ复合物激活核转录因子κB(nuclear factor kappa B,NF-κB),IRF3/7移位到细胞核后促进Ⅰ型IFN基因和促炎性细胞因子的表达[10]。这些分子不仅抑制病毒的复制、组装和传播,而且在激活适应性免疫应答方面起着关键作用。
TRIM25不仅能正向激活RIG-Ⅰ,同时也能负向调节RIG-Ⅰ。泛素样蛋白FAT10由促炎症细胞因子诱导产生,能与RIG-Ⅰ的第二个CARD非共价结合,导致RIG-Ⅰ沉淀,阻止RIG-Ⅰ靶向MAVS,有效地减弱了IRF3和NF-κB的活化,而TRIM25能够稳定泛素样蛋白FAT10进而负调节RIG-Ⅰ,以防止过度免疫反应与宿主损伤[11]。RIG-Ⅰ的活性受到翻译后修饰的严格调控,以确保在快速激活的同时避免发生过度的免疫激活[12]。
1.1.2 TRIM25增强ZAP活性
ZAP是一种抑制病毒mRNA翻译的细胞蛋白,它识别具有高CG-二核苷酸含量的病毒mRNA[13]。TRIM25能够作为ZAP抗病毒活性的关键调节因子增强其抗病毒活性,在对其机制的进一步研究中发现,TRIM25能介导ZAP的K48和K63连锁的多聚泛素化,但将ZAP泛素化位点突变使其失去泛素化功能后不会影响其抗病毒能力,推测TRIM25增强ZAP的抗病毒能力与其泛素化功能无关,是通过其他宿主因素上调ZAP的抗病毒能力[14]。
1.1.3 TRIM25抑制病毒RNA合成
关于TRIM25调节宿主抗病毒能力的报道大都聚焦于TRIM25的泛素连接酶活性以及和IFN相关的间接调节途径,但Meyerson等[15]指出,TRIM25能够直接抑制病毒RNA合成。
在限制甲型流感病毒复制的研究中发现,TRIM25能同时结合病毒核糖核蛋白(viral ribonucleoproteins,vRNPs)的RNA和蛋白质成分,在vRNPs相关RNA模板上起分子钳的作用,将RNA锁定在适当位置,阻碍RNA进入聚合酶复合物,阻止RNA链延伸,从而抑制病毒RNA合成[15]。
1.2 对TRIM25的调控机制
为了在感染后进行有效的复制,许多病毒已进化出复杂的机制干扰宿主的免疫反应,由于TRIM25在抗病毒天然免疫中的关键作用,TRIM25不可避免地成为了许多病毒的靶点;与此同时,为了对抗病毒的复制,宿主也进化出相应的机制拮抗病毒的干扰,因此,TRIM25受到病毒与宿主的双重调节。
1.2.1 TRIM25的泛素化降解
TRIM25具有泛素连接酶活性,但其自身也能被泛素化降解。H5N1猪源禽流感病毒的非结构蛋白1(nonstructural proteins 1,NS1)效应区的EALQR基序(AA191~195)发生的自然缺失减弱了NS1对宿主IFN相关细胞因子表达的抑制作用,EALQR缺失的NS1表现出更低的毒性;进一步研究表明,该基序的存在使NS1具备了诱导TRIM25寡聚化和自身泛素化的能力,使TRIM25泛素化降解增加,影响病毒在哺乳动物细胞和动物中的复制和毒力[16]。因此,EALQR基序可能成为未来小分子药物和疫苗的潜在靶点。
某些病毒产物能通过与TRIM25形成复合物促进TRIM25的泛素化降解。人乳头瘤病毒16型(human papillomavirus type16,HPV16)以及其他HPV类型的E6癌蛋白能与泛素特异性蛋白酶15(ubiquitin-specific protease 15,USP15)和TRIM25形成三元复合物,此三元复合物促进TRIM25降解,从而抑制RIG-Ⅰ激活和抗病毒信号转导[17]。Gupta等[18]研究发现,Epstein-Barr病毒也能诱导TRIM25的降解。14-3-3σ控制多条信号通路的活性并稳定TRIM25与RIG-Ⅰ的相互作用[19],促进RIG-Ⅰ泛素化和活性复合体向MAVS转移以进行下游信号传递。BPLF1是由Epstein-Barr病毒编码的病毒解偶联酶,BPLF1能与14-3-3σ结合,与TRIM25形成一个三分子复合物,促进TRIM25自身泛素化降解,减少RIG-Ⅰ泛素化并阻断Ⅰ型IFN的产生。
除病毒能调节TRIM25的泛素化降解外,宿主也有相应的机制泛素化降解TRIM25。线性泛素链组装复合物(linear ubiquitin chainassembly complex,LUBAC)是由氧化血红素IRP2泛素连接酶1(heme oxidized IRP2 ubiquitin ligase-1,HOIL-1)、HOIL-1相互作用蛋白(HOIL-1interacting protein,HOIP)组成的泛素聚合物,能通过泛素化TRIM25的C末端SPRY结构域从而降解TRIM25[20]。
然而,TRIM25的这种泛素化降解是可逆的。质谱分析发现,USP15可与TRIM25结合,而且进一步的研究还表明,USP15可去除LUBAC介导的K48连接的多聚泛素链,从而增强TRIM25稳定性以及RIG-Ⅰ介导的Ⅰ型IFN的表达[21]。泛素化与去泛素化过程对早期免疫反应的动态调节是至关重要的[10],因为先天免疫反应虽然能限制病毒感染,但必须严格控制,以避免免疫介导的宿主损伤、过度炎症和自身免疫。
1.2.2 TRIM25与RNA的结合
TRIM25是一种RNA结合蛋白,这种RNA结合能力能够影响细胞内信号转导与RNA病毒复制。TRIM25结合RNA通过以下3种形式调控抗病毒反应:第一,通过变构效应或通过多个TRIM25分子的聚集来增强泛素化活性;第二,通过调节TRIM25二聚体的多域结构,从而在泛素化反应期间调节SPRY和RBCC元件的结构耦合;第三,促进E3连接酶在病毒感染期间的亚细胞定位[22]。
TRIM25的RNA结合活性是由它的SPRY结构域介导的,Choudhury等[23]发现,TRIM25能与自身mRNA的3'-非翻译区(untranslatedregion,UTR)和5'-UTR结合,TRIM25与3'-UTR结合增强其自身泛素化。Sanchez等[22]发现,TRIM25在体外可结合dsRNA和ssRNA,在连接SPRY结构域和RBCC结构域的L2区域中存在一个富含赖氨酸的7K(381KKVSKEEKKSKK392)序列,其中SPRY结构域和7K序列都是TRIM25与RNA结合的决定因素。
Lin等[24]研究表明,除自身mRNA外,TRIM25也能与长链非编码RNA(longnon-coding RNA,lncRNA)结合;Lnczc3h7a是一种细胞质lncRNA,能与TRIM25的SPRY结构域结合,并作为分子支架在病毒感染早期稳定RIG-Ⅰ与TRIM25的结合,促进RIG-Ⅰ与TRIM25相互作用。相反,一些RNA病毒可以利用TRIM25结合RNA的能力来抑RIG-Ⅰ的抗病毒活性,如登革热病毒RNA能够有效地结合TRIM25,干扰USP15的去泛素化,从而阻止Ⅰ型IFN诱导的RIG-Ⅰ信号的持续扩增[10]。由于病毒RNA能与SPRY结合,因此,Lnczc3h7a可能通过抑制病毒RNA与TRIM25的相互作用从而阻止病毒免疫逃逸。
1.2.3 TRIM25与RIG-Ⅰ的结合
某些病毒能够干扰TRIM25与RIG-Ⅰ的结合。呼吸道合胞病毒(respiratory syncytial virus,RSV)的NS1与严重急性呼吸综合征冠状病毒的核衣壳蛋白(N蛋白)能够通过与SPRY结构域结合,从而干扰TRIM25与RIG-Ⅰ的结合;与RSV的NS1相似,甲型流感病毒的NS1对称地结合在TRIM25二聚体的每个单体的CCD上,代替了原本应与CARD结合的SPRY,干扰TRIM25对RIG-Ⅰ的泛素化激活,但是研究发现,甲型流感病毒的NS1并不会影响TRIM25二聚体与K63多聚泛素链的形成[25-27]。副黏病毒V蛋白的目标靶点也是TRIM25的SPRY结构域,其通过阻断TRIM25激活RIG-Ⅰ使RIG-Ⅰ不能与MAVS进行相互作用;不同的是,V蛋白不仅不会破坏RIG-Ⅰ与TRIM25的结合,反而增强了RIG-Ⅰ与TRIM25的相互作用[28]。这些研究报道表明,不同病毒虽然都能影响TRIM25与RIG-Ⅰ的结合,但其作用机制与最终效果却可能不同。
核相关激酶2(nuclear Dbf2-related 2,NDR2)是丝氨酸/苏氨酸激酶家族的一个成员,在真核生物中高度表达;NDR2作为一个支架蛋白,以非依赖性激酶活性的方式协助TRIM25与细胞质中的RIG-I之间的相互作用,从而增强RIG-I的K63连锁多泛素化和激活[29]。Lian等[9]发现,锌指蛋白ZCCHC3与病毒dsRNA的结合增强了RIG-Ⅰ、MDA5与病毒dsRNA的结合能力,此外,ZCCHC3还与TRIM25的C端SPRY结构域结合,促进TRIM25的SPRY结构域与RRIG-Ⅰ/MDA5的CARD结构域的相互作用,使RIG-Ⅰ/MDA5泛素化激活,而ZCCHC3的缺失能抑制RIG-Ⅰ和MDA5介导的信号转导。亲环素A(cyclophilin A,CyPA)是一种广泛表达的肽基脯氨酰顺反异构酶,能够通过促进RIG-Ⅰ与TRIM25之间的相互作用,使RIG-Ⅰ活性增强[30]。核苷酸结合寡聚化结构域样受体蛋白-12(nucleotide binding oligomerization domain-like receptors protein-12,NLRP12)是一种主要由树突状细胞和嗜中性粒细胞表达的含核苷酸结合寡聚化结构域样受体。Chen等[31]研究发现,骨髓系中的NLRP12与TRIM25相互作用,破坏RIG-Ⅰ与TRIM25结合以及RIG-Ⅰ的多聚泛素化,阻止了RIG-Ⅰ的激活,在病毒感染期间,NLRP12介导的抑制因其表达减少而降低。宿主能通过不同机制促进或者抑制TRIM25与RIG-Ⅰ的结合,因此,宿主对TRIM25与RIG-Ⅰ结合的调节是其保持免疫反应动态平衡的另一途径;另外,宿主对TRIM25与RIG-Ⅰ结合的促进作用是拮抗病毒对TRIM25与RIG-Ⅰ结合抑制的有力措施。
1.2.4 竞争抑制调控
与TRIM25竞争作用底物是宿主调控抗病毒能力的另一途径。CypA除上文所述通过促进RIG-Ⅰ与TRIM25之间的相互作用使RIG-Ⅰ活性增强外,还能与MAVS结合,从而与TRIM25形成竞争关系,减少TRIM25诱导的K48介导的MAVS泛素化和蛋白酶体降解,正向调控免疫反应[30]。LUBAC也能与TRIM25形成竞争关系,但LUBAC与CypA的作用底物不同,LUBAC通过HOIL-1L的Npl4型锌指构域与TRIM25竞争RIG-Ⅰ,从而阻断TRIM25对RIG-Ⅰ的泛素化激活,抑制TRIM25介导的RIG-Ⅰ泛素化[20]。
1.2.5 其他调节TRIM25的机制
乙型肝炎病毒(hepatitis B virus,HBV)可引起慢性乙型肝炎,导致肝硬化和肝癌。IFN是治疗慢性乙型肝炎的有效药物,在对IFN抗病毒作用的机制研究中发现:Ⅰ型IFN诱导白细胞介素-27,从而激活信号转导与转录激活因子3和信号转导与转录激活因Ⅰ来促进TRIM25基因表达,升高的TRIM25通过诱导IFNα/β的产生抑制HBV复制,并且HBV感染会减弱TRIM25表达[32]。
遗传学和生理学实验室蛋白2(laboratory of genetics and physiology 2,LGP2)是RLR家族成员之一,LGP2依据感染病毒种类的不同发挥不同的调控作用。LGP2是RIG-Ⅰ信号通路的调节因子之一,2019年,Quicke等[33]报道,LGP2作用于TRIM25,抑制TRIM25介导的K63特异性泛素化,并且LGP2也影响TRIM25其他的泛素化底物,如MAVS。严重发热伴血小板减少综合征病毒能与RIG-Ⅰ、TRIM25和TANK结合激酶1相互作用,从而抑制Ⅰ型IFN的产生[34]。磷酸化也在调节TRIM25中发挥作用,酪氨酸激酶c-SRC能够调节TRIM25在Y278上酪氨酸磷酸化,从而影响RIG-Ⅰ介导的抗病毒信号[35]。
尽管已经公认TRIM25是抗病毒免疫反应的调节因子,但越来越多的证据表明,TRIM25调节先天免疫反应的机制比以前想象的要复杂得多。首先,TRIM25在RIG-Ⅰ调节中起着双重作用,并可通过增强ZAP以及直接限制病毒RNA合成的方式调节宿主抗病毒能力;其次,TRIM25本身又受到宿主与病毒泛素化降解、与自身和病毒RNA结合、与RIG-Ⅰ的结合、竞争抑制多种机制的调节。在诸多调节TRIM25的机制中,TRIM25的RNA结合能力是进一步研究的热点,以了解TRIM25是否能对除lncRNA、自身mRNA以及病毒RNA之外其他种类的RNA产生影响,例如自身或者病毒编码的微小RNA。
2、TRIM25与恶性肿瘤
TRIM25作为先天免疫的关键调节因子,参与NF-κB与IFN等天然免疫信号的调节。NF-κB广泛存在于细胞中,除了作为炎症调节因子外,与肿瘤细胞分化、增殖、凋亡、免疫应答等应激反应息息相关。Ⅰ型IFN在肿瘤细胞的免疫监控、抑制细胞增殖和免疫调控等方面也有着重要的作用。近年来,已发现TRIM25在肺癌、前列腺癌、肝癌等恶性肿瘤中发挥重要作用。
2.1 TRIM25与肺癌
TRIM25在肺癌发生发展中有重要作用。Zhang等[36]研究发现,TRIM25能够通过影响p53的表达水平与转录活性对肺癌细胞的增殖迁移进行调节。TRIM25在人肺癌组织中高表达,通过敲低TRIM25表达能够抑制肺癌细胞的增殖和体外迁移[37]。此外,TRIM25的表达与非小细胞肺癌(non-small cell lungcancer,NSCLC)的TNM分期和淋巴结转移呈正相关,敲除TRIM25后显著增加肺癌细胞对阿霉素的敏感性,使阿霉素诱导的肺癌细胞凋亡显著增加;进一步探索其机制发现,TRIM25在肺癌组织和细胞中与p53和小鼠双微体2形成复合物,敲除TRIM25促进了肺癌细胞中p53的表达,因此,TRIM25可能通过调节p53的表达影响肺癌细胞凋亡[37-38];而miR-365能够通过抑制肺癌细胞中TRIM25的表达,上调促凋亡蛋白的表达[39]。此外,TRIM25也被发现与A549细胞中通过抑制14-3-3σ的表达获得对化疗药物顺铂的耐药性有关[40]。
2.2 TRIM25与前列腺癌
TRIM25高表达是前列腺癌患者的预后因素,与前列腺癌患者的预后不良显著相关,并且TRIM25能与GTP酶激活蛋白结合蛋白2相互作用形成复合物,调节p53核输出,促进前列腺癌细胞增殖与迁移,敲除TRIM25后,前列腺癌细胞的生长受到了明显的抑制,表明TRIM25是前列腺癌的潜在治疗靶点[41]。
2.3 TRIM25与肝癌
肝细胞癌(hepatocellular carcinoma,HCC)转移的重要调节因子之一是转移相关蛋白1(metastasis associated 1 protein,MTA-1),MTA-1的表达与癌症患者的不良预后直接相关。与正常肝细胞相比,肝癌细胞中MTA-1的表达显著增加,这是由于TRIM25能够促进MTA-1的降解,而在肝癌细胞中TRIM25表现为低表达;另有研究表明,在肝癌细胞中,miR-873抑制TRIM25的表达导致MTA-1上调,最终引起肝癌细胞增殖、转移[42-43]。在TRIM25降解MTA-1的机制研究中,发现TRIM25在MTA-1的K98处起作用,使MTA-1在K98残基上被TRIM25多泛素化降解[44]。
F框/WD40域蛋白(F-box and WD repeat domain containing 7,FBXW7)是F-box蛋白家族中的一员,在人体各组织细胞均有表达。C-Myc作为一种原癌基因在至少50%的癌症中高表达,在许多情况下,C-Myc的蛋白质水平与治疗抵抗、不良预后相关,已有研究发现,TRIM25能够通过拮抗FBXW7介导的C-Myc降解促进肝癌细胞增殖[45]。
2.4 TRIM25与其他肿瘤
TRIM25在乳腺癌中高表达,其通过靶向细胞周期调节因子14-3-3σ进入蛋白酶体降解来促进乳腺癌细胞生长[46]。胰岛素样生长因子2mRNA结合蛋白3(insulin like growth factor 2mRNAbinding protein3,IGF2BP3)稳定并促进mRNA的翻译,miRNA-3614通过与TRIM25mRNA3'-UTR结合而抑制TRIM25基因的表达,IGF2BP3可竞争性地占据该结合位点并抑制miRNA-3614成熟,从而保护TRIM25mRNA免受miR-3614介导的降解;沉默IGF2BP3后也能降低TRIM25的表达,抑制乳腺癌细胞增殖,并且表现出与miR-3614过表达的协同作用[47]。
TRIM25在胃癌与结直肠癌中都为高表达,并且TRIM25通过调节TGF-β影响胃癌与结直肠癌的进展;TRIM25能影响胃癌细胞的迁移和侵袭,而且对结直肠癌细胞的增殖和转移起到促进作用;因此,TRIM25可能是治疗胃癌与结直肠癌的潜在靶点[48-49]。
3、小结与展望
TRIM25在抗病毒天然免疫和肺癌等恶性肿瘤发生、发展中具有多种功能,其作为免疫反应和恶性肿瘤发生发展的双重调节因子受到病毒与宿主的多种机制的调节。TRIM25结合RNA的能力提示人们可以探索新的策略来调节先天免疫反应以减少病毒复制和避免过度炎症。TRIM25表现出的对多种恶性肿瘤的影响使之有潜力成为肿瘤综合治疗的新靶点。
虽然关于TRIM25的研究取得越来越多的进展,但仍然存在一些问题需要进一步探索:(1)尽管有报道指出TRIM25能影响ZAP的抗病毒活性,但其抗病毒机制尚不清楚;(2)TRIM25的RNA结合能力对其功能至关重要,但TRIM25的RNA结合能力如何影响它的泛素化作用,以及TRIM25固有的二聚体和潜在的多聚体性质如何影响它们识别和募集RNA目标还有待进一步探索;(3)TRIM25在肺癌、乳腺癌、前列腺癌、胃癌和结直肠癌等上调,但在肝癌中却为低表达,其具体的分子机制还需进一步研究。
参考文献
[1]Hatakeyama S.TRIM family proteins:roles in autophagy,immunity,and carcinogenesis.Trends Biochem Sci,2017,42:297-311
[2]Van Gent M,Sparrer KMJ,Gack MU.TRIM proteins and their roles in antiviral host defenses.Annu Rev Virol,2018,5:385-405
[3]Inoue S,Orimo A,Hosoi T,et al.Genomic binding-site cloning reveals an estrogen-responsive gene that encodes a RING finger protein.Proc Natl Acad Sci USA,1993,90:11117-21
[4]Ikeda K,Orimo A,Higashi Y,et al.Efp as a primary estrogen-responsive gene in human breast cancer.FEBS Lett,2000,472:9-13
[5]Gack MU,Shin YC,Joo CH,et al.TRIM25 RING-finger E3 ubiquitin ligase is essential for RIG-I-mediated antiviral activity.Nature,2007,446:916-20
[6]Chiang JJ,Sparrer KMJ,van Gent M,et al.Viral unmasking of cellular 5S rRNA pseudogene transcripts induces RIG-I-mediated immunity.Nat Immunol,2018,19:53-62
[7]Takeuchi O,Akira S.Pattern recognition receptors and inflflammation.Cell,2010,140:805-20
[8]Koliopoulos MG,Lethier M,van der Veen AG,et al.Molecular mechanism of influenza A NS1-mediated TRIM25 recognition and inhibition.Nat Commun,2018,9:1820
[9]Lian H,Zang R,Wei J,et al.The zinc-finger protein ZCCHC3 bindsRNAand facilitates viralRNAsensing and activation of the RIG-I-like receptors.Immunity,2018,49:438-48
[10]Martin-Vicente M,Medrano LM,Resino S,et al.TRIM25 in the regulation of the antiviral innate immunity.Front Immunol,2017,8:1187
[11]Nguyen NT,Now H,Kim WJ,et al.Ubiquitin-like modifier FAT10 attenuates RIG-I mediated antiviral signaling by segregating activated RIG-I from its signaling platform.Sci Rep,2016,6:23377
[12]Chiang C,Gack MU.Post-translational control of intracellular pathogen sensing pathways.Trends Immunol,2017,38:39-52
[13]Takata MA,Goncalves-Carneiro D,Zang TM,et al.CG dinucleotide suppression enables antiviral defence targeting non-self RNA.Nature,2017,550:124-7
[14]Li MM,Lau Z,Cheung P,et al.TRIM25 enhances the antiviral action of zinc-finger antiviral protein (ZAP).PLoS Pathog,2017,13:e1006145
[15]Meyerson NR,Zhou L,Guo YR,et al.Nuclear TRIM25 specifically targets influenza virus ribonucleoproteins to block the onset ofRNAchain elongation.Cell Host Microbe,2017,22:627-38
[16]Wang J,Zeng Y,Xu S,et al.A naturally occurring deletion in the effector domain of H5N1 swine influenza virus nonstructural protein 1 regulates viral fitness and host innate immunity.J Virol,2018,92:e00149-18
[17]Chiang C,Pauli EK,Biryukov J,et al.The human papillomavirus E6 oncoprotein targets USP15 and TRIM25 to suppress RIG-I-mediated innate immune signaling.J Virol,2018,92:e01737-17
[18]Gupta S,Yla-Anttila P,Masucci MG.A novel mechanism for regulation of the type I IFN response by herpesvirus deconjugases.Microb Cell,2018,5:259-61
[19]Morrison DK.The 14-3-3 proteins:integrators of diverse signaling cues that impact cell fate and cancer development.Trends Cell Biol,2009,19:16-23
[20]Inn KS,Gack MU,Tokunaga F,et al.Linear ubiquitin assembly complex negatively regulates RIG-I-and TRIM25-mediated type I interferon induction.Mol Cell,2011,41:354-65
[21]Teyra J,Singer AU,Schmitges FW,et al.Structural and functional characterization of ubiquitin variant inhibitors of USP15.Structure,2019,27:590-605
[22]Sanchez JG,Sparrer KMJ,Chiang C,et al.TRIM25 bindsRNAto modulate cellular anti-viral defense.J Mol Biol,2018,430:5280-93
[23]Choudhury NR,Heikel G,Trubitsyna M,et al.RNA binding activity of TRIM25 is mediated by its PRY/SPRY domain and is required for ubiquitination.BMC Biol,2017,15:105
[24]Lin H,Jiang M,Liu L,et al.The long noncodingRNALnczc3h7a promotes a TRIM25-mediated RIG-I antiviral innate immune response.Nat Immunol,2019,20:812-23
[25]Ban J,Lee NR,Lee NJ,et al.Human respiratory syncytial virus NS 1 targets TRIM25 to suppress RIG-I ubiquitination and subsequent RIG-I-mediated antiviral signaling.Viruses,2018,10:716
[26]Hu Y,Li W,Gao T,et al.The severe acute respiratory syndrome coronavirus nucleocapsid inhibits type I interferon production by interfering with TRIM25-mediated RIG-I ubiquitination.J Virol,2017,91:e02143-16
[27]Koliopoulos MG,Lethier M,van der Veen AG,et al.Molecular mechanism of influenza A NS1-mediated TRIM25 recognition and inhibition.Nat Commun,2018,9:1820
[28]Sánchez-Aparicio MT,Feinman LJ,Garcia-Sastre A,et al.Paramyxovirus V proteins interact with the RIG-I/ TRIM25 regulatory complex and inhibit RIG-I signaling.J Virol,2018,92:e01960-17
[29]Liu Z,Wu C,Pan Y,et al.NDR2 promotes the antiviral immune response via facilitating TRIM25-mediated RIG-I activation in macrophages.Sci Adv,2019,5:eaav0163
[30]Liu W,Li J,Zheng W,et al.Cyclophilin A-regulated ubiquitination is critical for RIG-I-mediated antiviral immune responses.Elife,2017,6:e24425
[31]Chen ST,Chen L,Lin DS,et al.NLRP12 regulates antiviral RIG-I activation via interaction with TRIM25.Cell Host Microbe,2019,25:602-16[32]Tan G,Xiao Q,Song H,et al.Type I IFN augments IL-27-dependent TRIM25 expression to inhibit HBV replication.Cell Mol Immunol,2018,15:272-81
[33]Quicke KM,Kim KY,Horvath CM,et al.RNA helicase LGP2 negatively regulates RIG-I signaling by preventing TRIM25-mediated caspase activation and recruitment domain ubiquitination.J Interferon Cytokine Res,2019,39:669-83
[34]Santiago FW,Covaleda LM,Sanchez-Aparicio MT,et al.Hijacking of RIG-I signaling proteins into virus-induced cytoplasmic structures correlates with the inhibition of type I interferon responses.J Virol,2014,88:4572-85
[35]Lee NR,Choi JY,Yoon IH,et al.Positive regulatory role of c-Src-mediated TRIM25 tyrosine phosphorylation on RIG-I ubiquitination and RIG-I-mediated antiviral signaling pathway.Cell Immunol,2018,332:94-100
[36]Zhang P,Elabd S,Hammer S,et al.TRIM25 has a dual function in the p53/Mdm2 circuit.Oncogene,2015,34:5729-38
[37]Qin Y,Cui H,Zhang H.Overexpression of TRIM25 in lung cancer regulates tumor cell progression.Technol Cancer Res Treat,2016,15:707-15
[38]Jing HZ,Qiu F,Chen SZ,et al.Tripartite-motif protein 25 and pyruvate kinase M2 protein expression in non-small cell lung cancer.Nan Fang Yi Ke Da Xue Xue Bao,2015,35:437-41
[39]Han Q,Cheng P,Yang H,et al.Altered expression of
microRNA-365 is related to the occurrence and development of non-small-cell lung cancer by inhibiting TRIM25 expression.J Cell Physiol,2019,234:22321-30
[40]Qin X,Qiu F,Zou Z.TRIM25 is associated with cisplatin resistance in non-small-cell lung carcinoma A549 cell line via downregulation of 14-3-3σ.Biochem Biophys Res Commun,2017,493:568-72
[41]Takayama KI,Suzuki T,Tanaka T,et al.TRIM25 enhances cell growth and cell survival by modulating p53 signals via interaction with G3BP2 in prostate cancer.Oncogene,2018,37:2165-80
[42]Zang HL,Ren SN,Cao H,et al.The ubiquitin ligase TRIM25 inhibits hepatocellular carcinoma progression by targeting metastasis associated 1 protein.IUBMB Life,2017,69:795-801
[43]Li YH,Zhong M,Zang HL,et al.The E3 ligase for metastasis associated 1 protein,TRIM25,is targeted by microRNA-873 in hepatocellular carcinoma.Exp Cell Res,2018,368:37-41
[44]Li YH,Zhong M,Zang HL,et al.Mechanism of TRIM25 mediated ubiquitination of metastasis associated protein (MTA)1 in normal liver cells.Exp Cell Res,2018,371:250-4
[45]Zhang Q,Li X,Cui K,et al.The MAP3K13-TRIM25-FBXW7α axis affects c-Myc protein stability and tumor development.Cell Death Differ,2020,27:420-33
[46]Urano T,Saito T,Tsukui T,et al.Efp targets 14-3-3σ for proteolysis and promotes breast tumour growth.Nature,2002,417:871-5
[47]Wang Z,Tong D,Han C,et al.Blockade of miR-3614 maturation by IGF2BP3 increases TRIM25 expression and promotes breast cancer cell proliferation.EBioMedicine,2019,41:357-69
[48]Sun N,Xue Y,Dai T,et al.Tripartite motif containing 25 promotes proliferation and invasion of colorectal cancer cells through TGF-β signaling.Biosci Rep,2017,37:BSR20170805
[49]Zhu Z,Wang Y,Zhang C,et al.TRIM25 blockade byRNAinterference inhibited migration and invasion of gastric cancer cells through TGF-β signaling.Sci Rep,2016,6:19070
(生命科学第4期第32卷2020年4月)