发布时间:2020年12月16日 10:24:40 来源:振东健康网
任秋宇,黄钱,马露,何涛,甘淋
【摘要】目的:探讨雄激素受体(androgen receptor,AR)拮抗剂比卡鲁胺(bicalutamide)对AR阳性的三阴性乳腺癌(triple-negative breast cancer,TNBC)型BT549细胞的生物学功能的影响及可能的分子机制。方法:采用蛋白质印迹法筛选AR高表达的TNBC细胞株;CCK-8法检测不同浓度比卡鲁胺对BT549细胞增殖的抑制作用,并计算半数抑制浓度(half maximal inhibitory concentration,IC50),以等体积的DMSO处理BT549细胞作为对照组。采用比卡鲁胺(150 µmol/L)处理BT549细胞后,蛋白质印迹法检测比卡鲁胺对BT549细胞中AR表达水平的影响;FCM法检测对BT549细胞凋亡和细胞周期的影响,Transwell小室法检测对BT549细胞迁移及侵袭能力的影响;最后,再用蛋白印迹法检测细胞中E-上皮钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、蛋白激酶C(protein kinase C,PKC)、基质金属蛋白酶3(matrix metalloproteinases 3,MMP3)、细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)及其磷酸化ERK1/2(phospho-ERK1/2,p-ERK1/2)蛋白的表达水平。结果:筛选AR高表达的TNBC细胞株BT549为研究对象;不同浓度比卡鲁胺(20、40、80和160 μmol/L)均能抑制BT549细胞的增殖(P值均<0.01),比卡鲁胺对BT549细胞的IC50值为143.9 µmol/L。用比卡鲁胺(150 μmol/L)处理BT549细胞24 h后,与对照组相比,比卡鲁胺能明显抑制BT549细胞中AR蛋白的表达水平(P<0.01),并诱导BT549细胞发生凋亡(P<0.01),但对细胞周期无明显影响。比卡鲁胺明显抑制BT549细胞的迁移及侵袭能力(P<0.001和P<0.01);上调E-cadherin蛋白的表达水平,下调Vimentin、PKC、MMP3、ERK1/2和p-ERK1/2蛋白的表达水平(P值均<0.05)。结论:AR拮抗剂比卡鲁胺可抑制AR高表达TNBC型BT549细胞的增殖、迁移和侵袭能力,并诱导其凋亡。PKC可能是比卡鲁胺调控BT549细胞增殖和侵袭的关键分子。
【关键词】乳腺肿瘤;雄激素受体拮抗剂;细胞增殖;细胞凋亡;细胞运动
[中图分类号] R737.9 [文献标志码] A [文章编号] 1000-7431 (2020) 09-0614-11
Bicalutamide inhibits proliferation and invasion of triple negative breast cancer BT549 cells by down-regulation PKC expression
REN Qiuyu,HUANG Qian,Ma Lu,HE Tao,GAN Lin
【Abstract】Objective:To investigate the effect of androgen receptor(AR)antagonist bicalutamide on the biological functions of AR-positive triple-negative breast cancer(TNBC)BT549 cells,and its possible molecular mechanism.Methods:The TNBC cell lines with high AR expression were screened by Western blotting.The ability of cell proliferation was detected using cell counting kit-8(CCK-8)assay in BT549 cells treated with different concentrations of bicalutamide and calculated the half maximal inhibitory concentration(IC50),BT549 cells were treated with the equal volume of DMSO as the control group.After BT549 cells treatment with 150 μmol/L bicalutamide,the effect of bicalutamide on AR expression in BT549 cells was detected by Western blotting.The apoptotic rate and cell cycle distribution were evaluated using FCM,and the migration and invasion capabilities were analyzed using Transwell assay.And the expression of E-cadherin,Vimentin,protein kinase C(PKC),matrix metalloproteinases 3(MMP3),extracellular signalregulated kinase 1/2(ERK1/2)and phospho-ERK1/2(p-ERK1/2)were detected by Western blotting.Results:TNBC BT549 cells which its high AR expression were selected as cell model.The ability of cell proliferation was inhibited which the BT549 cells treated at the different concentrations of bicalutamide(20,40,80 and 160 μmol/L),The IC50 value of bicalutamide on BT549 cells was 143.9 μmol/L.After BT549 cells treatment with 150 μmol/L bicalutamide for 24 h,compared with the control group,bicalutamide significantly inhibited the expression level of AR protein in BT549 cells (P<0.01),and significantly induced BT549 cells apoptosis rate(P<0.01),but it had no effect on cell cycle.Bicalutamide observably inhibited the abilities of invasion and migration of BT549 cells(P<0.01 and P<0.001).Bicalutamide could increase the expression level of E-cadherin,while decrease the expression levels of Vimentin,PKC,MMP3,ERK1/2,and p-ERK1/2(all P<0.05).Conclusion:AR antagonist bicalutamide inhibits the proliferation,migration,invasion abilities,and induces apoptosis of AR-postive TNBC BT549 cells.PKC may be a key molecule in the regulation of BT549 cell proliferation and invasion by bicalutamide.
【Key words】Breast neoplasms;Androgen receptor antagonists;Cell proliferation;Apoptosis;Cell movement
乳腺癌是女性发生率最高的恶性肿瘤,是导致女性癌性死亡的第二大杀手[1]。三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种异质程度高的乳腺癌类型,表现为缺乏雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达,发病率约占所有乳腺癌的10%~20%[2],其特征是发病年龄早,侵袭能力强,易转移和预后差[3]。与乳腺癌其他亚型相比,TNBC因缺乏激素受体和HER2靶向受体,内分泌和靶向治疗效果差,当前细胞毒性化疗仍然是主要的全身性治疗手段。为了更好的治疗TNBC患者,提高其生活质量和改善生存率,当前迫切需要探寻新的治疗靶点和治疗药物。
雄激素受体(androgen receptor,AR)为一种配体激活的转录因子,是核受体家族一员,主要参与肿瘤细胞的增殖、侵袭和细胞周期改变等生物学过程。AR基因位于人X染色体q11-12上,其编码蛋白的相对分子质量为1.1×105。目前研究发现,大多数肿瘤中均可检测到AR的表达,包括前列腺癌、乳腺癌、卵巢癌和子宫内膜癌等激素依赖性肿瘤。其中高达77%的乳腺癌和约30%的TNBC中发现AR高表达[4]。以AR为靶标的抗AR治疗在前列腺癌的治疗中已取得显著成效,并且AR拮抗剂[比卡鲁胺(bicalutamide)和恩扎鲁胺]已被美国食品药品监督管理局批准用于前列腺癌的临床治疗[5-6]。基于抗AR的治疗在前列腺癌治疗中已获得巨大成功,考虑到部分乳腺癌中也存在AR高水平表达,有研究提出AR拮抗剂可能在AR阳性表达(AR+)乳腺癌,尤其是治疗效果极差的AR+TNBC中发挥一定的治疗效果。
有文献报道,雄激素能够促进AR+TNBC细胞的增殖,且一系列临床前和临床研究均已证实抗雄激素治疗的确能够改善AR+TNBC患者的预后。如一项Ⅱ期研究,通过对424例AR+、ER阴性(ER-)和(或)PR阴性(PR-)的转移性乳腺癌患者进行每日口服比卡鲁胺的治疗,6个月后经评估,临床获益率为19%,这一结果表明比卡鲁胺可能具有一定的抗肿瘤作用,提示抗雄激素治疗可以作为AR+、ER-和(或)PR-转移性乳腺癌患者一种有效的治疗选择[7]。在另一项正在进行的Ⅱ期临床试验中,通过评估另一种抗AR药物恩扎鲁胺的功效时,也得到相似的结果,即AR拮抗剂的确有益于AR+TNBC患者的治疗[8]。目前越来越多的临床研究都提示,抗雄激素治疗对AR+TNBC患者具有一定的疗效,抗AR治疗有望靶向AR成为AR+TNBC患者一种新的治疗方式,但是关于抗AR的具体分子机制目前仍未阐明。因此,本研究中选取AR+TNBC细胞BT549为研究对象,检测AR拮抗剂比卡鲁胺是否通过调控蛋白激酶C(protein kinase C,PKC)对BT549细胞的生物学功能产生影响,并进一步探索可能的分子作用机制。
1、材料与方法
1.1细胞、试剂与仪器
人TNBC细胞株T47D、MDA-MB-231、BT549、MCF-7和SKBR3由西南医科大学基础医学院生物化学与分子生物学教研室提供。人工合成的AR拮抗剂比卡鲁胺购自中国大连美仑生物技术有限公司[比卡鲁胺可溶解于DMSO,配制成浓度为100 mmol/L的储备液,置于-20 ℃冰箱备用,使用时用含10%胎牛血清(fetal bovine serum,FBS)的RPMI 1640培养液稀释至所需的工作浓度,其中DMSO终体积浓度<0.1%]。PRMI 1640培养液、DMEM高糖培养液和胰蛋白酶购自美国Gibco公司,FBS购自德国PAN-biotech公司;青霉素-链霉素双抗和细胞周期试剂盒购自上海碧云天生物技术有限公司;蛋白裂解液购自美国SigmaAldrich公司;Transwell小室购自美国Millipore公司;基质胶(Martrigel)和细胞凋亡试剂盒购自美国BD公司;CCK-8试剂盒购自日本同仁株式会社化学研究所。兔抗人E-上皮钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、PKC和基质金属蛋白酶3(matrix metalloproteinases 3,MMP3)多克隆抗体购买自英国Abcam公司;兔抗人AR、ER、PR、HER2、细胞外信号调节激酶 1/2(extracellular signal-regulated kinase 1/2,ERK1/2)、磷酸化ERK1/2(phospho-ERK1/2,p-ERK1/2)和 GAPDH(内参照)多克隆抗体,以及辣根过氧化物酶标记的山羊抗兔IgG均购买自美国Cell Signaling Technology公司。
CO2恒温培养箱为美国Thermo公司产品,倒置相差显微镜(型号:CKX31)为日本Olympus公司产品,酶联免疫检测仪(型号:ELX800)为美国Bio Tek公司产品,FACSCanto Ⅱ流式细胞仪为美国BD公司产品,电泳仪及转膜仪为美国Bio Rad公司产品,ODYSSEY CLX荧光扫描仪(型号:ODYSSEY9120)为美国LiCor公司产品。
1.2细胞培养
将人乳腺癌BT549、T47D、MDA-MB-231、MCF-7和SKBR3细胞分别培养于含10% FBS、100 U/mL青霉素和0.1 mg/mL链霉素的RPMI 1640或DMEM高糖培养液中,置于37 ℃、CO2体积分数为5%的细胞培养箱中进行培养。
1.3蛋白质印迹法检测多种乳腺癌细胞中AR、ER、PR和HER2蛋白的表达水平
采用蛋白质印迹法检测乳腺癌T47D、MDA-MB-231、BT549、MCF-7和SKBR3细胞中AR、ER、PR和HER2蛋白的表达水平。将人乳腺癌BT549、T47D、MDA-MB-231、MCF-7和SKBR3细胞以1×106个/孔的密度接种于6孔板中,待细胞充分贴壁后,用胰蛋白酶消化并收集各组细胞。加入细胞裂解液裂解处理细胞,并将细胞裂解液收集于EP管中,超声处理15 s。通过Protein BCA Assay Kit(美国BioRad公司产品)检测上清液中蛋白的浓度。加入SDS上样缓冲液,混合均匀,100 ℃煮沸变性10 min。各组细胞取等量总蛋白上样,行10% SDSPAGE分离蛋白,采用湿转法将分离后的蛋白转移至PVDF膜上,室温条件下将膜置于含5%脱脂牛奶的封闭液中封闭1 h。随后,滴加一抗[兔抗人AR(体积稀释比例为1:2000)及ER、PR、HER2和GAPDH(内参照)(体积稀释比例均为1:1000)多克隆抗体]4 ℃反应过夜。用TBST洗膜3次,每次5 min;滴加二抗[辣根过氧化物酶标记的羊抗兔IgG(体积稀释比例为1:5 000)]室温下避光孵育1 h;再次用TBST洗膜3次,最后在荧光扫描仪中曝光后,分析各蛋白条带的灰度值。以目的蛋白条带与内参照 GAPDH蛋白条带灰度值之比表示目的蛋白的相对表达水平。
1.4CCK-8法检测细胞活力
待BT549细胞处于对数生长期后,弃除去 培养液,PBS洗涤细胞2次,胰蛋白酶消化处理后制成单细胞悬液。将BT549细胞以5×104个/孔的密度接种到96孔板中,过夜待细胞完全贴壁后,采用不同浓度的比卡鲁胺(0、20、40、80和160 μmol/L)处理细胞24 h,计算比卡鲁胺对的BT549细胞的半数抑制浓度(half maximal inhibitory concentration,IC50)。随后,根据IC50值采用浓度为150 μmol/L的比卡鲁胺处理BT549细胞(比卡鲁胺组),以加入等体积DMSO处理BT549细胞作为对照组,处理24、48和72 h后向每孔加入10 μL CCK-8溶液,继续置于37 ℃、CO2体积分数5%的细胞培养箱中孵育3 h,在设定为450 nm波长的酶联免疫检测仪中测量各孔的D值。每个实验组设置3个复孔,实验独立重复3次。细胞增殖抑制率(%)=[1-(药物组D值-调零组D值)/(对照组D值-调零组D值)]×100%。
1.5蛋白质印迹法检测比卡鲁胺对BT549细胞中AR蛋白表达水平的影响
将BT549细胞以1×106个/孔的密度接种于6孔板中,待细胞充分贴壁后,加入浓度为150 μmol/L的比卡鲁胺处理BT549细胞(比卡鲁胺组),同时以加入等体积溶剂DMSO处理BT549细胞作为对照组,处理细胞24 h,收集2组细胞,采用蛋白质印迹法检测2组细胞中AR的表达水平,实验流程同1.3节。
1.6FCM法检测比卡鲁胺对BT549细胞凋亡率及周期的影响
将BT549细胞以5×105个/孔的密度接种到6孔板中过夜,待细胞完全贴壁,加入比卡鲁胺(150 μmol/L),实验分组及处理方法同1.5节,每组设置3个复孔。药物处理24 h后,收集细胞,PBS洗涤细胞2次,用胰蛋白酶消化细胞制成细胞悬液;300×g离心3 min 除去上清液,再次用预冷的PBS重悬细胞,离心后除去上清液,加入300 μL 1×binding buffer重悬细胞,吹打均匀加入5 μL Annexin Ⅴ-FITC混匀,室温下避光孵育15 min;检测前5 min加入5 μL碘化丙啶(propidium iodide,PI),随后上流式细胞仪行FCM法检测细胞的凋亡率。
细胞周期的检测,细胞分组及收集细胞的检测步骤凋亡率的检测流程。最后,细胞中加入70%乙醇溶液,-20 ℃固定过夜;常规低速离心3 min除去乙醇溶液,PBS洗涤细胞2次;加0.5 mL PI染色,室温避光孵育30 min,上流式细胞仪检测细胞周期。
1.7Transwell小室实验检测比卡鲁胺对BT549细胞迁移和侵袭能力的影响
采用Transwell小室法检测细胞的迁移能力。收集BT549细胞,用不含血清培养的重悬细胞;将Transwell小室放置在24孔板中,每个上室中加入细胞悬液150 µL(1×105个/孔);实验分组及药物处理同1.5节。下室加入含20% FBS的培养液600 μL,形成血清浓度梯度差。将24孔板置于37 ℃、CO2体积分数为5%的培养箱中培养24 h。随后,取出小室,将上室中未穿过小室膜的细胞用棉签清除干净;PBS洗涤细胞后,用70%乙醇溶液固定细胞10 min;加入5%结晶紫染色15 min,PBS洗涤2次后,在光学显微镜下(放大倍数为400倍)随机选取4个视野观察细胞形态并计细胞数。
采用Transwell小室法检测细胞的侵袭能力。首先在上室中均匀铺入100 μL稀释后的Matrigel(避免气泡产生),将小室置于37 ℃静止4~6 h,待Matrigel凝固后,在上室中加入细胞,其余所
有检测步骤同细胞迁移。
1.8蛋白质印迹法检测比卡鲁胺对BT549细胞中侵袭和增殖相关蛋白表达的影响
将人乳腺癌BT549细胞以1×106个/孔的密度接种于6孔板中,待细胞充分贴壁后,用胰蛋白酶消化细胞并收集各组细胞;实验分组及药物处理方法同1.5节。采用蛋白质印迹法检测BT549细胞中E-cadherin、Vimentin、PKC、MMP3、ERK1/2和p-ERK1/2蛋白的表达水平,一抗为兔抗人E-cadherin、Vimentin、PKC、MMP3、ERK1/2、p-ERK1/2和GAPDH(内参照)多克隆抗体(体积稀释比例均为1:1000)。
1.9统计学方法
采用SPSS 13.0统计学软件对实验数据进行统计学处理,数据以x±s表示。细胞增殖抑制率的比较首先采用单因素方差分析,组内两两比较采用LSD-t检验。所有实验均独立重复3次。P<0.05为差异具有统计学意义。
2、结果
2.1蛋白质印迹法筛选AR高表达的TNBC型细胞
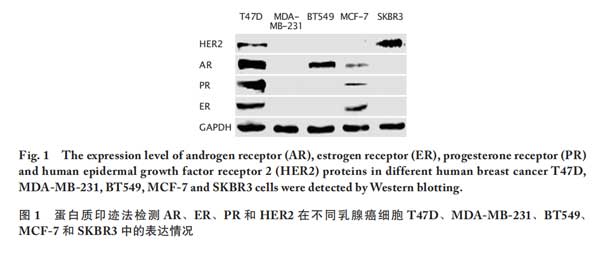
采用蛋白质印迹法检测乳腺癌T47D、MDA-MB-231、BT549、MCF-7和SKBR3细胞中AR、ER、PR和HER2蛋白的表达水平。结果(图1)显示,仅有BT549细胞中未见ER、PR和HER2表达,但AR高表达,提示其为一株AR高表达的TNBC 细胞,因此本研究中选择BT549细胞为研究对象进行后续实验。
2.2比卡鲁胺抑制BT549细胞的增殖
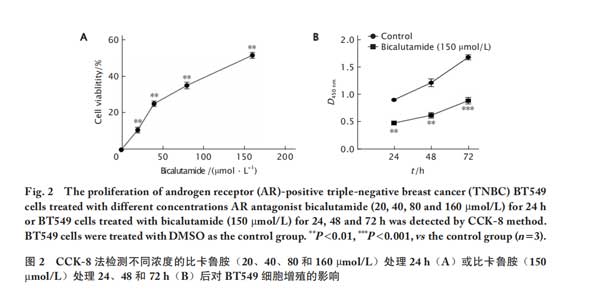
采用不同浓度的比卡鲁胺(20、40、80和160 μmol/L)刺激BT549细胞24 h后,CCK-8法检测比卡鲁胺刺激对BT549细胞增殖的影响。结果(图2A)显示,不同浓度比卡鲁胺可对BT549细胞的抑制率分别是(10.78±1.62)%、(25.25±1.53)%、(35.25±1.63)%和(51.81±1.06)%,与对照组相比,差异均有统计学意义(P值均<0.01)。计算显示,比卡鲁胺对的BT549细胞的IC50值为143.9 µmol/L,因此后续选择150 µmol/L为最适浓度进行实验。
进一步检测比卡鲁胺在不同时间点(24、48和72 h)对BT549细胞增殖的影响。CCK-8法检测结果(图2B)显示,比卡鲁胺(150 µmol/L)处理BT549细胞24、48和72 h后,比卡鲁胺组细胞的增殖能力均低于对照组细胞,差异具有统计学意义(P值均<0.01)。计算显示,24、48和72 h是比卡鲁胺(150 µmol/L)对BT549细胞的增殖抑制率分别为(38.02±1.86)%、(47.04±0.69)%和(56.67±0.75)%,这一结果提示比卡鲁胺对BT549细胞抑制作用可能与时间具有一定的相关性。
2.3AR拮抗剂比卡鲁胺可抑制BT549细胞中AR的表达
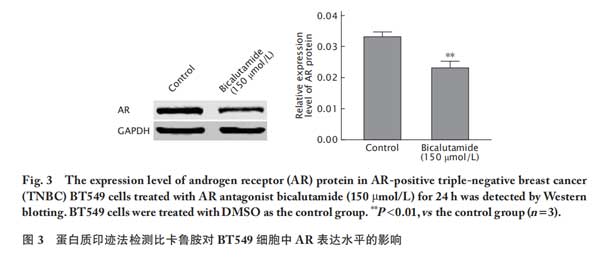
在TNBC型BT549 细胞中,加入比卡鲁胺(150 μmol/L)处理24 h后检测细胞中AR蛋白的表达水平。蛋白质印迹法检测结果(图3)显示,对照组和比卡鲁胺组BT549细胞中AR蛋白的表达量分别为0.33±0.01和0.23±0.01;与对照组相比,比卡鲁胺组BT549细胞中AR蛋白的表达量明显降低,差异具有统计学意义(P<0.01)。
2.4比卡鲁胺对 BT549 细胞凋亡和周期的影响
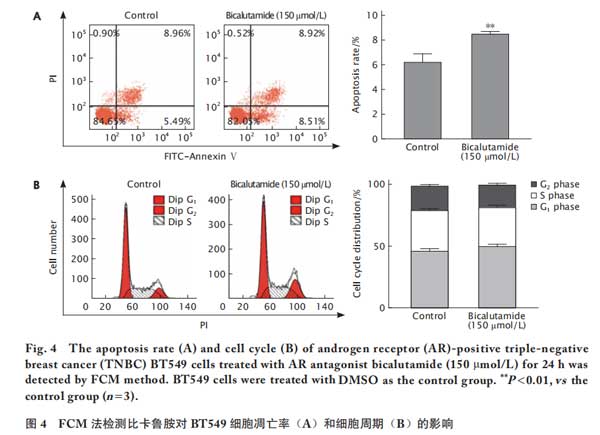
比卡鲁胺刺激BT549细胞24h后,采用FCM法检测比卡鲁胺对BT549细胞凋亡率的影响。结果(图4A)显示,对照组和比卡鲁胺组的凋亡率分别为(5.95±0.45)%和(8.51±0.19)%,与对照组相比,比卡鲁胺组的凋亡率明显提高(P<0.01)。
进一步采用FCM法检比卡鲁胺对BT549细胞周期的影响。结果(图4B)显示,对照组中G1期、S期和G2期细细胞所占的百分比分别为(46.34±1.68)%、(33.13±0.89)%和(19.56±0.74)%,比卡鲁胺组中G1期、S期和G2期细胞所占的百分比分别为(50.33±1.68)%、(31.46±1.54)%和(18.28±0.62)%;这一结果提示,比卡鲁胺对BT549细胞周期的影响不明显。
2.5比卡鲁胺抑制BT549细胞的迁移及侵袭能力
采用Transwell小室法检测比卡鲁胺(150μmol/L)对BT549细胞迁移和侵袭能力的影响。结果(图 5)显示,迁移实验中对照组穿过小室膜的细胞数为(180.5±8.5)个,比卡鲁胺组为(101.0±4.0)个,比卡鲁胺组细胞的迁移能力被明显抑制(P<0.001)。侵袭实验中对照组穿过小室膜的细胞数为(92.8±6.3)个,比卡鲁胺组为(59.5±3.5)个,比卡鲁胺组细胞的侵袭能力被明显抑制(P<0.01)。
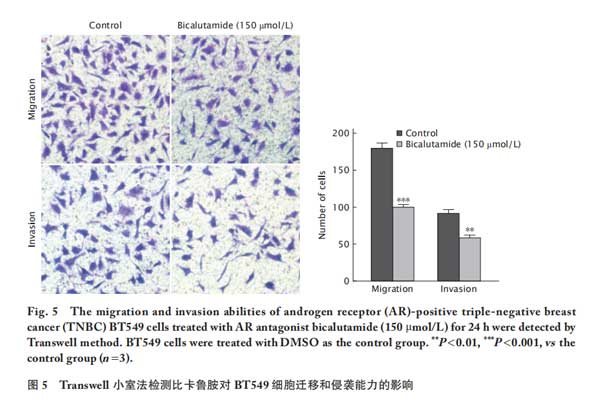
2.6蛋白质印迹法检测侵袭和增殖相关蛋白表达
为了进一步探讨比卡鲁胺刺激BT549细胞可能的分子作用机制,通过蛋白质印迹法检测侵袭增殖相关蛋白表达的水平。结果(图6)显示,对照组细胞中E-cadherin、PKC、MMP3、Vimentin、ERK1/2及其磷酸化蛋白p-ERK1/2的表达量分别为 0.49±0.05、1.24±0.08、0.13±0.01、0.68±0.05、0.48±0.04及0.40±0.01;比卡鲁胺组细胞中E-cadherin、PKC、MMP3、Vimentin、ERK1/2及其磷酸化蛋白p-ERK1/2的表达量分别为0.52±0.21、0.94±0.04、0.08±0.01、0.53±0.04、0.19±0.12及0.32±0.03;与对照组相比,E-cadherin的表达水平上调,而PKC、MMP3、Vimentin、ERK1/2和p-ERK1/2的表达水平均为下调(P值均<0.05)。
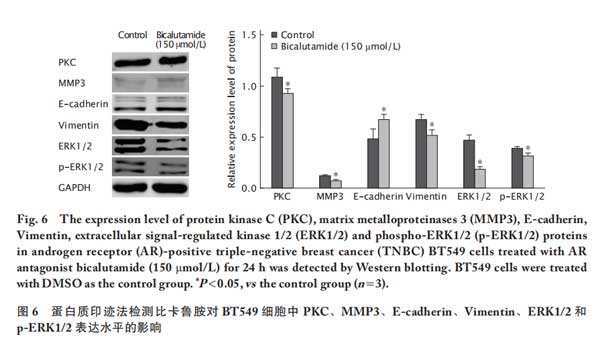
3、讨论
TNBC缺乏ER、PR和HER2表达,易早期转移,故手术治疗效果不佳,内分泌治疗无效,目前尚缺乏有效的治疗方案。化疗仍然是TNBC主要的治疗方法,如蒽环类药物单用或联合紫杉醇类药物等,但治疗效果并不理想,患者疾病复发率高[9-10]。本研究选取AR+TNBC细胞BT549作为研究对象,用比卡鲁胺进行干预,检测这种已用于前列腺癌治疗的AR拮抗剂对TNBC细胞生物学功能的影响,并探讨其分子机制。
本研究结果发现,比卡鲁胺对BT549细胞增殖有明显的抑制作用,且呈时间和浓度依赖性。进一步通过FCM法检测发现,比卡鲁胺能促进细胞早期凋亡,提示比卡鲁胺可能通过调节细胞的凋亡,抑制TNBC型BT549细胞的增殖。此外,ZHU等[11]评估了比卡鲁胺对乳腺癌细胞MDAMB-231和Hs578T的影响,发现比卡鲁胺可显著诱导MDA-MB-231和Hs578T细胞发生凋亡,进而抑制乳腺癌细胞的生长。另有研究也证实,比卡鲁胺作用于AR+和(或)ER-乳腺癌细胞,可显著抑制细胞增殖,诱导细胞凋亡[12]。
KAWAHARA等[13]报道,AR+膀胱癌疾病的进展受到AR信号的调控,AR拮抗剂(包括比卡鲁胺)能够阻断AR+膀胱癌细胞增殖和侵袭,有助于AR+膀胱癌的治疗。研究提示,比卡鲁胺通过下调前列腺癌细胞中与增殖和侵袭相关基因(细胞周期蛋白和表皮生长因子等)的表达,抑制前列腺癌细胞生长的活性,进而达到治疗前列腺癌的目的[14]。本研究中用比卡鲁胺处理AR+TNBC细胞后,通过CCK-8法和Transwell小室实验均得到相似的结果,比卡鲁胺能够明显降低TNBC型BT549细胞增殖、迁移与侵袭的能力。随后,本研究在检测了比卡鲁胺对BT549细胞生物学功能的基础上,进一步探讨了比卡鲁胺对BT549细胞增殖和侵袭作用涉及的分子机制。
PKC是一种丝/苏氨酸蛋白激酶,是细胞生物学功能的关键调节因子,在肿瘤细胞的增殖,分化和转移等过程中发挥作用[15]。有研究在肝癌中发现,PKC能通过调控丝裂原活化蛋白激酶(mitogen-activate protein kinase,MAPK)/ERK通路介导肿瘤细胞的增殖与转移,阻断肿瘤进展[16]。有研究在乳腺癌组织中发现,PKC表达在乳腺癌诊治中发挥重要作用,可作为判断其预后的重要参考指标[17-18]。ERK是一条经典的信号通路,参与了细胞的增殖和细胞分化等过程。有研究发现,紫杉醇能够通过激活抗凋亡的丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)/ERK信号转导途径抑制宫颈癌HeLa细胞的增殖,且ERK的表达量可作为紫杉醇诱导细胞凋亡的重要标志[19]。另有研究在非雄激素依赖性前列腺癌PC3和DU145细胞中发现,比卡鲁胺可以通过ERK1/2和信号转导及转录激活因子(signal transducer and activator of transcription,STAT)/JNK信号通路抑制细胞生长,且与姜黄素具有协同作用[20]。由此,本研究中进一步探讨了PKC能否在TNBC疾病进展中发挥作用。通过蛋白质印迹法检测结果提示,比卡鲁胺能抑制PKC、ERK1/2及其磷酸化蛋白的表达水平,这和上述研究报道结果一致。联系比卡鲁胺抑制细胞增殖的结果,由此提出在TNBC型BT549细胞中比卡鲁胺可能通过PKC调控MEK信号通路参与了细胞的增殖过程。
迁移和侵袭是肿瘤细胞恶性变的最重要的生物学特征,是肿瘤患者死亡的主要原因,同时也是临床治疗需要攻克的难点[21-22]。肿瘤转移的第一步是降解基底膜和细胞外基质,其中MMP发挥着重要作用,促进肿瘤细胞的侵袭与转移[23-24]。MMP3是MMP家族的重要成员之一,在多种恶性肿瘤中均有表达,可作为TNBC疾病进展的判断指标[25-26]。已有研究表明,乳腺癌细胞可通过上皮-间质转化(epithelial-mesenchymal transitions,EMT)调控细胞的增殖,迁移和侵袭等生物学功能,促进肿瘤的进展[27-28],E-cadherin和Vimentin都是EMT过程中主要的标志物[29-30]。有研究报告,在TNBC型MDA-MB-231细胞中负调控PKC的表达可抑制EMT进程[31]。另有研究进一步在MDA-MB-231细胞中发现,锌指转录因子(zinc-finger E-box binding protein 1,ZEB1)和AR间的相互影响可介导EMT过程,促进TNBC发展;进一步采用AR拮抗剂比卡鲁胺处理细胞,发现比卡鲁胺可通过抑制ZEB1表达而阻断肿瘤细胞的侵袭能力[32]。与其他研究结果一致,通过蛋白质印迹法检测发现比卡鲁胺可以上调E-cadherin表达水平,降低Vimentin、PKC和MMP3的表达水平。由此提示,比卡鲁胺可能通过PK抑制EMT信号通路,即通过调控PKC-EMT过程抑制细胞侵袭运动。
综上所述,在TNBC型BT549细胞中AR拮抗剂比卡鲁胺能明显降低细胞增殖侵袭能力,且这种抗增殖侵袭的机制可能通过PKC这一关键分子通过ERK和EMT而发挥作用。当然比卡鲁胺如何通过PKC 在 BT549 细胞中发挥抗肿瘤的具体机制仍有待进一步研究,但是比卡鲁胺作为TNBC的一个潜在的治疗药物具有一定的临床意义,值得进一步在临床上予以验证。
参考文献
[1]SIEGEL RL,MILLER KD,JEMAL A.Cancer statistics[J].CA Cancer J Clin,2017,67(1):7-30.
[2]ZEICHNER SB,TERAWAKI H,GOGINENI K.A review of systemic treatment in metastatic triple-negative breast cancer[J].Breast Cancer(Auckl),2016,10:25-36.
[3]COLLIGNON J,LOUSBERG L,SCHROEDER H,et al.Triple-negative breast cancer:treatment challenges and solutions[J].Breast Cancer (Dove Med Press),2016,8:93-107.
[4]COLLINS LC,COLE KS,MAROTTI JD,et al.Androgen receptor expression in breast cancer in relation to molecular phenotype:results from the Nurses' Health Study[J].Mod Pathol,2011,24(7):924-931.
[5]AKAZA H,HINOTSU S,USAMI M,et al.Combined androgen blockade with bicalutamide for advanced prostate cancer:Long-term follow-up of a phase 3,doubleblind,randomized study for survival[J].Cancer,2009,115(15):3437-3445.
[6]TRAN C,OUK S,CLEGG NJ,et al.Development of a second-generation antiandrogen for treatment of advanced prostate cancer[J].Science,2009,324(5928):787-790.
[7]GUCALP A,TOLANEY S,ISAKOFF SJ,et al.Phase Ⅱ trial of bicalutamide in patients with androgen receptor-positive,estrogen receptor-negative metastatic breast cancer[J].Clin Cancer Res,2013,19(19):5505-5512.
[8]TRAINA TA,MILLER K,YARDLEY DA,et al.Enzalutamide for the treatment of androgen receptor-expressing triple-negative breast cancer[J].J Clin Oncol,2018,36(9):884-890.
[9]LEHMANN BD,BAUER JA,CHEN X,et al.Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies[J].J Clin Invest,2011,121(7):2750-2767.
[10]ANESTIS A,KARAMOUZIS MV,DALAGIORGOU G,et al.Is androgen receptor targeting an emerging treatment strategy for triple negative breast cancer?[J].Cancer Treat Rev,2015,41(6):547-553.
[11]ZHU A,LI Y,SONG W,et al.Antiproliferative effect of androgen receptor inhibition in mesenchymal stem-like triple-negative breast cancer[J].Cell Physiol Biochem,2016,38(3):1003-1014.
[12]HUANG R,HAN J,LIANG X,et al.Androgen receptor expression and bicalutamide antagonize androgen receptor inhibit β-catenin transcription complex in estrogen receptor-negative breast cancer[J].Cell Physiol Biochem,2017,43(6):2212-2225.
[13]KAWAHARA T,IDE H,KASHIWAGI E,et al.Enzalutamide inhibits androgen receptorpositive bladder cancer cell growth[J].Urol Oncol,2016,34(10):432.e15–432.e4.32E23.
[14]MANGERINI R,ARGELLATI F,PFEFFER U,et al.Effects of bicalutamide and 4OH-tamoxifen on androgen-regulated gene expression in the LNCaP cell line[J].Anticancer Res,2012,32(12):5323-5329.
[15]KIKKAWA U,KISHIMOTO A,NISHIZUKA Y.The protein kinase C family:Heterogeneity and its implications[J].Annu Rev Biochem,1989,58:31-44.
[16]HU CT,CHENG CC,WU JR,et al.PKCε-mediated c-Met endosomal processing directs fluctuant c-Met-JNK-paxillin signaling for tumor progression of HepG2[J].Cell Signal,2015,27(7):1544-1555.
[17]SHAO WF,LI FX,TANG R,et al.Nanog promotes the invasion of breast cancer cells by increasing PKC epsilon expression[J].Nan Fang Yi Ke Da Xue Xue Bao,2016,36(5):639-644.
[18]JAIN K,BASU A.Protein kinase C-ε promotes EMT in breast cancer[J].Breast Cancer (Auckl),2014,8:61-67.
[19]MCDAID HM,HORWITZ SB.Selective potentiation of paclitaxel (taxol)-induced cell death by mitogen-activated protein kinase kinase inhibition in human cancer cell lines[J].Mol Pharmacol,2001,60(2):290-301.
[20]LI J,XIANG S,ZHANG Q,et al.Combination of curcumin and bicalutamide enhanced the growth inhibition of androgen-independent prostate cancer cells through SAPK/JNK and MEK/ERK1/2-mediated targeting NF-κB/p65 and MUC1-C[J].J Exp Clin Cancer Res,2015,34(1):46.
[21]JACQUEMET G,HAMIDI H,IVASKA J.Filopodia in cell adhesion,3D migration and cancer cell invasion[J].Curr Opin Cell Biol,2015,36:23-31.
[22]NOEL A,GILLES C,FOIDART JM.Invasion and metastatic dissemination in breast cancer:Mechanisms[J].Rev Med Liege,2011,66(5-6):274-278.
[23]CHABOTTAUX V,NOEL A.Breast cancer progression:Insights into multifaceted matrix metalloproteinases[J].Clin Exp Metastasis,2007,24(8):647-656.
[24]HIDALGO M,ECKHARDT SG.Development of matrix metalloproteinase inhibitors in cancer therapy[J].J Natl Cancer Inst,2001,93(3):178-193.
[25]苏书娟,邢鲁奇,陈登庭.MMP-3在乳腺导管癌中的表达及临床意义[J].现代肿瘤学杂志,2011,19(2):274-276.
[26]FOLGUERAS AR,PENDÁS AM,SÁNCHEZ LM,et al.Matrix metalloproteinases in cancer:From new functions to improved inhibition strategies[J].Int J Dev Biol,2004,48(5-6):411-424.
[27]KULBE H,THOMPSON R,WILSON JL,et al.The inflammatory cytokine tumor necrosis factoralpha generates an autocrine tumor-promoting network in epithelial ovarian cancer cells[J].Cancer Res,2007,67(2):585-592.
[28]WU Y,ZHOU BP.TNF-alpha/NF-kappaB/Snail pathway in cancer cell migration and invasion[J].Br J Cancer,2010,102(4):639-644.
[29]PIETERS T,VAN ROY F.Role of cell-cell adhesion complexes in embryonic stem cell biology[J].J Cell Sci,2014,127(Pt 12):2603-2613.
[30]VU T,DATTA PK.Regulation of EMT in colorectal cancer:A culprit in metastasis[J].Cancers (Basel),2017,9(12):171.
[31]HOU J,WANG Z,XU H,et al.Stanniocalicin 2 suppresses breast cancer cell migration and invasion via the PKC/claudin-1-mediated signaling[J].PLoS One,2015,10(4):e0122179.
[32]GRAHAM TR,YACOUB R,TALIAFERROSMITH L,et al.Reciprocal regulation of ZEB1 and AR in triple negative breast cancer cells[J].Breast Cancer Res Treat,2010,123(1):139-147.
(肿瘤 TUMOR Vol.40,September 2020)
