发布时间:2021年08月06日 08:45:09 来源:振东健康网
杨颖1,赵伟2,吕丹3
(1.北京大学人民医院输血科,北京 100044;
2. 中日友好医院检验科,北京 100029;
3.北京大学医学部系统生物医学研究所,北京 100191)
【摘要】目的:探讨19号染色体开放读码框12(C19ORF12)对胃癌MKN45细胞增殖和化疗药物敏感性的影响,并阐明其作用机制。方法:将胃癌MKN45细胞分为对照组和C19ORF12组。CCK-8法检测2组胃癌MKN45细胞的增殖活性,克隆形成实验检测2组胃癌MKN45细胞克隆形成数,CCK-8法检测加入化疗药物阿霉素或过氧化氢(H2O2)后2各组胃癌MKN45细胞存活率,流式细胞术检测2组胃癌MKN45细胞凋亡率,激光共聚焦显微镜技术检测C19ORF12在胃癌MKN45细胞中的亚细胞定位,GEPIA分析癌症基因组图谱(TCGA)中C19ORF12mRNA在正常胃组织和胃癌组织中的表达差异,KM-plot回顾性分析不同表达水平C19ORF12对胃癌患者预后的影响。结果:与对照组比较,C19ORF12组胃癌MKN45细胞增殖活性明显升高(P<0.05),克隆形成数升高(P<0.01)。阿霉素或H2O2作用后,与对照组比较,C19ORF12组胃癌MKN45细胞存活率升高(P<0.05或P<0.01),细胞凋亡率降低(P<0.01)。激光共聚焦显微镜下,C19ORF12主要定位于胃癌MKN45细胞的线粒体中。与正常胃组织比较,胃癌组织中C19ORF12mRNA表达水平明显升高(P<0.01)。与低表达C19ORF12的胃癌患者比较,高表达C19ORF12的胃癌患者总体生存期明显缩短(P<0.01)。结论:C19ORF12能够促进胃癌细胞的增殖,并且降低胃癌细胞对化疗药物的敏感性。C19ORF12可以作为肿瘤治疗的潜在靶标。
【关键词】C19ORF12;胃肿瘤;细胞增殖;阿霉素;化疗药敏感性;活性氧
[中图分类号] R735.2 [文献标志码] A
Effect of C19ORF12 on proliferation and chemo-sensitivity of gastric cancer MKN45 cells and its mechanism
YANG Ying1,ZHAO Wei2,LYU Dan3
(1.Department of Blood Transfusion,Peking University People’s Hospital,Beijing 100044,China;
2.Department of Clinical Laboratory,China-Japan Friendship Hospital,Beijing 100029,China;
3.Institute of Systems Biomedicine,School of Basic Medical Sciences,Peking University,
Beijing 100191,China)
【ABSTRACT】Objective:To discuss the effect of C19ORF12 on the proliferation and chemo-sensitivity o-f the gastric cancer MKN45 cells,and to clarify its mechanism. Methods:The gastric cancer MKN45 cells were divided into control group and C19ORF12 group.The proliferation activities of the gastric cancer MKN45 cells in two groups were detected by CCK-8 method;the number of colony formation of the ga-stric cancer MKN45 cells in two groups was detected by colony formation assay;the survival rates of the gastric cancer MKN45 cells after treated with chemotherapeutic drugs doxorubicin or hydrogen peroxide(H2O2)in two groups were detected by CCK-8 method;the apoptotic rates of the gastric cancer MKN45 c-ells in two groups were detected by flow cytometry;the subcellular localization of C19ORF12 in the gas-tric cancer MKN45 cells was detected by laser confocal microscope.The expression difference of C19ORF12 gene in Cancer Genome Atlas(TCGA)between normal gastric and gastric cancer tissues was analyzed by GEPIA.The effect of different expression level of C19ORF12 on the prognosis of gastric cancer pati-ents was retrospectively analyzed by KM-plot.Results:Compared with control group,the proliferation activi-ty and the number of colone formation of the gastric cancer MKN45 cells in C19ORF12 group were s-ignificantly increased(P<0.01).Compared with control group,the survival rate of gastric cancer MKN45 ce-lls in C19ORF12 group after treated with doxorubicin or H2O2 were increased(P<0.05 or P<0.01),and the apoptotic rates were decreased(P<0.01).The C19ORF12 was mainly expressed in the mitochondrion.The b-ioinformatics analysis results showed that compared with normal gastric tissue,the level of C19ORF12 m-RNA in gastric cancer tissue was increased(P<0.01).Compared with the patients with low expression of C-19ORF12,the overall survival time of gastric cancer patients with high expression of C19ORF12 was si-gnificantly decreased(P<0.01).Conclusion:C19ORF12 can promote the proliferation of gastric cancer cells and reduce the sensitivity of gastric cancer cells to chemotherapeutic drugs.C19ORF12 can be used as a potential target for tumor therapy.
【KEYWORDS】chromosome 19 open reading frame 12;gastric neoplasm;cell proliferation;doxorubicin;che-mo-sensitivity;reactive oxygen species
胃癌是我国常见的恶性肿瘤之一[1]。胃癌的治疗主要包括手术疗法、化学疗法、靶向疗法和免疫疗法等[2-3]。肿瘤的化学疗法和靶向疗法的耐药性是肿瘤治疗的难点[4-5]。最近的研究[6-7]表明:无论是在化学疗法中,还是在CD8阳性T淋巴细胞介导的免疫疗法中,活性氧(reactive oxygen species,ROS)介导的细胞毒性发挥了重要的作用,其可以激活肿瘤细胞内在的死亡途径,从而达到抗肿瘤的作用。研究[8]显示:药物诱导的细胞死亡会激发宿主的免疫反应,进而增强肿瘤化学疗法的有效性。在肿瘤发生发展的过程中,某些基因的上调或者下调可以导致肿瘤对化疗药物的敏感性改变,进而影响该药物的抗肿瘤效果[9]。染色质获得或缺失是基因组不稳定的主要表现形式,常见于多种人类肿瘤[10-11]。19号染色体开放读码框12(chromosome 19 open reading frame 12,C19ORF12)基因位于19号染色体长臂1区2带(19q12)。19q12扩增子区域包括很多基因,19q12区域这些基因与肿瘤的发生发展密切相关[12-13]。研究[14-16]显示:在妇科肿瘤中,19q12区域基因的扩增与肿瘤的进展密切相关,为妇科肿瘤的治疗提供了新的研究方向。研究[17]显示:在胃癌组织中可以检测到19q12区域的扩增。然而19q12区域的基因在胃癌发生发展中的作用及其机制尚不清楚。C19ORF12基因编码小分子跨膜蛋白,但是其功能尚不清楚。本研究探讨C19ORF12在胃癌发生发展中的作用,阐述C19ORF12对胃癌MKN45细胞增殖和化疗药物敏感性的影响及其可能机制,为胃癌的治疗提供新的靶点。
1、材料与方法
1.1 细胞、主要试剂和仪器 人胃癌MKN45细胞购于上海中科院细胞库。DMEM培养基、胎牛血清(fetal bovine serum,FBS)和胰蛋白酶购于美国Gibco公司,细胞培养箱购于美国Thermo公司,碘化丙啶(propidium iodide,PI)、阿霉素和过氧化氢(H2O2)购于美国Sigma公司,CCK-8试剂盒购于日本Dojindo公司,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)、线粒体红色荧光探针(MitoTracker Red CMXRos)和Lipofectamine 2000试剂盒购于美国Invitrogen公司。流式细胞仪购于美国BD公司,酶标仪购于美国Bio-Rad公司,激光共聚焦显微镜购于日本Nikon公司。
1.2 细胞培养 人胃癌MKN45细胞置于含10%FBS的DMEM培养基中,采用CO2孵箱于37℃和5%CO2条件下培养细胞。待培养瓶中的细胞达到80%以上融合时,采用0.25%胰蛋白酶对细胞进行消化处理,并进行传代培养。
1.3 细胞转染和分组 选取处于对数生长期的胃癌MKN45细胞,采用0.25%胰蛋白酶进行消化处理后接种于24孔板中。实验分为对照组和C19ORF12 组。待细胞融合至80%左右时,采用Lipofectamine 2000转染试剂将对照组质粒和C19ORF12-Flag质粒分别转染至MKN45细胞中。转染步骤参照Lipofectamine 2000转染试剂说明书进行。
1.4 CCK-8 法检测2组胃癌MKN45细胞的增殖活性 将对照组细胞和C19ORF12组细胞以3×103个/孔的密度接种于96孔板。将各组细胞分别培养24、48、72和96h。在每个检测时间点,每孔加入10μL CCK-8和90μL DMEM培养基,孵育2h。采用酶标仪检测450nm波长处的吸光度(A)值。设置3个平行孔,取平均值。以A值代表细胞增殖活性。采用GraphPad Prism6.0软件绘制各组细胞的增殖曲线。
1.5 克隆形成实验检测2组胃癌MKN45细胞克隆形成数 将对照组细胞和C19ORF12组细胞以1×103个/孔的密度接种于6孔板。每组设置3个平行孔。培养14d后,弃去培养基,PBS清洗细胞3次,加入4%多聚甲醛固定30min,加入结晶紫染液静置20min,PBS清洗细胞3次,自然干燥后,置于显微镜下拍照并计数每组细胞的克隆形成数。
1.6 CCK-8法检测2组胃癌MKN45细胞的存活率 将对照组细胞 和C19ORF12组细胞以5×103个/孔的密度接种于96孔板。待细胞贴壁之后,分别加入不同浓度(1、2、4、8和16mg·L-1)阿霉素或不同浓度(100、200、400、800和1600μmol·L-1)H2O2。加药后37℃培养24h。随后每孔加入10μL CCK-8和90μL DMEM培养基,孵育2h。采用酶标仪检测450nm波长处的A值。设置3个平行孔,取平均值,计算细胞存活率。细胞存活率=药物处理后细胞A值/未加药细胞A值×100%,未加药细胞的存活率设定为100%。
1.7 流式细胞术检测2组胃癌MKN45细胞凋亡率 对照组细胞和C19ORF12组细胞贴壁生长于6孔板中,各组细胞培养基中加入16mg·L-1阿霉素或1600μmol·L-1H2O2。药物处理24h之后,收集细胞于流式管中,采用预冷的PBS洗涤细胞2次,离心弃去上清。每管细胞加入1mL乙醇固定液,4℃固定过夜。随后再采用预冷的PBS洗涤细胞2次,离心弃去上清。每管加入500μL PI染液,室温避光孵育20 min。流式细胞术检测各组细胞凋亡率。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.8 激光共聚焦显微镜检测亚细胞定位 将泡酸、高压消毒后的盖玻片置入6孔板中,胃癌MKN45细胞以2×105/孔的浓度铺于6孔板中,细胞贴壁24h后进行细胞转染,转染方法同"1.3"步骤。对照组细胞转染 pEGFP-N1质粒,C19ORF12组细胞转染pEGFP-N1-C19ORF12质粒。转染24h后,PBS洗涤细胞,采用4%多聚甲醛固定细胞15min,洗涤细胞后,每孔加入含0.1% Triton X-100的PBS,孵育3min。洗涤细胞后,每孔加入MitoTracker Red CMXRos和DAPI,对线粒体和细胞核进行染色。载玻片上滴加1滴封片剂(10%PBS+90%甘油),将6孔板中的盖玻片取出,细胞面朝下覆盖于载玻片上。激光共聚焦显微镜下观察细胞并采集图像。
1.9 生物信息学分析 通过检索癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,下载胃癌患者的胃组织和正常胃组织的转录组数据以及相应的临床信息文件。通过GEPIA(网址为http://gepia.cancer-pku.cn/)分析C19ORF12 mRNA在胃癌和正常胃组织中表达水平的差异。通过KM-plot(网址为http://www.kmplot.com/)回顾性分析不同表达水平的C19ORF12对胃癌患者预后的影响。
1.10 统计学分析 采用GraphPad Prism 6.0统计软件进行统计学分析。各组细胞增殖活性、克隆形成数和细胞凋亡率均以±s表示,多组间样本均数比较采用单因素方差分析,两组间样本均数比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2、结果
2.1 2组胃癌MKN45细胞的增殖活性 与对照组比较,C19ORF12组胃癌MKN45细胞的增殖活性明显升高(P<0.05)。见图1。
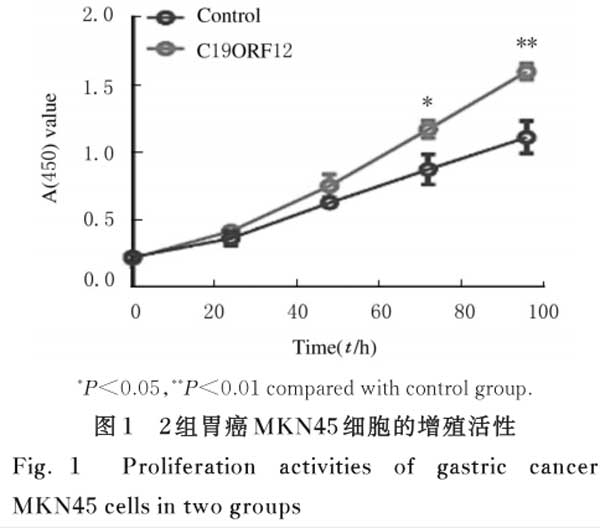
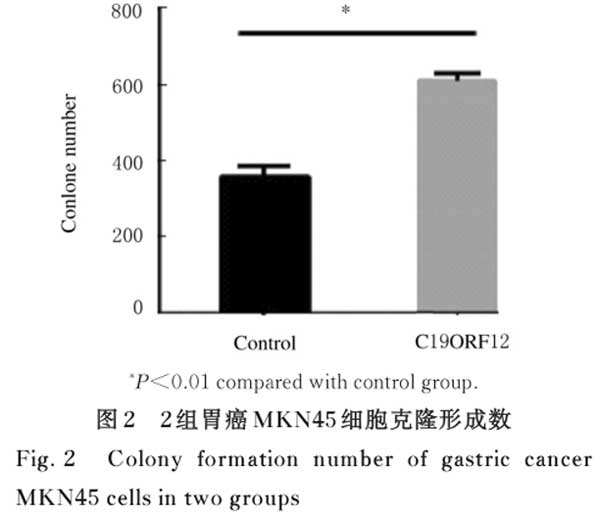
2.2 2组胃癌MKN45细胞克隆形成数 与对照组比较,C19ORF12组胃癌MKN45细胞克隆形成数明显增多(P<0.01)。见图2。
2.3 阿霉素作用后2组胃癌MKN45细胞存活率 4、8和16mg•L-1阿霉素作用后,与对照组比较,C19ORF12组胃癌MKN45细胞存活率升高(P<0.01),即C19ORF12能够降低胃癌MKN45细胞对阿霉素的敏感性,并且随着阿霉素剂量的增加,这种差异逐渐增大。见图3。

2.4 H2O2作用后2组胃癌MKN45细胞存活率 与对照组比较,400、800和1600μmol·L-1 H2O2作用后,C19ORF12组胃癌MKN45细胞存活率升高(P<0.05)。并且随着H2O2剂量的增加这种差异逐渐增大。即C19ORF12以剂量依赖的方式抑制了ROS介导的细胞死亡。见图4。

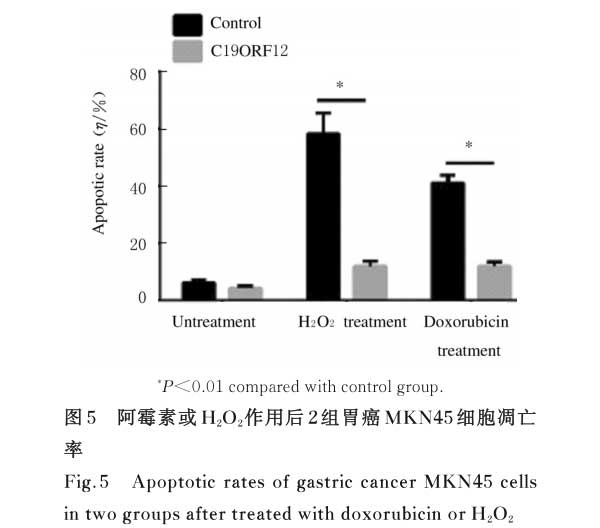
2.5 2组胃癌MKN45细胞凋亡率 阿霉素或者H2O2作用后,与对照组比较,C19ORF12组胃癌MKN45细胞凋亡率明显降低(P<0.01)。即C19ORF12可以抑制ROS介导的细胞死亡。见图5。
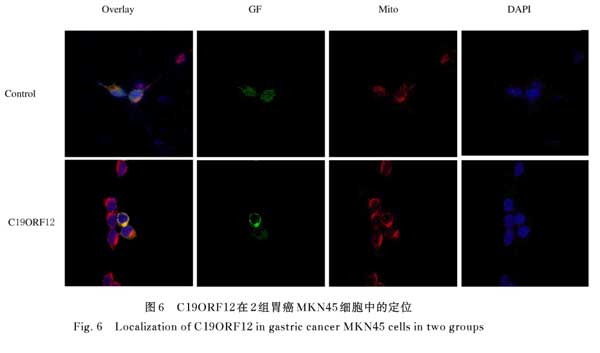
2.6 C19ORF12在胃癌MKN45细胞中的亚细胞定位 激光共聚焦显微镜结果显示:C19ORF12主要表达于胃癌MKN45细胞的线粒体中。见图6。
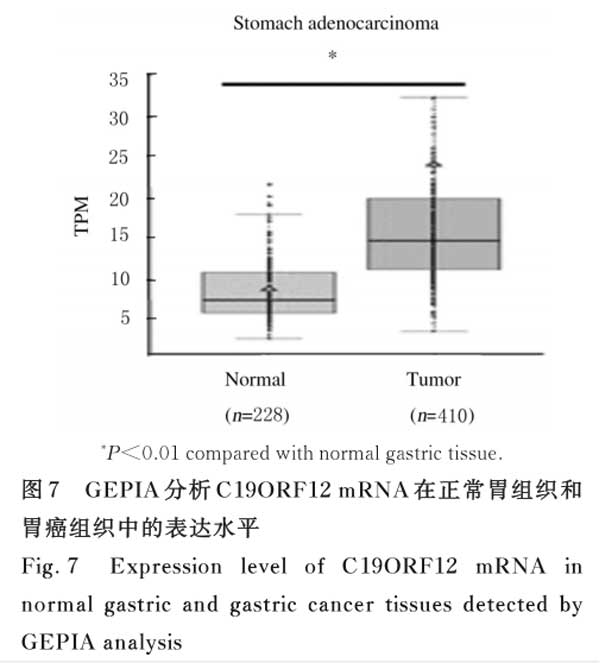
2.7 胃癌组织和正常胃组织中C19ORF12 mRNA表达水平GEPIA分析结果显示:与正常胃组织(228例)比较,胃癌组织(410例)中C19ORF12 mRNA表达水平明显升高(P<0.01)。见图7。
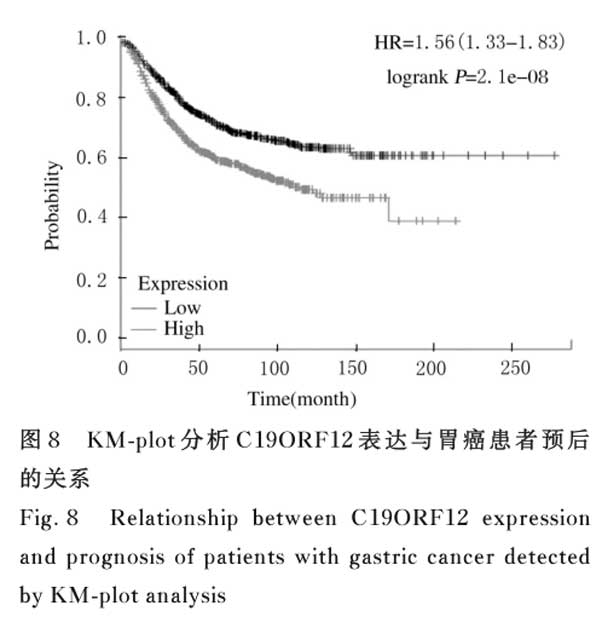
2.8 C19ORF12表达与胃癌预后的关系 KM-plot生存分析结果显示:C19ORF12的差异表达明显影响胃癌患者的预后。与低表达C19ORF12的胃癌患者比较,高表达C19ORF12的胃癌患者总体生存期明显缩短(P<0.01),提示C19ORF12的高表达与胃癌的不良预后相关。见图8。
3、讨论
C19ORF12基因位于19号染色体长臂1区2带,该基因编码小分子的跨膜蛋白。C19ORF12基因及其编码产物在肿瘤中的作用和作用机制并不清楚。本研究明确了C19ORF12是一个癌基因,其在胃癌组织中表达上调。C19ORF12不仅能够促进胃癌MKN45细胞的增殖,而且能够降低胃癌MKN45细胞对化疗药物阿霉素的敏感性,C19ORF12与胃癌患者的不良预后高度相关。C19ORF12可以作为增强肿瘤化疗药物敏感性的潜在靶标。
化疗药物的抗药性严重影响肿瘤的治疗效果[18]。因此,阐明化疗药物的耐药机制对于肿瘤的临床治疗至关重要[4]。作为最广泛使用的抗肿瘤药物之一,阿霉素可诱导过量的ROS生成,从而导致肿瘤细胞的凋亡或非凋亡细胞死亡[19-20]。研究[21]显示:大剂量阿霉素可以诱导线粒体中铁蓄积,这表明细胞铁死亡可能与阿霉素诱导的细胞死亡有关。与细胞凋亡不同,细胞铁死亡可以引起炎症损伤并增强对肿瘤细胞的免疫攻击[22]。H2O2可以模拟体内过量ROS产生这一过程,因此,本研究中采用H2O2来模拟诱导ROS介导的细胞死亡。本研究结果显示:C19ORF12能够抑制ROS介导的细胞死亡并增强胃癌细胞对阿霉素的抗药性。
线粒体在能量代谢、细胞凋亡调节和细胞信号传导等方面发挥重要的作用[23]。肿瘤细胞的线粒体与正常细胞的线粒体在结构和功能上均存在差异。肿瘤细胞中的线粒体能够产生过量的ROS,ROS通过诱导基因组不稳定性、修饰基因的表达以及参与信号传导等途径促进肿瘤的发展[24-26]。当线粒体接收到刺激信号后,线粒体膜的通透性增加,线粒体中的活性分子会进入胞质,通过一系列级联反应诱导细胞凋亡[27-28]。亚细胞定位结果显示:C19ORF12主要表达于胃癌MKN45细胞的线粒体中。同时C19ORF12能够抑制ROS介导的细胞死亡,C19ORF12很有可能在线粒体的功能调控中发挥一定的作用。C19ORF12能够为肿瘤治疗提供新的思路。
综上所述,本研究明确了C19ORF12在胃癌发生发展中的作用。C19ORF12能够促进胃癌细胞的增殖,并减弱化疗引起的氧化损伤,降低胃癌细胞对化疗药物的敏感性,最终促进胃癌的发展并导致不良预后。
参考文献
[1]SUN D Q,LI H,CAO M M,et al. Cancer burden in China:trends,risk factors and prevention[J].Cancer Biol Med,2020,17(4):879-895.
[2]SMYTH E,NILSSON M,GRABSCH H,et al.Gastric cancer[J].Lancet,2020,396(10251):635-648.
[3]ZHAO Q F,CAO L,GUAN L L,et al.Immunotherapy for gastric cancer: dilemmas andprospect [J].Brief Funct Genomics,2019,18(2):107-112.
[4]POKHRIYAL R,HARIPRASAD R,KUMAR L,et al.Chemotherapy resistance in advanced ovarian cancer patients[J].Biomark Cancer,2019,11:1179299X19860815.
[5]O’DONNELL J S,TENG M W L,SMYTH M J.Cancer immunoediting and resistance to T cell-based immunotherapy[J].Nat Rev Clin Oncol,2019,16(3):151-167.
[6]PILCO-FERRETO N,CALAF G M.Influence of doxorubicin on apoptosis and oxidative stress in breast cancer cell lines[J].Int J Oncol,2016,49(2):753-762.
[7]WANG W ,GREEN M ,CHOI J E ,et al.CD8+ T cells regulate tumour ferroptosis during cancer im-munotherapy[J].Nature,2019,569(7755):270-274.
[8]KANG T H,MAO C P,KIM Y S,et al.TLR9 acts as a sensor for tumor-released DNA to modulate anti-tumor immunity after chemotherapy[J].J Immunother Cancer,2019,7(1):260.
[9]LI Z J,ZHANG Y,WANG R N,et al.Genetic alterations in anaplastic thyroid carcinoma and targeted therapies[J].Exp Ther Med,2019,18(4):2369-2377.
[10]SMID M, HOES M,SIEUWERTS A M,et al.Patterns and incidence of chromosomal instability and their prognostic relevance in breast cancer subtypes[J].Breast Cancer Res Treat,2011,128(1):23-30.
[11]MCGRANAHAN N,BURRELL R A,ENDESFELDER D,et al.Cancer chromosomal instability:therapeutic and diagnostic challenges[J].EMBO Rep,2012,13(6):528-538.
[12]NOSKE A,HENRICKSEN L A,LAFLEUR B,et al.Characterization of the 19q12 amplification including CCNE1 and URI in different epithelial ovarian cancer subtypes[J].Exp Mol Pathol,2015,98(1):47-54.
[13]NATRAJAN R,MACKAY A,WILKERSON P M,et al.Functional characterization of the 19q12 amplicon in grade Ⅲ breast cancers[J].Breast Cancer Res,2012,14(2):R53.
[14]ETEMADMOGHADAM D,WEIR B A,AU-YEUNG G,et al.Synthetic lethality between CCNE1 ampl-ification and loss of BRCA1[J].Proc Natl Acad Sci USA,2013,110(48):19489-19494.
[15]THEURILLAT J P,METZLER S C,HENZI N,et al.URI is an oncogene amplified in ovarian cancer cells and is required for their survival[J].Cancer Cell,2011,19(3):317-332.
[16]ETEMADMOGHADAM D,GEORGE J,COWIN P A,et al.Amplicon-dependent CCNE1 expression is critical for clonogenic survival after cisplatin treatment and is correlated with 20q11 gain in ovarian cancer[J].PLoS One,2010,5(11):e15498.
[17]LEUNG S Y,HO C,TU I P,et al.Comprehensive analysis of 19q12 amplicon in human gastric cancers[J].Mod Pathol,2006,19(6):854-863.
[18]CHATTERJEE N,BIVONA T G.Polytherapy and targeted cancer drug resistance[J].Trends Cancer,2019,5(3):170-182.
[19]BINASCHI M,BIGIONI M,CIPOLLONE A,et al.Anthracyclines: selected new developments[J].Curr Med Chem Anticancer Agents,2001,1(2):113-130.
[20]CHEN C,LU L,YAN S C,et al.Autophagy and doxorubicin resistance in cancer[J].Anticancer Drugs,2018,29(1):1-9.
[21]ICHIKAWA Y,GHANEFAR M,BAYEVA M,et al.Cardiotoxicity of doxorubicin is mediated through m-itochondrial iron accumulation[J].J Clin Invest,2014,124(2):617-630.
[22]QI J,KIM J W,ZHOU Z X,et al.Ferroptosis affects the progression of nonalcoholic steatohepatitis via the modulation of lipid peroxidation-mediated cell death in mice[J].Am J Pathol,2020,190(1):68-81.
[23]BANO D,PREHN J H M.Apoptosis-inducing factor (AIF)in physiology and disease:the tale of a repented natural born killer [J].EBioMedicine,2018,30:29-37.
[24]VYAS S,ZAGANJOR E,HAIGIS M C.Mitochondria and cancer[J].Cell,2016,166(3):555-566.
[25]DICKERSON T,JAUREGUI C E,TENG Y.Friend or foe?Mitochondria as a pharmacological target in cancer treatment[J].Future Med Chem,2017,9(18):2197-2210.
[26]YANG Y H,KARAKHANOVA S,HARTWIG W,et al.Mitochondria and mitochondrial ROS in cancer:novel targets for anticancer therapy[J].J Cell Physiol,2016,231(12):2570-2581.
[27]KOLTHUR-SEETHARAM U,DANTZER F,MCBURNEY M W,et al.Control of AIF-mediated cell death by the functional interplay of SIRT1 and PARP-1 in response to DNA damage[J].Cell Cycle,2006,5(8):873-877.
[28]YUSTE V J,MOUBARAK R S,DELETTRE C,et al.Cysteine protease inhibition prevents mitochondrial apoptosis-inducing factor(AIF)release[J].Cell Death Differ,2005,12(11):1445-1448.
[吉林大学学报(医学版) 第47卷第3期 2021年5月]
