发布时间:2020年03月26日 08:44:28 来源:振东健康网
于海静、连臻强
(广东省妇幼保健院乳腺病中心,广州511400)
【摘 要】目的:探讨早期乳腺癌和乳腺良性疾病的乳管灌洗液细胞学涂片检查与RASSF1A基因甲基化检测敏感性及特异性的差异以及后者在早期乳腺癌中的诊断意义。方法:回顾性分析以乳头溢液为表现的已接受手术治疗的乳腺良或恶性肿瘤患者40例,术前均行乳管灌洗液细胞学涂片检查,并运用甲基化特异性PCR方法对40例患者的乳管灌洗液标本进行RASSF1A基因甲基化的检测,分析对比两种检查方法的差异。结果:乳管灌洗液的细胞学涂片检查对早期乳腺癌诊断的敏感性为24%,特异性为93.3%。RASSF1A甲基化诊断早期乳腺癌敏感性为80%,特异性为80%。相比细胞学检查RASSF1A甲基化检测对以病理性乳头溢液为表现的乳腺癌敏感性和特异性均较高,差异有统计学意义(P<0.05)。结论:应用甲基化荧光定量PCR检测乳管灌洗液标本RASSF1A的甲基化可作为早期乳腺癌的术前诊断参考依据。
【关键词】乳腺癌;乳腺良性病变;RASSFIA基因;甲基化
[中图分类号]R737.9[文献标识码]A[文章编号]1000-9760(2019)10-305-05
The clinical significance of methylation of RASSF1A gene in the diagnosis of early breast cancer
YU Haijing,LIAN ZhenQiang
(Breast Disease Center,Guangdong Women and Children's Hospital,Guangzhou 511400,China)
【Abstract】Objective:To investigate the difference between cytological smear of breast duct lavage fluid and methylation of RASSF1A gene in early breast cancer and benign breast disease.Methods:The sensitivity and specificity of preoperative cytological smear examination of breast duct lavage fluid in 40 patients with benign or malignant breast tumors with nipple discharge were retrospectively analyzed.Simultaneously,the methylation specific PCR method was used to analysis RASSF1A gene methylation in 40 cases of patients with breast duct lavage fluid.And then we analyzed the differences of two detection methods.Results:The sensitivity and specificity of cytological smear of the fluid were 24% and 93.3%,respectively.Methylation of RASSF1A accounted for 80% of early breast cancer tissue,20% of benign breast disease.The diagnostic sensitivity and specificity were both 80%.Methylation of RASSF1A was more sensitive and specific to breast cancer with pathological nipple discharge than cytology.The difference between methylation of RASSF1A gene and cytological diagnosis of pathological nipple discharge was statistically significant(P<0.05).Conclusion:The detection of methylation of RASSF1A gene by quantitative PCR could be used as a reference basis of preoperative diagnosis for early breast cancer.
【Key words】 Early Breast cancer;Benign breast lesions;RASSFIA gene;Methylation
乳腺癌是女性最常见的恶性肿瘤之一,也是导致女性癌症死亡的主要原因[1]。乳头溢液为早期乳腺癌、乳腺导管内乳头状瘤及乳腺炎症的常见临床症状。然而,目前区分乳腺良恶性疾病的金标准依然是组织病理学检测,而以影像学检查方法为主的乳腺癌早期诊断技术,对于微小病灶诊断敏感性和特异性仍有待提高。细胞学涂片的检查准确率也存在局限性。因此,探索敏感性和特异性更高的乳腺癌早期诊断方法有重要的临床研究意义。RASSF1A因其在众多细胞通路中的多功能作用而被广泛研究。
Agathanggelou等[2]提出RASSF1A基因调控细胞增殖、细胞完整性和细胞死亡。近年来,针对RASSF1A基因甲基化状态的Meta分析也越来越多,阐明了RASSF1A甲基化与乳腺癌患者的淋巴结转移、三阴性表型、高复发风险和较差生存率之间的显著相关性[3-4]。同样,也有研究者提出乳腺癌RASSF1A和GSTP1甲基化水平与正常癌旁组织相比存在显著性差异,与乳腺癌的早期和晚期相关[5-6]。然而,甲基化状态的RASSF1A基因主要只在肿瘤组织中被描述,但未曾利用乳管灌洗液标本研究以乳头溢液为表现的早期乳腺良恶性疾病。本研究根据前期的研究基础选择了与乳腺癌早期诊断相关的RASSF1A基因为研究对象,对乳管灌洗液标本进行甲基化特异性定量PCR检测,探讨乳管灌洗液RASSF1A基因甲基化的定量检测在乳腺癌早期诊断的潜在临床应用价值。
1 资料与方法
1.1资料选取2016年6月至2018年6月于广东省妇幼保健院乳腺科就诊,并以病理性乳头溢液为表现的40例患者。纳入的患者的乳头溢液表现均为自发性、单管、血性或浆液性溢液。所有参与者都接受了乳管镜检查。患者年龄23~61岁(中位年龄39岁,平均年龄38岁)。患者均签署知情同意书,本研究所有样本的使用均经广东省妇幼保健院伦理委员会批准。
1.2方法
1.2.1乳管灌洗液标本收集术前经乳管镜检查后置入乳管灌洗导管,通过乳管导管反复注入生理盐水,从而获得乳管灌洗液约10ml。共收集40例患者的乳管灌洗液均两份,一份用于细胞学涂片检查,一份用于RASSF1A基因甲基化的定量检测。
1.2.2细胞学涂片检查当乳管镜观察到异常时,收集进境到异常部位的灌洗液,进行细胞学评价。细胞学涂片结果分为良性、轻度不典型、严重不典型和恶性。细胞学检查阳性被定义为严重不典型或恶性。
1.2.3甲基化特异性定量PCR(methylationspe-cificPCR,MSP)的检测步骤:1)乳管灌洗液标本DNA提取。采用专用组织DNA提取试剂盒处理,提取的DNA样本通过NanoDrop2000检测浓度及凝胶电泳质检后,置于-20℃保存。2)DNA样本的亚硫酸氢盐修饰。DNA样本的亚硫酸氢盐修饰采用甲基化检测试剂盒修饰,修饰后样品置于-20℃保存、备用。3)甲基化特异性PCR检测。DNA甲基化特异性PCR引物的设计:为了能够同时扩增得到甲基化和非甲基化的目的序列,运用专用的引物设计软件设计基因启动子区的甲基化引物和非甲基化引物。使用PromegaPCR体系如下:4μlGoTaqFlexi Buffer,2.4μlMg Cl2Solution(25mM),0.4μlPCR Nucleotide Mix(10mMeach),1μlPrimer(5μM),0.1μlGoTaqHotStartPoly-merase(5u/μl),50ngTemplate补水到20μl反应体积。PCR反应条件:95℃10min;(95℃30s-53℃30s-72℃30s)X45;72℃5s。
甲基化程度的判读:DNA样品的甲基化程度分值(MS)通过以下公式计算:MS=100/[1+2(CqM-CqU)],其中CqM和CqU分别为检测甲基化的CG探针和检测非甲基化的TG探针检测的Ct值,平均Ct值<40为阳性。见图1。
1.3统计学方法
采用SPSS13.0统计软件进行数据分析。用McNemar检验分析两种检测方法的差异。以P<0.05为差异有统计学意义。
2 结果
2.140例患者病理诊断情况
在40例患者的乳管镜检查中均发现异常隆起新生物,其中包括单发或多发乳头状瘤性病变,其三维体积至少占管腔体积的1/4。所有患者均接受手术治疗,根据切除组织的病理学评价,结果分为两大类:1)含有恶性肿瘤的导管(20例DCIS,4例DCIS合并浸润性导管癌及1例严重不典型增生);2)含有良性病变的导管(13例导管内乳头状瘤,2例轻度导管不典型增生)
2.2细胞学涂片对比RASSF1A甲基化检测结果
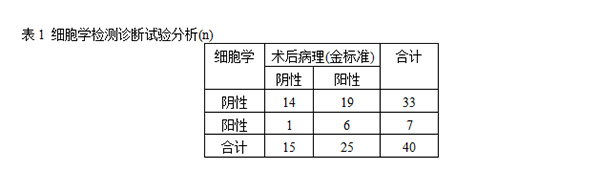
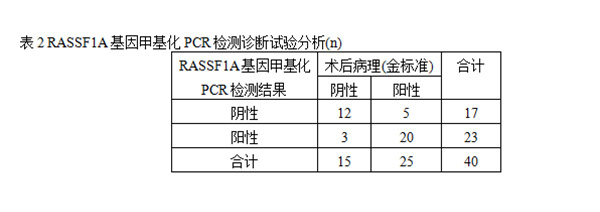
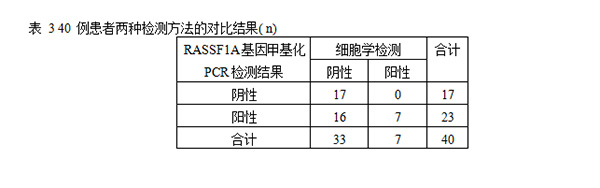
为了确定细胞学的可靠性,并将其与RASSF1A甲基化进行比较。在经病理组织学确诊为乳腺癌的患者中,只有24%通过细胞学涂片检查确认为恶性,敏感性和特异性分别为24%和93.3%(表1)。相比之下,使用RASSF1A基因甲基化作为生物标志物,80%的患者(20/25)识别准确。在乳管镜检查的前提下,提取乳管灌洗液进行RASS1FA基因MSP检测,阳性预测值为87.0%,敏感性为80%,特异性为80%(表2)。经过McNemar检验连续校正后得到x2为4.341,P<0.05。见表3。
3 讨论
乳头溢液是乳腺疾病常见的临床症状,病理性乳头溢液常见于早期乳腺癌、乳腺导管内乳头状瘤及乳腺炎症等疾病。然而,目前还没有一种术前检查能够可靠地区分早期乳腺癌和乳腺良性疾病。目前国内外研究显示,肿瘤相关基因的甲基化在乳腺癌和乳腺良性组织及正常乳腺组织的表达有显著性的差异[7-8]。与其它分子生物标记物(如mRNA和蛋白质)相比,DNA甲基化相对稳定,不容易受外界条件的影响,另外DNA甲基化可被PCR等相关技术扩增,其检测仅需少量的标本[9]。这些均有利于DNA甲基化检测在实际临床应用的开展。异常的DNA甲基化与乳腺癌的发生发展密切相关,而且可发生在乳腺癌形成的起初阶段[10-12]。因此,DNA的甲基化检测可应用于乳腺癌的早期诊断,特异性的DNA甲基化指标有望成为乳腺癌早期诊断的分子标记[12]。目前,国内仍未见有关乳管灌洗液DNA甲基化检测的研究报道。本课题组前期采用甲基化CpG岛富集分析(Methylated-CpGIsland Recovery Assay,MIRA)结合全基因组的甲基化芯片分析早期乳腺癌组织和正常乳腺组织之间差异甲基化位点,结果显示肿瘤相关的基因(GSTP1、RASSF1A、FOXC1、TWIST等)在早期乳腺癌组织和正常乳腺组织存的表达存在显著的差异[7]。根据前期研究基础,结合国外文献,本研究选择了可能与乳腺癌早期诊断相关且目前研究较广泛的基因RASSF1A为研究对象,探讨乳管灌洗液DNA甲基化的定量检测在乳腺癌早期诊断的潜在临床应用价值。
国内外有关乳腺癌DNA甲基化的诊断性研究多采用患者的血清进行检测,尽管相关肿瘤基因的甲基化指标在乳腺癌患者及对照组的表达具有差异,但不同研究中的DNA甲基化量化指标变化较大,且其敏感性和特异性仍有待进一步提高[13-15]。这可能由于不同研究的人群和检测方法存在差异,另外肿瘤释放至血清的肿瘤相关基因的DNA含量极少,也是造成血清DNA甲基化检测不稳定的重要原因。而大部分乳腺癌起源于乳腺导管系统,乳管灌洗液含有乳腺导管的上皮细胞、富含游离的DNA、RNA和蛋白等,可作为分子标记物的检测样本。因此,乳管溢液或乳管灌洗液的DNA甲基化检测逐渐成为在乳腺癌早期诊断的研究热点。
我们研究了甲基化荧光定量PCR检测乳管灌洗液标本RASSF1A基因的甲基化定量检测可以提高乳管镜对病理性乳头溢液患者早期乳腺癌的检出率,结果表明,MSP可以更有效的区分以病理性乳头溢液为表现的乳腺良恶性疾病。根据本研究的结果,RASSF1A基因MSP检测可能有助于精确术前评估,并更好地完善术前准备,预测其早期乳腺癌的可能性。此外,随着内镜消融工具的出现,术前区分良恶性病变的能力将变得至关重要,因为从逻辑上讲,原位消融更适用于良性病变。与细胞学涂片检查相比,RASSF1A甲基化PCR检测的敏感性和特异性均优于细胞学检查。而且,早期乳腺癌和良性乳头状瘤的乳管灌洗液RASSF1A基因甲基化水平也有显著差异。Kassenstein等[6]对22例乳腺癌及其配对的正常乳腺组织和乳管溢液标本进行GSTP1、RARbeta2、p16(INk4a)、p14(ARF)、RASSF1A、DAP-ki-nase等基因的甲基化检测,结果显示正常乳腺组织无相关基因甲基化表达,乳腺癌组织均具有1个或以上的基因甲基化高表达,而与其相匹配的乳管溢液中82%可检测到相关基因的甲基化高表达。Fackler等[7]对49例患者的乳管溢液进行RASSF1A、TWIST1和HIN基因甲基化检测,结果显示乳管溢液的DNA甲基化检测能较好区分良恶性病变,敏感性达100%,特异性为72%,而传统细胞学检查敏感性仅29%。
Twelves等[18]研究显示,乳管灌洗液DNA甲基化可反映乳腺癌组织DNA甲基化的程度,两者密切相关。最近deGroot等[19]对乳腺癌患者和健康人的乳管灌洗液进行肿瘤相关基因甲基化检测,结果显示乳管灌洗液中抑癌基因的甲基化在乳腺癌和健康人的表达具有明显差异,AKR1B1,ALX1,RASSF1A和TM6SF1等基因的甲基化指标可作为乳腺癌早期诊断的潜在分子标记。以上研究显示,乳管灌洗液DNA甲基化检测可进一步提高乳腺早期诊断的准确性,有望成为一种新的乳腺癌早期诊断方法。虽然以上研究均表明,在检测乳腺癌抑癌基因甲基化指标均选择了多个基因构建的基因面板而非单个基因[20],而本文值得注意的是,在保持80%敏感性的情况下,单基因比多基因组具有相近的特异性为80%,这表明使用更少的基因也可以产生更特异性的标记板,从而减少诊断所需的时间和成本。
本文的不足是样本量偏小,可能影响两种检测方法的一致性,其结果对临床实际应用的适用性有待进一步探讨。
综上所述,我们证明了用甲基化PCR法测定病理学乳头溢液患者乳管灌洗液样本的RASSF1A基因甲基化在鉴别早期乳腺癌和乳腺良性疾病中是可行的。RASSF1A的甲基化可以作为诊断以病理性乳头溢液为表现的早期乳腺癌的潜在生物标志物。应用甲基化荧光定量PCR检测乳管灌洗液标本RASSF1A的甲基化可以作为早期乳腺癌的术前诊断参考依据。
参考文献
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.DOI:10.3322/caac.21492.
[2]Agathanggelou A,Cooper WN,Latif F.Role of the Rasassociation domain family 1 tumor suppressor gene in human cancers[J].Cancer Res,2005,65 (9):3497-3508.DOI:10.1158/0008-5472.CAN-04-4088.
[3]Zhang L,Long X.Association of BRCA1 promoter methylation with sporadic breast cancers:Evidence from 40 studies[J].Sci Rep,2015,5:17869.DOI:10.1038/srep17869.
[4]Sheng X,Guo Y,Lu Y.Prognostic role of methylated GSTP1,p16,ESR1 and PITX2 in patients with breast cancer:A systematic meta-analysis under the guideline of PRISMA[J].Medicine (Baltimore),2017,96(28):e7476.DOI:10.1097/MD.0000000000007476.
[5]Hesson LB,Cooper WN,Latif F .The role of RASSF1A methylation in cancer[J].Dis Markers,2007,23(1-2):73-87.
[6]Fang C,Wei XM,Zeng XT,et al.Aberrant GSTP1 promoter methylation is associated with increased risk and advanced stage of breast cancer:a meta-analysis of 19 case-control studies[J].BMC Cancer,2015,15:920.DOI:10.1186/s12885-015-1926-1.
[7]Lian ZQ,Wang Q,Li WP,et al.Screening of significantly hypermethylated genes in breast cancer using microarray-based methylated-CpG island recovery assay and identification of their expression levels[J].Int J Oncol,2012,41(2):629-638.DOI:10.3892/ijo.2012.1464.
[8]Kim MS,Lee J,Oh T,et al.Genome-wide identification of OTP gene as a novel methylation marker of breast cancer[J].Oncol Rep,2012,27(5):1681-1688.DOI:10.3892/or.2012.1691.
[9]Duffy MJ,Napieralski R,Martens JW,et al.Methylated genes as new cancer biomarkers[J].Eur J Cancer,2009,45(3):335-346.DOI:10.1016/j.ejca.2008.12.008.
[10]Mikeska T,Bock C,Do H,et al.DNA methylation biomarkers in cancer:progress towards clinical implementation[J].Expert Rev Mol Diagn,2012,12(5):473-487.DOI:10.1586/erm.12.45.
[11]Park SY,Kwon HJ,Lee HE,et al.Promoter CpG island hypermethylation during breast cancer progression[J].Virchows Arch,2011,458(1):73-84.DOI:10.1007/s00428-010-1013-6.
[12] Suijkerbuijk KP,van Diest PJ,van der Wall E.Improving early breast cancer detection:focus on methylation[J].Ann Oncol,2011,22(1):24-29.DOI:10.1093/annonc/mdq305.
[13]Van De Voorde L,Speeckaert R,Van Gestel D,et al.DNA methylation-based biomarkers in serum of patients with breast cancer[J].Mutat Res,2012,751(2):304-325.DOI:10.1016/j.mrrev.2012.06.001.
[14]符德元,任传利,谭好升,等.乳腺癌患者血浆循环DNA 中 Sox17 基因甲基化检测的临床意义[J].中国癌症杂志,2014,( 11):808-813.DOI:10.3969/j.issn.1007-3969.2014.11.002.
[15]李世荣,王振明,董爱萍,等.乳腺癌患者外周血及癌组织RASSF1A基因甲基化水平检测临床意义分析[J].中华肿瘤防治杂志,2013,20(24):1908-1911.DOI:10.3969/j.issn.1673-5269.2013.24.011.
[16]Krassenstein R,Sauter E,Dulaimi E,et al.Detection of breast cancer in nipple aspirate fluid by CpG island hypermethylation[J].Clin Cancer Res,2004,10(1 Pt1):28-32.
[17]Fackler MJ,Rivers A,Teo WW,et al.Hypermethylated genes as biomarkers of cancer in women with pathologic nipple discharge[J].Clin Cancer Res,2009,15(11):3802-3811.DOI:10.1158/1078-0432.CCR-08-1981.
[18]Twelves D,Nerurkar A,Osin P,et al.DNA promoter hypermethylation profiles in breast duct fluid[J].Breast Cancer Res Treat,2013,139(2):341-350.DOI:10.1007/s10549-013-2544-8.
[19]de Groot JS,Moelans CB,Elias SG,et al.DNA promoter hypermethylation in nipple fluid:a potential tool for early breast cancer detection[J].Oncotarget,2016,7(17):24778-24791.DOI:10.18632/oncotarget.8352.
[20]Fackler MJ,Malone K,Zhang Z,et al.Quantitative multiplex methylation-specific PCR analysis doubles detec-tion of tumor cells in breast ductal fluid[J].Clin Cancer Res,2006,12(11 Pt1):3306-3310.DOI:10.1158/1078-0432.CCR-05-2733.
(济宁医学院学报2019年10月第42卷第5期)