发布时间:2020年08月12日 10:26:07 来源:振东健康网
张昌生1,张学贞1,韩宗明1,朱鸿波1,万涛2
(1.开封市中心医院普通外科,河南开封475000;2.中国人民解放军总医院第
一医学中心肝胆外科,北京100853)
【摘 要】目的:研究细胞骨架相关蛋白2(cytoskeleton-associated protein 2,CKAP2)对肝癌细胞的增殖、凋亡和迁移的作用及其机制。方法:培养正常肝细胞L02和肝癌细胞系HepG2,Huh7和SMMC-7721。采用实时PCR和蛋白质印迹法检测CKAP2的表达水平。进一步将HepG2细胞分为对照(Control)组、阴性对照(NC)组和沉默CKAP2(siCKAP2)组。NC组和siCKAP2组细胞分别转染siControl和siCKAP2。采用CKK-8法检测细胞活性,BrdU掺入法检测细胞增殖,凋亡试剂盒检测细胞凋亡,transwell实验检测细胞的迁移和侵袭。采用蛋白质印迹法检测cleavedcaspase3,Bax,E-cadherin,N-cadherin,Vimentin以及磷酸化的Janus激酶2(Janus kinase2,JAK2)和磷酸化的信号转导和转录激活因子3(signal transducer and activator of transcription3,STAT3)的蛋白质表达水平。结果:与正常肝细胞L02比较,CKAP2在肝癌细胞系HepG2,Huh7和SMMC-7721中的表达显著上调(均P<0.05)。与NC组比较,siCKAP2组细胞活性和增殖率显著下降(均P<0.05);细胞凋亡率升高,cleaved-caspase3和Bax的蛋白质表达水平显著上调(均P<0.05);细胞迁移和侵袭显著减少(均P<0.05);E-cadherin蛋白质表达水平显著上调,Vimentin,Ncadherin,磷酸化的JAK2和磷酸化的STAT3的蛋白质表达水平显著下调(均P<0.05)。结论:沉默CKAP2基因抑制肝癌细胞的增殖、迁移和侵袭,促进其凋亡,JAK2/STAT3信号通路可能参与这些过程。
【关键词】细胞骨架相关蛋白2;肝癌;增殖;凋亡;迁移
Silence of cytoskeleton-associated protein 2 represses cell proliferation and migration and promotes apoptosis in liver ancer cell lines
ZHANG Changsheng1,ZHANG Xuezhen1,HAN Zongming1,ZHU Hongbo1,WAN Tao2
(1.Department of General Surgery,Kaifeng Central Hospital,Kaifeng Henan 475000;2.Department of Hepatobiliary Surgery,First Medical Center,Chinese PLA General Hospital,Beijing 100853,China)
【Abstract】Objective:To investigate the roles of cytoskeleton-associated protein 2(CKAP2)in proliferation,apoptosis,and migration in liver cancer cells and the potential mechanisms.Methods:Human normal hepatocyte L02 and liver cancer cell lines HepG2,Huh7,and SMMC-7721 were cultured.The CKAP2 expression was detected by real-time PCR and Western blotting.HepG2 cells were randomly divided into a control group,a negative control(NC)group,and a CKAP2 silencing(siCKAP2)group.CCK-8 and BrdU assays were used to evaluate cell viability and proliferation,respectively.Transwell assay was employed to determine cell migration and invasion.The protein levels of cleaved-caspase 3,Bax,E-cadherin,N-cadherin,Vimentin,phosphorylated Janus kinase 2 (p-JAK2),and phosphorylated signal transducer and activator of transcription 3(p-STAT3)were determined by Western blotting.Results:Compared with normal hepatocyte L02,CKAP2 was highly expressed in liver cancer cell lines HepG2,Huh7,and SMMC-7721(all P<0.05).Compared with the NC group,cell viability and proliferation rate of the siCKAP2 group were decreased(both P<0.05).The apoptotic rate,protein expression of cleaved-caspase 3 and Bax in the siCKAP2 group were significantly higher than those in the NC group(all P<0.05).Compared with the NC group,cell migration and invasion rates of the siCKAP2 group were significantly attenuated(both P<0.05).Compared with the NC group,E-cadherin protein expression in siCKAP2 group was increased,while protein expression levels of Vimentin,N-cadherin,pJAK2,and p-STAT3 were decreased(all P<0.05).Conclusion:CKAP2 gene silence inhibits proliferation,migration,and invasion,and promotes apoptosis in liver cancer cells,while JAK2/STAT3 signaling pathway may be involved in these processes.
【Key words】cytoskeleton-associated protein 2;liver cancer;proliferation;apoptosis;migration
肝癌是最常见的原发性癌症 ,全球癌症死亡的第二大原因[1]。许多患者由于没能在早期被诊断 ,导致肿瘤被发现时已处于中晚期 ,5年生存率只有6.9%[2]。慢性病毒性肝炎、肝硬化、黄曲霉素、非酒精性脂肪肝以及糖尿病等代谢疾病都是肝癌的危险因素[3]。目前在肝癌的诊断、外科治疗等方面取得了一定的进展 ,肝移植被认为是肝癌最有效的治疗方式之一。然而 ,由于肝供体不足、移植手术费用昂贵且患者终身需服用免疫抑制药等诸多因素 ,限制了其临床应用。因此 ,寻找早期诊断和治疗肝癌的靶分子具有重要的意义。细胞骨架相关蛋白2(cytoskeleton-associated protein 2 ,CKAP2)又称肿瘤相关微管蛋白(tumorassociated microtubule-associated protein ,TMAP) ,在细胞增殖中发挥重要作用 ,特别是在有丝分裂期间。研究[4]发现:CKAP2在多种癌组织中表达异常 ,参与调控癌细胞的增殖、凋亡、迁移和侵袭等过程。本研究通过观察沉默CKAP2对肝癌细胞增殖、凋亡、迁移和侵袭的影响 ,探讨CKAP2在肝癌发展过程的作用。
1、材料与方法
1.1 材料
人正常肝细胞L02和肝癌细胞系HepG2 ,Huh7和SMMC-7721购自上海中国科学院细胞库;胎牛血清、MEM培养基、RPMI 1640培养基和DMEM培养基购自美国Gibco公司;CKAP2 siRNA(siCKAP2)和siRNA阴性对照(siControl)购自上海吉玛制药技术有限公司;CCK-8试剂盒、BCA蛋白定量试剂盒和辣根过氧化酶标记的二抗购自上海碧云天生物技术有限公司;BrdU-ELISA细胞增殖试剂盒和细胞凋亡试剂盒(Cell Death Detection ELISAPLUS)购自德国Roche公司;transwell小室购自美国Costar公司;matrigel胶购自美国BD公司;SYBR Green PCR Master Mix购自德国Qiagen公司;反转录试剂盒和荧光素酶活性试剂盒购自美国Promega公司;lipofectamine 2000购自美国Invitrogen公司;CKAP2 ,E-cadherin ,N-cadherin ,Vimentin ,Janus激酶2(Janus kinase 2 ,JAK2) ,信号转导和转录激活因子3(signal transducer and activator of transcription 3 ,STAT3) ,pJAK2 ,p-STAT3 ,β-actin和GAPDH抗体购自美国Abcam公司;cleaved-caspase 3和Bax抗体购自美国CST公司。
1.2 方法
1.2.1 细胞培养
L02细胞培养于含20%胎牛血清、1%青霉素/链霉素的RPMI 1640中;HepG2细胞生长于含10%胎牛血清、1%青霉素/链霉素的MEM中;Huh-7细胞培养于含10%胎牛血清、1%青霉素/链霉素的DMEM中;SMMC-7721细胞培养于含10%胎牛血清、1%青霉素/链霉素的RPMI 1640中。所有细胞置于5% CO2 ,37℃培养。每1~2 d换液1次 ,每2~3 d用0.25%胰酶消化细胞 ,传代。
1.2.2 细胞分组及转染
将HepG2细胞随机分为3组:对照(Control)组细胞不作处理;阴性对照(NC)组细胞转染siControl 48 h;CKAP2沉默(siCKAP2)组细胞转染siCKAP2 48 h。按照lipofectamine 2000 说明书将siControl和siCKAP2转染至细胞。48 h后收集细胞用于后续检测。
1.2.3 CCK-8法测定细胞活性
Control组、NC组、siCKAP2组HepG2细胞加入10 μL CCK-8反应液和100 μL无血清培养基于37 ℃反应2 h ,同时设置空白对照孔。在酶标仪上450 nm波长处(参考波长690 nm)测定各孔光密度(OD)值。细胞活性=(OD实验组-OD空白对照组)/(ODControl组-OD空白对照组)×100%。
1.2.4 BrdU掺入法测定细胞增殖
在Control组、NC组、siCKAP2组中加入BrdU孵育6 h ,细胞经过变性后加入抗BrdU抗体和TMB底物液显色 ,30 min后加入1 mol/L H2SO4终止反应实验另设置仅含培养基的空白对照孔和有细胞不加BrdU的背景对照孔 ,每组设6个复孔。在酶标仪上 450 nm处(参考波长690 nm)测定各孔OD值。细胞增殖率=(OD实验组-OD空白对照组)/(ODControl组-OD空白对照组)×100%。
1.2.5 细胞凋亡率检测
利用特异性抗体与凋亡细胞释放的组蛋白相关DNA断裂片段结合 ,经显色后测定OD值来评价细胞凋亡。Control组、NC组、siCKAP2组细胞弃培养基 ,用PBS清洗后裂解细胞 ,以12000 r/min离心5 min后收集上清。取20 μL上清加入包被抗组蛋白的单克隆抗体的微量反应板中 ,再加入80 μL免疫试剂。在室温下缓慢振荡2 h。吸去上清 ,用孵育液清洗细胞3次 ,每孔中加入100 μLABST液 ,于摇床上摇晃反应10 min。在酶标仪上于450 nm波长处测定各孔OD值。细胞凋亡率=(OD实验组/ODControl组)×100%。
1.2.6 Transwell实验测定
细胞迁移和侵袭取密度为2×105个/mL的Control组、NC组、siCKAP2组HepG2细胞悬液100 μL接种于transwell上室中 ,在下室中加入600 μL的完全培养基 ,每组设置3个复孔。48 h后 ,用多聚甲醛固定细胞 ,结晶紫染色后 ,PBS洗涤细胞 ,在倒置显微镜下随机选取5个100倍视野拍照并计数(N)。侵袭实验时在transwell小室底部铺上matrigel胶 ,其他步骤参照迁移实验。细胞迁移(侵袭)率=(N实验组/NControl组)×100%。
1.2.7实时PCR测定CKAP2表达水平
在Control组、NC组、siCKAP2组HepG2细胞中加入适量的TRIzol ,按照TRIzol试剂盒说明书提取总RNA。采用反转录试剂盒将5 μg总RNA反转录为cDNA。然后用SYBR Green进行实时PCR ,每组设3个复孔 ,反应条件为:94 ℃下5 min ,57 ℃下30 s ,72 ℃下30 s ,共35个循环。β-actin作为内参 ,目的基因的相对表达量采用2-ΔΔCt计算。
1.2.8蛋白质印迹法
在Control组、NC组、siCKAP2组HepG2细胞中加入细胞裂解液于 4 ℃反应15 min ,于4 ℃下以12000 r/min离心15 min。收集上清并测定各组样品的蛋白质浓度。每个样品按照50 μg的上样量 ,行SDS-PAGE分离蛋白质 ,转膜 ,采用5%的脱脂牛奶于室温封闭1 h ,于4 ℃与一抗孵育过夜 ,与辣根过氧化酶标记的二抗于室温反应1h ,用ECL发光显色 ,曝光后采用Image J图像分析软件检测蛋白质条带OD值。蛋白质相对表达水平=OD实验组/ODControl组。
1.3 统计学处理
采用SPSS 16.0软件对数据进行分析;计量资料以均数±标准差(x±s)表示;多组间比较采用单因素方差分析法 ,两两比较采用LSD-t检验;P<0.05表示差异具有统计学意义。
2、结果
2.1 正常肝细胞和肝癌细胞中CKAP2表达水平
实时PCR和蛋白质印迹法结果显示:与人正常肝细胞L02相比 ,CKAP2 mRNA在肝癌细胞HepG2 ,Huh7 ,SMMC-7721中表达上调 ,差异有统计学意义(均P<0.05 ,图1A);CKAP2蛋白质在肝癌细胞HepG2 ,Huh7 ,SMMC-7721中表达上调 ,差异有统 计学意义(均P<0.05;图1B ,1C)。

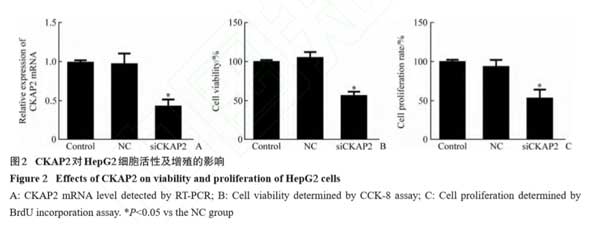
2.2 CKAP2对肝癌细胞活性和增殖的影响
实时PCR实验结果显示:与NC组相比 ,siCKAP2组CKAP2的表达水平显著下调(P<0.05 ,图2A) ,表明转染siCKAP2后HepG2细胞CKAP2的表达被显著抑制。CCK-8法实验结果显示:与NC组相比 ,siCKAP2组细胞活性显著降低(P<0.05 ,图2B)。BrdU掺入法实验结果显示:与NC组相比 ,siCKAP2组细胞增殖率显著降低(P<0.05 ,图2C)。这些结果表明沉默CKAP2具有降低HepG2细胞活性并抑制其增殖的作用。
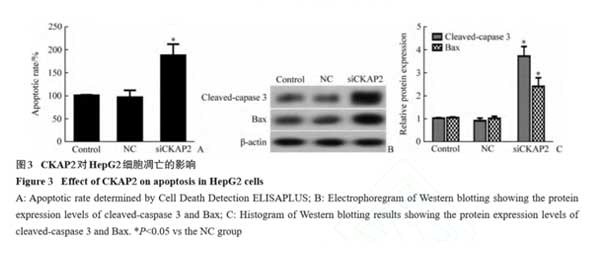
2.3 CKAP2对肝癌细胞凋亡的影响
与NC组相比 ,siCKAP2组细胞凋亡率显著增加(P<0.05 ,图3A) ,同时凋亡相关蛋白cleaved-caspase 3和Bax的表达水平明显上调(P<0.05;图3B ,3C)。
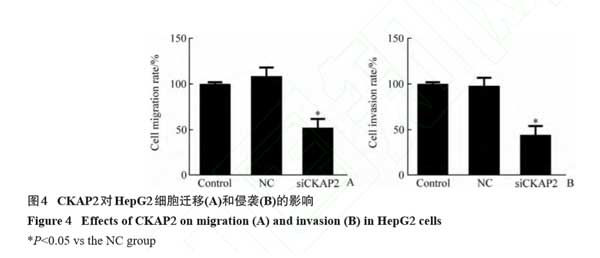
2.4 CKAP2对肝癌细胞迁移和侵袭的作用
Transwell实验结果显示:与NC组相比 ,siCKAP2组细胞的迁移和细胞的侵袭明显减少(P<0.05 ,图4)。
2.5 CKAP2对肝癌细胞中Vimentin ,E-cadherin和N-cadherin蛋白质表达的影响
蛋白质印迹法实验结果显示:NC组相比 ,siCKAP2组细胞Vimentin和N-cadherin的蛋白质表达水平明显下调 ,E-cadherin的蛋白质表达水平明显上调 ,差异有统计学意义(P<0.05 ,图5)。

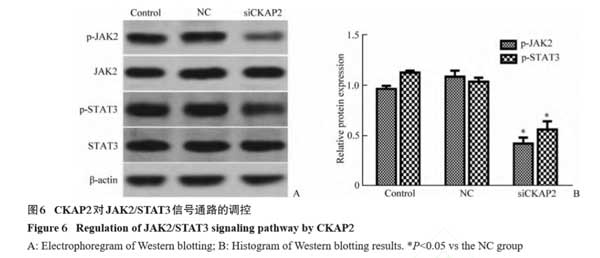
2.6 CKAP2对肝癌细胞JAK2/STAT信号通路的调控
蛋白质印迹法实验结果显示:与NC组相比 ,siCKAP2组细胞p-JAK2和p-STAT3的蛋白质表达水平明显下调 ,差异有统计学意义(P<0.05 ,图6)。这表明沉默CKAP2抑制肝癌细胞中JAK2/STAT3信号通路的激活。

3、讨论
CKAP2以P53依赖的方式在细胞有丝分裂和细胞凋亡中发挥重要作用[5]。CKAP2在宫颈癌、卵巢 癌、胃癌中高表达 ,且影响癌细胞的生物学行为[6-8]。研究[9]发现:CKAP2在肝癌组织中表达上调 ,且与患者预后关系密切。本研究发现:肝癌细胞HepG2 ,Huh7和SMMC-7721中CKAP2表达水平升高 ,提示CKAP2参与肝癌的发生和发展。CKAP2参与调控癌细胞增殖、凋亡、迁移和侵袭等生物学过程。
CKAP2通过激活ERK2信号通路促进卵巢癌细胞SKOV3增殖及迁移[7]。沉默CKAP2可通过阻断ERK2的激活来抑制宫颈癌细胞的增殖、侵袭和迁移[6]。此外 ,沉默CKAP2可阻断JAK2/STAT3信号通路激活 ,再通过其下游分子Cyclin D1和Bcl-2发挥抑制骨肉瘤细胞增殖并诱导其凋亡的作用[10]。CKAP2高表达的胶质瘤患者生存时间较CKAP2低表达患者显著缩短[4]。这些结果表明: CKAP2通过促进癌细胞的增殖及迁移 ,参与癌症的发生和发展 ,且与癌症患者的生存时间相关。本研究证实:沉默CKAP2后 ,肝癌细胞活性和细胞增殖率降低 ,细胞凋亡率升高 ,细胞迁移和侵袭能力降低 ,这与CKAP2对其他癌细胞的作用一致。上皮间充质转化(epithelial-mesenchymal transition ,EMT)是上皮细胞获得迁移能力的重要过程 ,与恶性肿瘤的局部浸润和迁移密切相关 ,因此阻断EMT发生能够有效抑制癌症的扩散和发展[11]。E-cadherin ,Ncadherin和Vimentin是EMT相关的重要分子。本研究发现:沉默CKAP2可显著上调肝癌细胞HepG2中Ecadherin的表达 ,下调N-cadherin和Vimentin的表达 ,提示沉默CKAP2能够有效阻止肝癌细胞EMT发生 ,并进一步抑制肝癌细胞HepG2的迁移和侵袭。
JAK2/STAT3在多种癌症中被激活 ,STAT3的活化与肝癌的发生、侵袭和转移关系密切[12]。阻碍JAK2/STAT3信号通路的激活可抑制肝癌细胞的迁移[13] ,激活JAK2/STAT3则促进肝癌细胞的增殖和迁移[14]。本研究发现沉默CKAP2阻碍肝癌细胞HepG2中JAK2/STAT3信号通路的激活 ,提示JAK2/STAT3可能参与CKAP2对肝癌细胞增殖及迁移的调控过程。
参考文献
[1]Wong SW,Ting YW,Chan WK.Epidemiology of nonalcoholic fatty liver disease-related hepatocellular carcinoma and its implications[J].JGH Open,2018,2(5):235-241.
[2]Ozakyol A.Global epidemiology of hepatocellular carcinoma (HCC epidemiology)[J].J Gastrointest Cancer,2017,48(3):238-240.
[3]Rawla P,Sunkara T,Muralidharan P,et al.Update in global trends and aetiology of hepatocellular carcinoma[J].Contemp Oncol (Pozn),2018,22(3):141-150.
[4]Wang K,Huang R,Li G,et al.CKAP2 expression is associated with glioma tumor growth and acts as a prognostic factor in highgrade glioma[J].Oncol Rep,2018,40(4):2036-2046.
[5]Tsuchihara K,Lapin V,Bakal C,et al.Ckap2 regulates aneuploidy,cell cycling,and cell death in a p53-dependent manner[J].Cancer Res,2005,65(15):6685-6691.
[6]Guo QS,Song Y,Hua KQ,et al.Involvement of FAK-ERK2 signaling pathway in CKAP2-induced proliferation and motility in cervical carcinoma cell lines[J].Sci Rep,2017,7(1):2117.
[7]Zhang M,Zhao L.CKAP2 promotes ovarian cancer proliferation and tumorigenesis through the FAK-ERK pathway[J].DNACell Biol,2017,36(11):983-990.
[8]Bae CD,Sung YS,Jeon SM,et al.Up-regulation of cytoskeletal-associated protein 2 in primary human gastric adenocarcinomas[J].J Cancer Res Clin Oncol,2003,129(11):621-630.
[9]Hayashi T,Ohtsuka M,Okamura D,et al.Cytoskeletonassociated protein 2 is a potential predictive marker for risk of early and extensive recurrence of hepatocellular carcinoma after operative resection[J].Surgery,2014,155(1):114-123.
[10]Zhang S,Wang Y,Chen S,et al.Silencing of cytoskeletonassociated protein 2 represses cell proliferation and induces cell cycle arrest and cell apoptosis in osteosarcoma cells[J].Biomed Pharmacother,2018,106:1396-1403.
[11]Davis FM,Stewart TA,Thompson EW,et al.Targeting EMT in cancer:opportunities for pharmacological intervention[J].Trends Pharmacol Sci,2014,35(9):479-488.
[12]王建强,黄缘.JAK-STAT信号通路在肝癌发生发展中作用的研究进展[J].世界华人消化杂志,2013,21(21):2051-2056.WANG Jianqiang,HUANG Yuan.Role of the JAK-STAT signal pathway in the development and progression of liver cancer[J].World Chinese Journal of Digestology,2013,21(21):2051-2056.
[13]Pan X,Wang C,Li Y,et al.Protective autophagy induced by physcion suppresses hepatocellular carcinoma cell metastasis by inactivating the JAK2/STAT3 axis[J].Life Sci,2018,214:124-135.
[14]LÜ J,Kong Y,Gao Z,et al.LncRNA TUG1 interacting with miR-144 contributes to proliferation,migration and tumorigenesis through activating the JAK2/STAT3 pathway in hepatocellular carcinoma[J].Int J Biochem Cell Biol,2018,101:19-28.
(中南大学学报(医学版)2020,45(4))
