发布时间:2020年10月28日 08:35:50 来源:振东健康网
汪洋1,2,柳明杰1
(1。锦州医科大学,辽宁锦州121000;2。辽宁省健康产业集团抚矿总医院,辽宁抚顺113000)
【摘要】目的:探讨信号转导与转录激活因子5(signaltransducersandactivatorsoftranscription5,STAT5)基因沉默及过表达对人乳腺癌细胞SKBR3和MCF-7紫杉醇化疗耐药性的影响及可能的分子机制。方法:构建紫杉醇耐药株SKBR3/PR和MCF-7/PR,Westernblot检测STAT5蛋白表达情况;用STAT5特异性shRNA转染SKBR3/PR和MCF-7/PR细胞,MTS法检测SKBR3/PR-shRNA和MCF-7/PR-shRNA细胞对紫杉醇的敏感性;通过STAT5过表达脂质体载体及shRNA转染SKBR3和MCF-7细胞,MTS法和流式细胞术检测紫杉醇化疗对SKBR3-STAT、SKBR3-STAT-shRNA、MCF-7-STAT和MCF-7-STAT-shRNA细胞生存率和凋亡率的影响,Westernblot及qPCR法检测细胞周期调控蛋白cyclinB1、CDK2和c-myc蛋白表达及mRNA转录水平。结果:SKBR3/PR和MCF-7/PR细胞中STAT5的表达显著高于SKBR3和MCF7细胞(P<0。01),而SKBR3/PR和MCF-7/PR细胞STAT5沉默后,紫杉醇化疗敏感性显著升高(P<0。05)。SKBR3和MCF-7细胞过表达STAT5后,紫杉醇敏感性显著降低(P<0。05),细胞凋亡率显著下降(P<0。05),cyclinB1、CDK2和c-myc蛋白表达及mRNA转录水平均显著上调(P<0。01),而STAT5沉默后,其紫杉醇敏感性显著提高(P<0。05),细胞凋亡率显著升高(P<0。05),cyclinB1、CDK2和c-myc蛋白表达及mRNA转录水平均显著降低(P<0。01)。结论:STAT5基因调控细胞周期相关因子cyclinB1、CDK2和c-myc的表达,进而介导乳腺癌细胞紫杉醇耐药。
【关键词】乳腺癌;信号转导与转录激活因子5;紫杉醇;耐药;细胞周期
[中图分类号]R737。9 [文献标识码]A [文章编号]1004-5503(2020)07-0754-08
Effect of STAT5 gene silencing and overexpression on resistance of human breast cancer cell lines to paclitaxel and relevant mechanism
WANG Yang,LIU Ming-jie
Jinzhou Medical University,Jinzhou 121000,Liaoning Province,China
【Abstract】Objective:To investigate the effect of silencing and overexpression of signal transducers and activators of transcription5(STAT5)gene on resistance of human breast cancer SKBR3 and MCF-7 cells to paclitaxel chemotherapy as well as the possible molecular mechanism.Methods:Paclitaxel-resistant SKBR3/PR and MCF-7/PR strains were constructed and determined for the expression of STAT5 protein by Western blot.SKBR3/PR and MCF-7/PR cells were transfected with STAT5 specific shRNA and analyzed for the sensitivity to paclitaxel by MTS assay.SKBR3 and MCF-7 cells were transfected with STAT5 overexpression liposome vector and shRNA,evaluated for the effect of paclitaxel chemotherapy on survival and apoptosis rates of SKBR3-STAT,SKBR3-STAT-shRNA,MCF-7-STAT and MCF-7-STAT-shRNA cells by MTS assay and flow cytometry,and determined for the mRNA transcription and protein expression levels of cell cycle regulatory proteins cyclin B1,CDK2 and c-myc by qPCR and Western blot respectively.Results:The expression levels of STAT5 in SKBR3/PR and MCF-7/PR cells were significantly higher than those in SKBR3 and MCF7 cells(P<0.01),while the sensitivity to paclitaxel chemotherapy increased significantly after STAT5 gene silencing(P<0.05).The over expression of STAT5 in SKBR3 and MCF-7 cells decreased the sensitivity to paclitaxel significantly(P<0.05),while the cell apoptosis rate decreased significantly(P<0.05),and the mRNA transcription and protein expression levels of cyclin B1,CDK2 and c-myc were up-regulated (P<0.01).However,after STAT5 silencing,the sensitivity to paclitaxel increased significantly(P<0.05),while the cell apoptosis rate increased significantly(P<0.05),and the mRNA transcription and protein expression levels of cyclin B1,CDK2 and c-myc decreased significantly(P<0.01).Conclusion:STAT5 gene regulated the expression of cell cycle-related factors cyclin B1,CDK2 and c-myc,which further mediated the paclitaxel resistance of breast cancer cells.
【Key words】Breast cancer;Signal transducers and activators of transcription 5(STAT5);Paclitaxel;Drug resistance;Cell cycle
乳腺癌是危害女性健康的常见恶性肿瘤,全球每年的死亡人数高达50万人,是仅次于肺癌的第二大肿瘤[1]。近年来,化疗逐渐成为乳腺癌治疗的主要方式,顺铂、卡铂、多西紫杉醇、吉西他滨、紫杉醇和他莫昔芬等化疗药物在一定程度上能提高患者的生活质量和总体生存率。但化疗耐药性大大降低了乳腺癌的靶向治疗效果,Ⅳ期乳腺癌患者5年生存率仍低于20%[2]。研究乳腺癌耐药标记物及相关机制,进而逆转化疗耐药性迫在眉睫。信号转导与转录激活因子(signal transducer andactivators of transcripton,STAT)表达于多种细胞和组织中,是具有高度同源性的一类转录因子,通过介导生长因子和细胞因子信号传导,调控靶基因的转录和功能,密切参与肿瘤的发生、发展及凋亡[3-4]。STAT5是STATs家族中的重要成员,在头颈癌、前列腺癌和白血病等恶性肿瘤中异常表达[5],但其在乳腺癌中的生物学功能及作用机制尚未见报道。本研究通过沉默及过表达STAT5基因,分析其对乳腺癌细胞紫杉醇化疗敏感性的影响,探讨细胞化疗耐药的分子机制。
1、材料与方法
1.1细胞及质粒人乳腺癌细胞SKBR3和MCF-7购自中国科学院上海细胞库;STAT5特异性shRNA真核表达质粒和STAT5过表达质粒由北京唯尚立德生物科技有限公司构建。
1.2主要试剂SDS-PAGE凝胶制备试剂盒、BCA蛋白定量试剂盒、蛋白质裂解液和蛋白酶抑制剂PMSF购自美国Solarbio公司;质粒大提取试剂盒购自天根生化科技有限公司;Lipofectamine2000和Opti-MEM购自美国Invitrogen公司;AnnexinV-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基生物科技有限公司;OneStepSYBR誖PrimeScriptTMRT-PCRKit购自日本TaKaRa公司;RNA提取试剂盒购自德国Qiagen公司;鼠抗人STAT5、cyclinB1、CDK2、c-myc和actin单克隆抗体购自英国Abcam公司;紫杉醇购自奥泽生物科技有限公司;HRP标记的兔抗鼠IgG购自北京索莱宝科技有限公司。
1.3细胞培养用含10%胎牛血清、15mmol/LHEPES、100U/mL青霉素和100μg/mL链霉素的RPMI1640培养基,于37℃,5%CO2温箱中培养SKBR3和MCF-7细胞。待细胞密度为80%左右时,铺于6孔板,用于后续试验。
1.4SKBR3和MCF-7细胞紫杉醇耐药株的建立取对数生长期的SKBR3和MCF-7细胞,铺于24孔板中,分别加入1nmol/L紫杉醇培养,24h后撤药,培养至细胞生长良好且稳定时,进行浓度逐步递增性诱导(药物加入量依次为5、10、20、40、80、160、320、640、1280nmol/L),建立紫杉醇耐药株SKBR3/PR和MCF-7/PR。
1.5SKBR3、MCF-7及紫杉醇耐药细胞株中STAT5表达的检测采用Westernblot法。收集各细胞,加入蛋白质裂解液与蛋白酶抑制剂PMSF(1:100)的混合液,4℃,8000×g离心10min,取少量上清液,经BCA定量后,取12μL样品,常规电泳后,转膜(120mA恒流2h),以5%BSA室温封闭1h;加入鼠抗人STAT5(1:1500稀释)和actin(1:5000稀释)单抗,4℃摇床过夜;TBST洗涤,加入HRP标记的兔抗鼠IgG(1:10000稀释),室温反应1h;TBST洗涤后,ECL显影并拍照。ImageJ分析条带。
1.6细胞转染用50μL无血清培养基Opti-MEM稀释40μg提取的STAT5过表达质粒DNA,轻轻混匀;用48μL无血清培养基Opti-MEM稀释2μLLipofectamine2000,轻轻混匀,室温作用5min;将两种液体混匀,室温作用20min,形成DNA-Lipofecta-mine2000复合物,将100μL复合物分别加入SKBR3/PR和MCF-7/PR细胞培养板中,轻轻混匀,置37℃孵箱中培养24h后传代,更换完全培养基,并加入G418筛选。待细胞在G418作用下长满后,传代或冻存。转染shRNA:当细胞汇合度达30%~50%时转染,shRNA用量100pmol/孔,Lipofectamine2000用量5μL/孔,其余步骤与转染质粒相同。
1.7紫杉醇耐药株STAT5基因沉默对其化疗敏感性影响的检测分别用80和640nmol/L紫杉醇处理SKBR3/PR、SKBR3/PR-shRNA和MCF-7/PR、MCF-7/PR-shRNA细胞24、48、72h,MTS法检测紫杉醇对各细胞的敏感性:用胰酶消化对数期细胞,接种96孔板,5000~10000个/孔,置培养箱中培养至细胞铺满底板,加入紫杉醇(80或640nmol/L)药物培养基,100μL/孔,37℃,5%CO2条件下分别孵育24、48、72h;加入0.1mol/LMTS溶液,10μL/孔,避光培养4h,490nm波长处检测A值,按下式计算细胞存活率。细胞存活率(%)=(试验孔A490-空白孔A490)/(对照孔A490-空白孔A490)×100%1.8STAT5对SKBR3和MCF-7细胞紫杉醇耐药性影响的检测分别用80和640nmol/L紫杉醇处理SKBR3、SKBR3-STAT5、SKBR3-STAT5-shRNA和MCF-7、MCF-7-STAT5、MCF-7-STAT5-shRNA细胞24、48、72h,MTS法检测紫杉醇对各细胞的敏感性。
1.9STAT5对SKBR3和MCF-7细胞凋亡影响的检测分别用80和640nmol/L紫杉醇处理1.8项各组细胞7d后,采用流式细胞术检测AnnexinV-FITC/PI双标坏死及凋亡细胞(Q2+Q3):用无EDTA-胰酶消化细胞,制成单细胞悬液,用预冷PBS清洗,加入Bindingbuffer300μL重悬细胞,密度约为5×105个/管,加入AnnexinV-FITC,5μL/管,混匀,加入PI,5μL/管,混匀,避光10min。1h内上流式细胞仪检测。
1.10STAT5对细胞周期相关因子蛋白表达及mRNA转录影响的检测
1.10.1各蛋白表达水平的检测采用Westernblot法。一抗分别为鼠抗人STAT5(1:1500稀释)、cyclinB1(1:1000稀释)、CDK2(1:1000稀释)、c-myc(1:1500稀释)、actin(1:5000稀释)单抗,按1.5项操作。
1.10.2各基因mRNA转录水平的检测采用qPCR法。用RNA提取试剂盒提取细胞总RNA:取200μL细胞沉淀加入RLT溶液中,依次加入β-巯基乙醇、70%乙醇、RW1、RPE等,具体步骤按试剂盒说明书进行。以提取的总RNA为模板,进行qPCR扩增。引物序列见表1。引物由生工生物工程(上海)股份有限公司合成。反应体系:SYBRRT-PCRBuffer10μL,RTEnzymeMix0.4μL,EXTaqHS0.4μL,ROXReferenceDye(50×)0.4μL,ForwardPrimer(10μmol/L)0.4μL,ReversePrimer(10μmol/L)0.4μL,TotalRNA1μL。反应条件:42℃5min;95℃12s;95℃5s,60℃30s,共40个循环;绘制熔解曲线。2-ΔΔCT法计算各基因的相对转录水平。
1.11统计学分析利用SPSS22.0软件进行统计分析,应用GraphPad绘图,组间比较采用t检验,以P<0.05为差异有统计学意义。
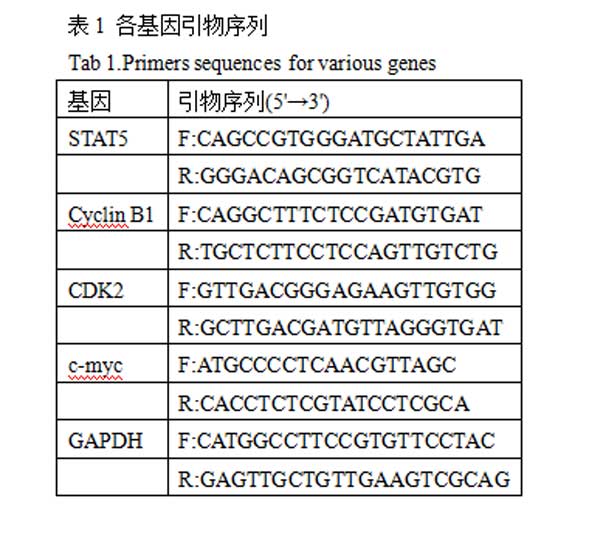
2、结果
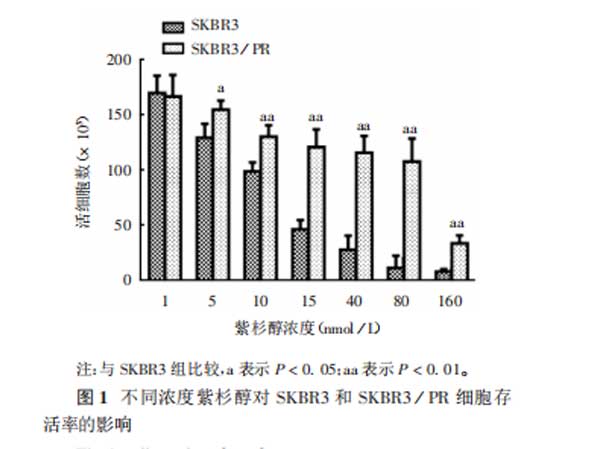
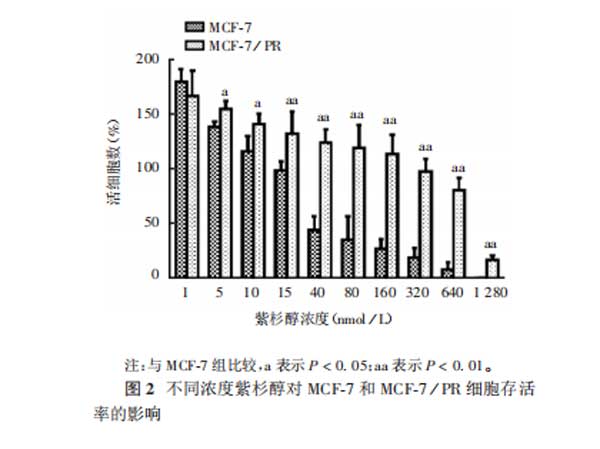
2.1SKBR3和MCF-7细胞紫杉醇耐药株的建立SKBR3和MCF-7细胞随紫杉醇浓度(>5nmol/L)增加,细胞存活率降低,且呈剂量依赖性(SKBR3细胞:t=2.476~5.653,P<0.05或P<0.01;MCF-7细胞:t=2.309~8.591,P<0.05或P<0.01)。SKBR3/PR细胞在紫杉醇浓度为80nmol/L的培养液中能稳定生长,MCF-7/PR细胞在紫杉醇浓度为640nmol/L的培养液中能稳定生长。见图1和图2。因此,在后续试验中,紫杉醇处理SKBR3和MCF-7细胞的最佳剂量分别为80和640nmol/L。
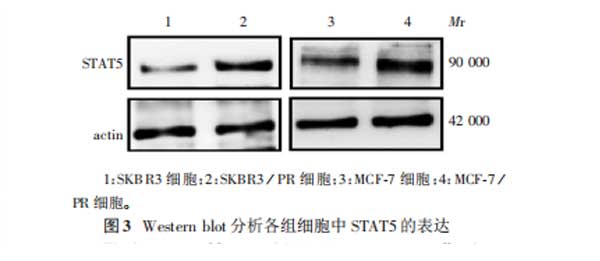
2.2SKBR3、MCF-7及紫杉醇耐药细胞株中STAT5的表达SKBR3/PR细胞中STAT5的表达量显著高于SKBR3细胞(t=7.027,P=0.000),MCF-7/PR细胞中STAT5的表达量显著高于MCF-7细胞(t=6.242,P=0.000),见图3和图4。
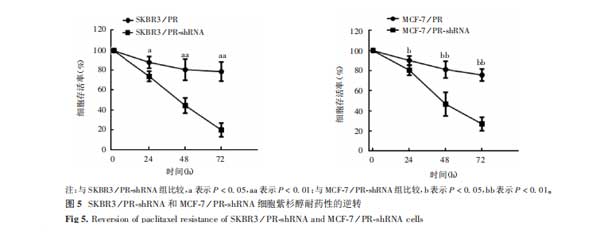
2.3紫杉醇耐药株STAT5基因沉默对其化疗敏感性的影响MTS结果显示,经80nmol/L紫杉醇处理24、48、72h的SKBR3/PR-shRNA细胞的化疗敏感性均显著高于相同时间点的SKBR3/PR细胞(t分别为2.638、4.253和7.905,P分别为0.012、0.001和0.000);经640nmol/L紫杉醇处理24、48、72h的MCF-7/PR-shRNA细胞的化疗敏感性均显著高于相同时间点的MCF-7/PR细胞(t分别为2.360、3.670和6.207,P分别为0.028、0.003和0.000)。见图5。

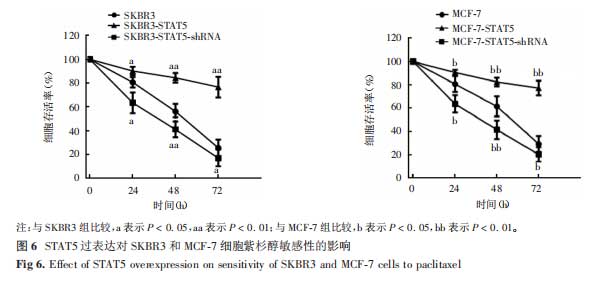
2.4STAT5对SKBR3和MCF-7细胞紫杉醇耐药性的影响MTS结果显示,经80nmol/L紫杉醇处理24、48、72h的SKBR3-STAT5细胞的化疗敏感性显著低于相同时间点的SKBR3细胞(t分别为2.532、3.676和4.109,P分别为0.016、0.003和0.002),经640nmol/L紫杉醇处理24、48、72h的MCF-7-STAT5细胞的化疗敏感性显著低于相同时间点的MCF-7细胞(t分别为2.420、3.254和2.297,P分别为0.025、0.005和0.031);STAT5沉默后,SKBR3-STAT5-shRNA细胞的化疗敏感性较相同时间点的SKBR3细胞显著增强(t分别为2.275、4.564和4.967,P分别为0.034、0.001和0.000),MCF-7-STAT5-shRNA细胞的化疗敏感性较相同时间点的MCF-7细胞显著增强(t分别为2.413、3.696和5.779,P分别为0.026、0.003和0.000)。见图6。
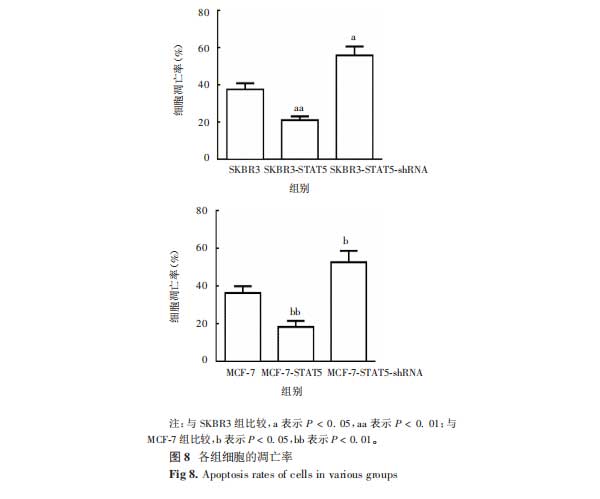
2.5STAT5对SKBR3和MCF-7细胞凋亡的影响流式细胞术检测结果显示,SKBR3-STAT5细胞的凋亡率显著低于SKBR3细胞(t=3.248,P=0.004),MCF-7-STAT5细胞的凋亡率显著低于MCF-7细胞(t=4.517,P=0.001);STAT5沉默后,SKBR3-STAT5-shRNA细胞的凋亡率显著高于SKBR3细胞(t=2.395,P=0.027),MCF-7-STAT5-shRNA细胞的凋亡率显著高于MCF-7细胞(t=2.505,P=0.019)。见图7和图8。

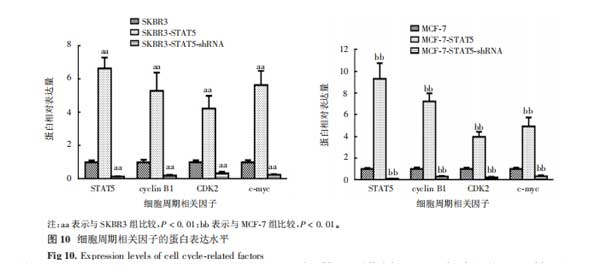
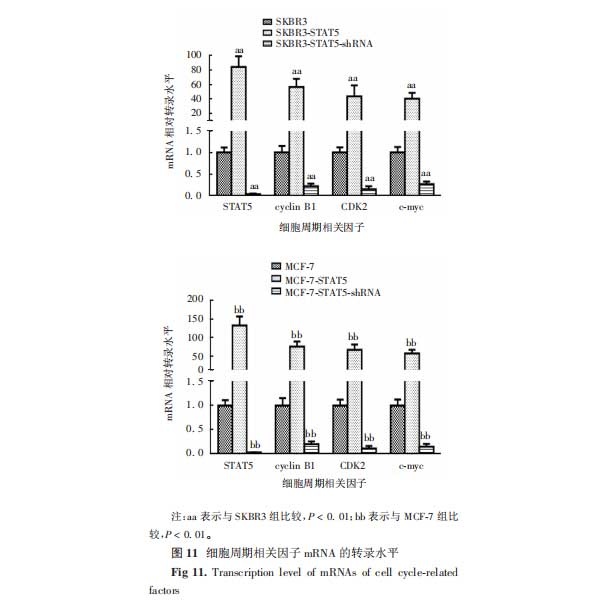
2.6STAT5对细胞周期相关因子mRNA转录及蛋白表达的影响SKBR3-STAT5细胞STAT5、cyclinB1、CDK2、c-myc蛋白表达水平和mRNA转录水平较SKBR3细胞均显著上调(蛋白:t分别为4.723、3.206、3.124和3.521,P分别为0.001、0.004、0.006和0.003;mRNA:t分别为4.818、5.013、4.427和5.103,P分别为0.000、0.000、0.001和0.001),MCF-7-STAT5细胞STAT5、cyclinB1、CDK2、c-myc蛋白表达水平和mRNA转录水平较MCF-7细胞均显著上调(蛋白:t分别为4.523、5.012、3.449和3.402;P分别为0.001、0.000、0.003和0.003;mRNA:t分别为4.812、4.890、3.194和3.676;P分别为0.000、0.000、0.004和0.002);STAT5沉默后,SKBR3-STAT5-shRNA细胞STAT5、cyclinB1、CDK2、c-myc蛋白表达水平和mRNA转录水平较SKBR3细胞均显著降低(蛋白:t分别为3.290、3.657、2.836和3.091;P分别为0.004、0.002、0.009和0.006;mRNA:t分别为4.811、4.925、3.725和4.986;P分别为0.000、0.000、0.001和0.000),MCF-7-STAT5-shRNA细胞STAT5、cyclinB1、CDK2、c-myc蛋白表达水平和mRNA转录水平较MCF-7细胞均显著降低(蛋白:t分别为4.892、3.069、4.628和2.914;P分别为0.000、0.007、0.001和0.008;mRNA:t分别为4.690、2.897、3.309和3.086;P分别为0.000、0.008、0.004和0.006)。见图9~11。

3、讨论
抗代谢物、蒽环类抗生素和拓扑异构酶抑制剂等药物化疗是治疗乳腺癌的主要手段,其诱导DNA不可修复性损伤进而破坏癌细胞。而多药耐药(multidrugresistance,MDR)是乳腺癌化疗和内分泌治疗失败的首要原因[6]。肿瘤细胞对一种化疗药耐药后,会逐渐建立起对非同类多种结构、不同靶点和不同机理的化疗药的交叉耐药,因此,寻找敏感、特异性的药物作用靶点,并开发新的靶向药物是解决乳腺癌耐药问题的关键点。研究发现,JAK-STAT通路参与肿瘤细胞的增殖和凋亡,该通路长期高水平的活化与肿瘤的发生、耐药密切相关[7]。JAK2-STAT3信号通路在结直肠、胃癌、肺癌和肝癌中持续激活,并提示该通路在肿瘤的发生发展进程及化疗耐药性中发挥重要作用[8-11]。
本研究结果显示,紫杉醇耐药细胞株SKBR3/PR和MCF-7/PR高表达STAT5基因,提示STAT5的过表达使乳腺癌细胞紫杉醇化疗敏感性降低。但沉默STAT5基因后,SKBR3/PR-shRNA和MCF-7/PR-shRNA细胞对紫杉醇敏感性提高,耐药性被逆转。进一步通过脂质体转染质粒和干扰片段shRNA,建立STAT5过表达SKBR3-STAT5和MCF-7-STAT5及STAT5沉默株SKBR3-STAT5-shRNA和MCF-7-STAT5-shRNA,结果发现,STAT5过表达抑制乳腺癌细胞对紫杉醇的敏感性,而STAT5基因沉默后,耐药性逆转。可见STAT5基因是介导乳腺癌细胞多药耐药的重要调控因子。
关于STAT5介导乳腺癌耐药的靶点和分子机制尚不明确。有研究报道,STAT5基因促进细胞增殖、恶性转化,抑制细胞凋亡[12]。STAT5通过上调细胞周期调节蛋白cyclinD的表达,促进细胞持续增殖并恶化,加速非小细胞肺癌的进程[13]。cyclinD调节G1/S期,异常表达时,DNA受损的细胞停滞在细胞周期的G1期进行修复,使化疗药物无效。胃癌和肝癌的化疗耐药性与cyclinD表达相关[14-15]。本研究结果显示,STAT5过表达的SKBR3-STAT5和MCF-7-STAT5细胞周期调控蛋白cyclinB1、CDK2和c-myc蛋白及mRNA水平均上调;而沉默STAT5后,SKBR3-STAT5-shRNA和MCF-7-STAT5-shRNA细胞cyclinB1、CDK2和c-myc蛋白及mRNA水平降低。G2期周期蛋白cyclinB1活化后与细胞周期蛋白依赖性蛋白激酶CDK2结合形成复合物,使细胞进入G2/M期,细胞周期调控系统的失衡诱发肿瘤细胞失控性生长。由此可见,STAT5基因通过调控细胞周期调控系统细胞周期蛋白(cyclinB1)-细胞周期蛋白依赖性激酶(CDK2)-细胞周期蛋白依赖性激酶抑制物(c-myc)介导乳腺癌细胞耐药。
综上所述,STAT5基因通过调控细胞周期调节蛋白的表达进而影响乳腺癌细胞紫杉醇的耐药性。STAT5有望作为乳腺癌精准治疗的新靶点,cyclinB1、CDK2和c-myc高表达可作为预测乳腺癌患者化疗耐药的生物标志物。
参考文献
[1]ZHOU Y,ZHONG J.Research progress in reducing chemotherapy resistance and predictive markers in breast cancer[J].Cardiovascular Dis J Integr Tradit Chin Western Med,2018,6(7):18-19.(in Chinese)
周叶,钟警.减少乳腺癌化疗耐药性及其预测标记物研究进展[J].中西医结合心血管病杂志,2018,6(7):18-19.
[2]MALHOTRA A,JAIN M,PRAKASH H,et al.The regulatory roles of long non-coding RNAs in the development of chemoresistance in breast cancer[J].Oncotarget,2017,8(66):110671-110684.
[3]RANI A,MURPHY J J.STAT5 in cancer and immunity[J].J Interferon Cytokine Res,2016,36(4):226-237.
[4]WINGELHOFER B,NEUBAUER H A,VALENT P,et al.Implications of STAT3 and STAT5 signaling on gene regulation and chromatin remodeling in hematopoietic cancer[J].Leukemia,2018,32(8):1713-1726.
[5]TIAN T P,XU J,LIU Y H,et al.Advances of relationship between STAT3 and its tumor[J].Yunnan Chem Industry,2017,44(7):3-6.(in Chinese)docetaxel reverses multidrug resistance in breast cancer cells[J].J Pharm Pharmacol,2019,71(8):1243-1254.
[7]XIE Y F.Development of JAK2-STAT3 signaling pathway in cancer cells[J].J Shijiazhuang Univ Appl Technol,2018,30(2):22-25.(in Chinese)
解芸菲.JAK2-STAT3信号通路在癌细胞中作用的研究进展[J].石家庄职业技术学院学报,2018,30(2):22-25.
[8]LI B,HUANG C.Regulation of EMT by STAT3 in gastrointestinal cancer(Review)[J].Int J Oncol,2017,50(3):753-767.
[9]SONG S,SU Z,XU H,et al.Luteolin selectively kills STAT3 highly activated gastric cancer cells through enhancing the binding of STAT3 to SHP-1[J].Cell Death Dis,2017,8(2):e2612.
[10]HUANG W,YUAN X,SUN T,et al.Proteasome inhibitor YSY01A abrogates constitutive STAT3 signaling via down-regulation of Gp130 and JAK2 in human A549 lung cancer cells[J].Front Pharmacol,2017,8:476.
[11]ZHAO C,WANG W,YU W,et al.A novel small molecule STAT3 inhibitor,LY5,inhibits cell viability,colony formation,and migration of colon and liver cancer cells[J].Oncotarget,2016,7(11):12917-12926.
[12]ZHANG X K,SI X M,ZHANG S.Effect of propofol combined with carboplatin on apoptosis and JAK/STAT pathway[J].Chin J Modern Med,2019,29(9):21-26.(in Chinese)
张新科,司小萌,张朔.丙泊酚联合卡铂对乳腺癌细胞凋亡及JAK/STAT通路的影响[J].中国现代医学杂志,2019,29(9):21-26.
[13]ZHANG T,JIANG B,ZOU S T,et al.Overexpression of B7H3 augments anti-apoptosis of colorectal cancer cells by Jak2-STAT3[J].World J Gastroenterol,2015,21(6):1804-1813.
[14]XU Y,LV S X.The effect of JAK2 knockout on inhibition of liver tumor growth by inducing apoptosis,autophagy and antiproliferation via STATs and PI3K/AKT signaling pathways[J].Biomed Pharmacother,2016,84:1202-1212.
[15]WANG C C,ZHENG J F,ZHOU L T,et al.Relationship between Cyclin D1 or PTEN expression and chemoresistance in gastric cancinoma[J].J Mol Diagn Ther,2014,6(7):233-238.(in Chinese)
王翠翠,郑金峰,周露婷,等.胃癌CyclinD1、PTEN表达及与化疗药物耐药性关系的研究[J].分子诊断与治疗杂志,2014,6(7):233-238.
(中国生物制品学杂志2020年7月第33卷第7期)
