发布时间:2020年11月18日 08:31:23 来源:振东健康网
李彦泽、王磊、陈志远、刘修恒
武汉大学人民医院泌尿外科袁湖北武汉430060
【摘要】膀胱癌作为泌尿系统常见肿瘤,目前常见的治疗方法包括手术治疗和化疗,然而对于晚期膀胱癌患者的疗效仍不尽如人意。近年来,随着以程序性细胞死亡分子1(PD-1)/程序性细胞死亡分子配体1(PD-L1)抑制剂等免疫检查点抑制剂为代表的免疫治疗的出现,使晚期膀胱癌的治疗出现了新的希望。PD-1IPD-LI抑制剂可以阻断PD-1/PD-L1结合,从而阻断负性免疫调节信号,进而提高抗肿瘤免疫活性。本文将通过分析临床试验研究的数据和结果对PD-1/PD-L1I抑制剂在晚期膀胱癌治疗中的作用机制、现况及不良反应等进行综述,为晚期膀胱癌患者的临床治疗提供帮助。
【关键词】晚期膀胱癌;程序性细胞死亡分子1/程序性细胞死亡分子配体1抑制剂;免疫检查点抑制剂;免疫治疗
【中图分类号】R737.14 【文献标识码】A 【文章编号】1673-7210(2020)02(a)-0040-05
Research progress of PD -1/PD -L1 inhibitors for the treatment of advanced bladder cancer
LI Yanze WANG Lei CHEN Zhiyuan LIU Xiuheng
【Abstract】Bladder cancer is a common cancer in the urinary system.The curent common treatments include surgery and chemotherapy. However, the efficacy of patients with advanced bladder cancer is till unsatisfactory.In recent years, with the advent of immunotherapy represented by immunological checkpoint inhibitors such as programmed cell death 1(PD-1/programmed cell death ligation 1(PD-Ll)inhibitors, new treatments for advanced bladder cancer have emerged. PD-1/PD-L1 inhibitors bock PD-1/PD-LI binding, therapy blocking negative immune regulatory signals, then enhancing anti-tumor immune activity.This article will review the principles,current status and adverse facts of PD-1/PD-Ll inhibitors in the treatment of advanced bladder cancer through analyzing data and results in clinical trials, and provide assistance for the clinical treatment of patients with advanced bladder cancer.
【Key words】Advanced bladder cancer;Programmed cell death l/programmed cell death ligation I inhibitor;Immunological checkpoint inhibitor;Immunotherapy
膀胱癌已经成为常见的泌尿系恶性肿瘤之一,2017年美国有超过79000例新发病例,在我国膀胱癌的发病率达到80.5/10万[1]。尿路上皮癌是膀胱癌中最常见的组织类型,占90%以上。对于非肌层浸润性膀胱癌的治疗,目前以手术治疗和膀胱灌注化疗为主。对于失去手术机会的膀胱癌患者,如局部进展期或远处转移期的患者,目前的治疗方案是以顺铂为基础的系统化疗袁然而效果差强人意袁5年生存率难以达到15%[2]。对于此类患者的治疗近三十年未见有明显的进展。近年来袁随着肿瘤免疫检查点抑制剂的研究,尤其是程序性细胞死亡分子1(PD-1)/程序性细胞死亡分子配体1(PD-L1)抑制剂研究的快速发展,为膀胱癌患者的治疗带来了新的方案。大量的临床试验正在进行,到目前为止,美国食品与药品管理局(FDA)已经批准了5种PD-1/PD-L1抑制剂用于治疗晚期转移性尿路上皮癌。2018年6月,我国国家食品药品监督管理局(CFDA)批准首个PD-1抑制剂上市。本文将对PD-1/PD-L1抑制剂在晚期膀胱癌治疗中的作用机制尧现况及不良反应等进行综述。
1、PD-1/PD-L1抑制剂在膀胱癌治疗中的作用机制
PD-1是T细胞表面上的一种抑制性跨膜受体,其有PD-LI和PD-L2两种配体。PD-L2与PD-1的亲和力较PD-LI高,但PD-L2的分布较PD-L1局限,所以目前研究多集中于PD-L1方向[3]。PD-1与PD-L1结合后会对免疫细胞活性产生负性调节的作用。同时,PD-1在免疫细胞被激活时会有一定的表达或上调。在正常人群中,这一机制可以防止免疫系统对于自身正常组织的损伤,在自身免疫耐受中发挥重要作用。而在肿瘤患者中,高表达的PD-1则成为了肿瘤细胞免疫逃逸的“帮凶”[3]。
有文献报道,部分膀胱癌患者的肿瘤组织中可出现高表达的PD-L1,这可能是膀胱癌肿瘤逃逸的重要机制之一。研究结果表明,膀胱癌患者PD-L1的表达水平与疾病进展、预计生存期、死亡风险等密切相关[4]。PD-1和PD-LI抑制剂就是通过阻断PD-1和PD-L1的结合,降低对于免疫细胞的负性调控作用,增强T细胞对于肿瘤细胞的免疫应答作用,从而起到抗肿瘤的效果[5]。
2、应用于晚期膀胱癌治疗的PD-1/PD-L1抑制剂
目前,对于局部晚期尿路上皮癌(aUC)或者转移性尿路上皮癌(mUC)的标准化治疗方案,仍是以铂类为基础的化疗。然而,因为显著的毒性反应,大约50%的患者不适合接受这种化疗方案[6]。2016年,FDA通过了Atezolizumab作为铂基治疗后复发的二线用药,这是首个用于晚期尿路上皮癌的PD-1PD-LI1抑制剂。此后,Nivolumab、Durvalumab、Avelumab、Pem-broli-zumab等四种PD-1/PD-L1抑制剂相继获批。下面我们就已获批的五种PD-1/PD-L1抑制剂进行简要介绍。
2.1Atezolizumab
Atezolizumab是一种选择性结合PD-L1的人源IgG1抗体,它是第一个被批准用于膀胱癌治疗的免疫检查点抑制剂[7]。Atezolizumab可以阻断PD-L1与PD-1及CD80(B7.1)的结合,恢复T细胞抗肿瘤的免疫作用[8]。最初,在Ia期临床试验(NCT01375842)中,Atezolizumab在接受过铂基化疗的晚期膀胱癌患者中表现出了明显且持久的抗肿瘤活性,并且治疗的反应率与肿瘤浸润免疫细胞PD-L1阳性率呈正相关[9]。基于上述关键性的研究进展,FDA认可Atezolizumab作为晚期膀胱癌治疗的重大突破性药物。
接下来的一项Ⅱ期单臂多中心临床试验(IMvigor210)旨在评价Atezolizumab在铂基化疗无效的局部进展性或转移性膀胱癌患者中的疗效[10]。结果显示,全部患者的客观缓解率(ORR)为15%,总生存期(OS)为7.9个月,而PD-LI高表达患者的ORR为26%,OS为11.4个月,因此,PD-L1的表达水平可作为评判Atezolizumab治疗预期的标志物。2017年5月9日,Roche宣布IMvigor211临床试验中,Atezolizumab在PD-LI高表达患者组中未能达到0S疗效终点,与化疗组相比并没有明显改善生存期[11]。
使用Atezolizumab最常见的不良反应(AE)是疲劳、腹泻和瘙痒,还有因使用免疫治疗引起的自身免疫症状,包括肝功能异常(3%)、肺炎(2%)和甲状腺功能减退症(7%)。
2.2Nivolumab
Nivolumab是一种PD-1抑制剂,与PD-1有高亲和力,可以阻断PD-1与PD-L1和PD-L2的结合[12]。CheckMate032(NCTO1928394)是一项包括I/Ⅱ期多臂多中心的临床试验。其中,膀胱癌患者组包括3个试验组,从N3组(Nivolumab单药治疗,按3mg/kg给药,每2周给药1次)结果可以看出,在PD-L1高表达的患者中,Nivolumab可以显著提高患者的OS和ORR[13]。
CheckMate275(NCTO2387996)是一项Ⅱ期多中心单臂试验,旨在评估Nivolumab单药治疗的安全性和有效性[14]。与历史对照ORR10%相比,整体人群的ORR接近19.6%。PD-L1高表达患者的中位OS为11.3个月,与二线化疗的历史对照OS(6.98个月)相比有所提高[15]。在CheckMate275试验中,约18%的受试者出现了3~4级AE。其中,最常见的AE是3~4级的腹泻。研究中有3例患者死于Nivolumab治疗,其中,肺炎、急性呼吸衰竭和心脏损害各1例。最常见的治疗相关不良反应(TRAE)是疲劳(33%)、瘙痒(29%)和皮疹(15%)。
2.3Durvalumab
Durvalumab是一种针对PD-L1的高亲和力人IgGIk单克隆抗体,其能阻断PD-L1与PD-1和CD80(B7.1)的相互作用[16]。Study1108(NCTO1693562)是一项Ⅰ/Ⅱ期非盲多中心临床试验研究,包括了Durval-umab在晚期膀胱癌中的应用[17]。在该项研究中,Durvalumab的治疗响应出现得迅速而持久∶中位至缓解时间(TTR)仅为1.4个月,同时,45%的应答患者有持续超过6个月的治疗应答,总体ORR为17.8%,在PD-L1高表达患者中ORR更是达到了27.6%。中位无进展生存期(PFS)和OS分别为1.5个月和18.2个月,1年总缓解率达到55.0%。Durvalumab耐受性良好,63.9%的患者出现TRAE,其中6.8%为3级及以上[18]。最常见的TRAE是疲劳(13.1%)、腹泻(9.8%)和厌食(8.2%)。值得注意的是,截至目前还没有出现治疗相关死亡的报道[19]。
2.4Avelumab
Avelumab(MSB0010718C)是一种人抗PD-L1IgG1抗体,可选择性抑制PD-1/PD-L1相互作用[20]。有研究已经发现,Avelumab可以通过ADCC途径在体外诱导肿瘤细胞裂解,表明其可能存在其他的抗癌活性机制[21]。同时,Avelumab对天然免疫细胞没有显著影响,从而减少了对其毒性作用的担忧[22]。JAVELINSolidTumor(NCTO1772004)是一项I期非盲多队列临床试验,旨在评估Avelumab在铂基化疗不理想的膀胱癌患者中的疗效[23]。该项研究结果显示,总体ORR为17.3%,其中PD-L1高表达患者的ORR达到了256%。中位数总缓解期(DOR)为20.1个月,中位PFS为1.6个月,中位OS为8.2个月[24]。Avelumab耐受性良好,68.3%的患者出现了不同等级TRAE,其中最常见的是输液相关反应(23.3%)和疲劳(17.3%)。
2.5Pembrolizumab
Pembrolizumab是一种抗PD-1人源IgG4抗体,破坏PD-1与其配体PD-L1和PD-L2的结合,阻止T细胞中的抑制性信号传导,增强抗肿瘤免疫[25]。在I期临床试验(KEYNOTE-012【NCTO1848834】)和Ⅱ期临床试验(KEYNOTE-052【NCTO2335424】)之后,KEYNOTE-045(NCTO2256436)是一项Ⅲ期非盲的国际性临床试验,542例铂基化疗后出现复发或进展的晚期尿路上皮癌患者随机选择接受Pembrolizumab或化疗[26]。结果显示,Pembrolizumab组和化疗组中位OS分别为10.3个月和7.4个月,12个月OS率分别为44.4%和30.2%,18个月OS率分别为36.1%和20.5%。值得注意的是,总体患者OS要比PD-L1高表达患者OS更长,提示PD-LI高表达可能是不良预后的生物学标志。Pembrolizumab组的ORR显著高于化疗组,超过12个月的持续缓解率前者也是明显高于后者。值得注意的是,Pembrolizumab是唯一经过大型随机Ⅲ期临床试验验证的OS优于化疗的免疫检查点抑制剂,因此其在铂类难治性晚期膀胱癌治疗中具有最高证据等级。就TRAE而言,Pembrolizaumab发生的不同等级的AE更少,其中最常见的是瘙痒(19.5%)、疲劳(13.9%)和恶心(10.9%)。试验中出现了一例因治疗相关性肺炎死亡的患者。
3、免疫相关不良反应(IRAE)
PD-1/PD-L1抑制剂是免疫检查点抑制剂中的一种,通过阻断免疫检查点不仅增强了机体抗肿瘤免疫的能力,同时也使机体免疫系统对于正常组织和器官产生反应,由此而产生的一系列不良反应,我们称为IRAE。有文献报道,IRAE的发生可能与T细胞过度活跃有关。这一类不良反应与一般的化疗和靶向治疗的不良反应不同,主要是一些免疫相关的不良反应。常见的有肠炎、皮疹、瘙痒、黄疸、肺炎等[27]。每种不良反应发生的时间点各不相同,出现的比例也千差万别,但大部分的IRAE可以通过停药或者激素治疗得以控制甚至可以逆转[28]。
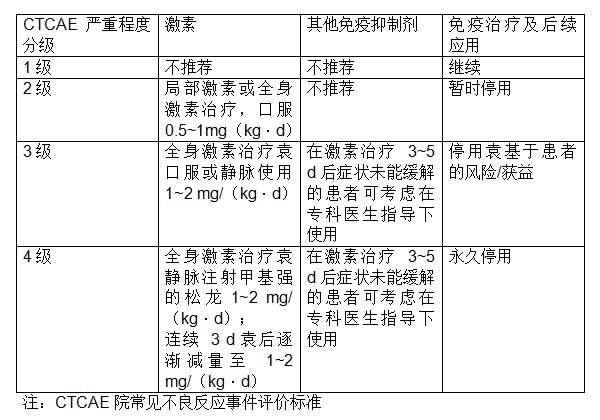
IRAE的严重程度以不良事件通用术语标准(CTCAE)来评估∶1级为轻度,2级为中度,3级为重度,4级为威胁生命,5级为死亡。症状不同或者分级不等,患者需要进行不同的治疗,对于后续免疫治疗应用与否也不尽相同[29]。见表1。
4、小结
去年,美国科学家JamesP.Allison和日本科学家TasukuHonju共享2018年诺贝尔医学及生理学奖,以表彰两人在开创肿瘤免疫治疗方法上做出的杰出贡献。随着诺贝尔奖的颁发,肿瘤免疫治疗这一新兴抗肿瘤疗法走进了人们的视野。PD-1I/PD-L1抑制剂是肿瘤免疫治疗的一个重要部分,随着研究和开发的深入,多种PD-1/PD-L1抑制剂已被FDA批准用于晚期膀胱癌的治疗,部分药物也逐步在我国上市。然而,随着临床应用的增加,不可避免地会导致不良反应的出现。如何监测用药过程中的指标变化,如何合理地联合用药以避免不良反应的发生,使患者获得安全而有效的抗肿瘤疗效,值得我们进一步的思考和研究。但不可否认的是,PD-1/PD-L1抑制剂的出现为"沉寂"多年的晚期膀胱癌治疗带来了新的希望。
参考文献
[1]Chen W,Zheng R,Bade PD,et al.Cancer staistic in China,2015[J]. CA CamncrJClin,2016,6(2):15-132.
[2]Kim J. Immune checkpoint blockade therapy for bladder cancer treatment[J]. Investig Clin Urol,2016,57(Suppl 1):S98-S105.
[3]Postow MA,Callahan MK,Wolchok JD. Immune checkpoint blockade in cancer therapy [J].J Clin Oncol,2015,33(17):1974-1982.
[4]Siefker-Radtke AO,Apolo AB,Bivalacqua TJ,et al. Immunotherapy with checkpoint blockade in the treatment of urothelial carcinoma[J].J Urol,2018,199(5):1129-1142.
[5]Sundararajan S,Vogelzang NJ. Anti-PD-1 and PD-L1 ther apy for bladder cancer:what is on the horizon?[J]. Future Oncol,2015,11(16):2299-2306.
[6]Koshkin VS,Grivas P. Emerging role of immunotherapy in advanced urothelial carcinoma [J]. Cur Oncol Rep,2018, 20(6):48.
[7]Ning YM,Suzman D,Maher VE,et ad. FDA approval summary:Atezolizumab for the treatment of patients with pro-gressive advanced urothelial carcinoma after platinum-containing chemotherapy [J] Oncologist,2017,22(6):743-749.
[8]Herbst RS,Soria JC,Kowanetz M,et al. Predictive correlates of response to the anti-PD-LI antibody MPDL3280A in cancer patients [J]. Nature,2014,515(7528):563-567.
[9]Petrylak D,Powles T, Bellmunt J,et d. Atezolizumab(atezo) in patients with metastatic urothelial carcinoma(mUC):a 2-year clinical update from a phase I a study [J].J Clin Oncol,2017,35(6 Suppl):290.
[10]Rosenberg JE,Hoffman-censits J,Powles T,et al. Atezolizumab in patients with locally advanced and metastat-ic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy:a single-arm, multicentre,phase 2 trial[J].Lancet,2016,387(10031):1909-1920.
[11]Powles T,Durdn I,van der Heijden MS,et al. Atezolizumab versus chemotherapy in patients with plat-inum-treated locally advanced or metastatic urothelial carcinoma(IMvigor211):a multicentre,open-label, phase randomised controlled trial [J]. Lancet,2017,S0140673 61733297X:1-11.
[12]Brahmer JR,Hammers H,Lipson EJ. Nivolumab:targeting PD-1 to bolster antitumor immunity [J]. Future Oncol, 2015,11(9):1307-1326.
[13]Sharma P,Callahan MK, Bono P,et ad.Nivolumab monotherapy in recurrent metastatic urothelial carcinoma(Check-Mate 032):a multicentre,open-label, two-stage,multiam,phase 1/2 trial [J].Lancet Oncol,2016,17(11):1590-1598.
[14] Sharma P,Retz M,Siefker-radtke A,et ad. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275)∶a multicentre,singlearm,phase 2trial【即Lancet Oncol】,2017,18(3):312-322.
[15]Raggi D,Miceli R, Sonpavde G,t al. Second-line single-agent versus doublet chemotherapy as salvage thera-py for metastatic urothelial cancer;a systematic review and meta-analysis[J]. Ann Oncol,2016,27(1):49-61. 16] Massard C,Gordon MS,Sharma S,et ad. Safety and efficacy of Durvalumab(MED14736),an anti-programmed cell death Ligand-1 immune checkpoint inhibitor,in pa-tients with advanced Urothelial bladder cancer[J].J Clin Oncol,2016,34(26):3119-3125.
[17]Hahn NM,Powles T,Massard C,et ad.Updated efficacy and tolerability of durvalumab in locally advanced or metastatic urothelial carcinoma(UC)[J]. J Clin Oncol, 2017,35(15Suppl):4525.
[18]Powles T,O'donell PH,Masard C,et d.Eficacy and safety of durvalumab in locally advanced or metastatic urothelial carcinoma:updated results from a phase 1/2 open-label study [J].JAMA Oncol,2017,3(9):el72411.
[19]Powles T,O'donnell PH,Massard C, et ad.Updated efficacy and tolerability of durvalumab in locally advanced and metastatic urothelial carcinoma J].J Clin Oncol,2017. 35(6 Suppl):286.
[20]Heery CR,O'sullivan coyne GH,Madan RA,et al. Phase I open-label,multiple ascending dose trial of MSB0010 718C,an anti-PD-Ll monoclonal antibody in advanced solid malignancies [J].J Clin Oncol,2014,32(15 Suppl):3064.
[21]Boyerinas B,Jochems C, Fantini M,et d. Antibody-dependent cellular cytotoxicity activity of a novel anti-PD-L1 antibody avelumab(MSB0010718C)on human tumor cells [J]. Cancer Immunol Res,2015,3(10):1148-1157.
[22]Grenga I, Donahue RN,Lepone LM,ei al.A fully human IgG1 anti-PD-L1 MAb in an in vitro assay enhances antigen-specific T-cell responses [J]. Clin Transl munol,2016,5(5):e83.1-e83.12.
[23]Heery CR, O'sullivan-coyne G,Madan RA,et al. Avelum-23 ab for metastatic or locally advanced previously treated solid tumors(JAVELIN Solid Tumor):a phase la,multi-cohort,dose-escalation trial [J].Lancet Oncol,2017,18 (5):587-598.
[24]Apolo AB,Infante JR,Balmanoukian A,et al. Avelumab, an ant-programmed death-ligand I antibody,n patients with refractory metastaticurothelialcarcinoma:rsults from a multicenter,phase Ibstudy [JJ Clin Oncol,2017,35 (19):2117-2124.
[25]Khoja L,Butler MO,Kang SP,et al.Pembrolizumab[J]. Immuno Theraphy Cancer,2015,3(1):36.
[26]Bellmunt J,De wit R,Vaughn DJ,et al.KEYNOTE-045 investigators. Pembrolizamab as second-line therapy for advanced urothelial carinoma J]. New Engl J Med, 2017,376(11):1015-1026.
[27]Michot JM,Bigenwald C, Champiat S,et al.Immune-related adverse events with immune checkpoint blockade:a comprehensive review [J]. Eur J Cancer,2016,54:139-148.
[28]Weber JS,Kahler KC,Hauschild A.Management of immune-related adverse events and kinetics of response with ipilimumab [J.J Clin Oncol,2012,30(21):2691-2697.
[29]Champiat S,Lambot O,Barrau E,et al.Management of immune checkpoint blockade dysimmune toxicities:a collaborative position paper [J.Ann Oncol,2015,27(4):559-574.
中国医药导报 2020 年 2 月第 17 卷第 4 期
