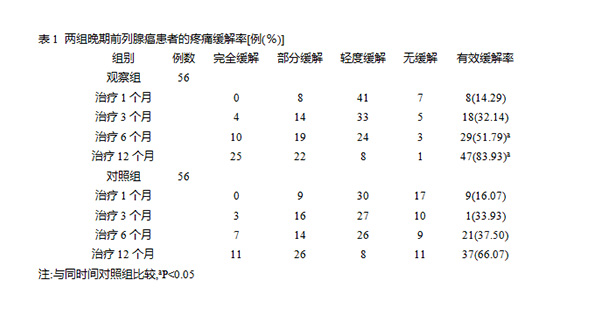
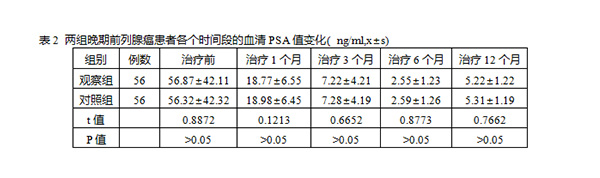
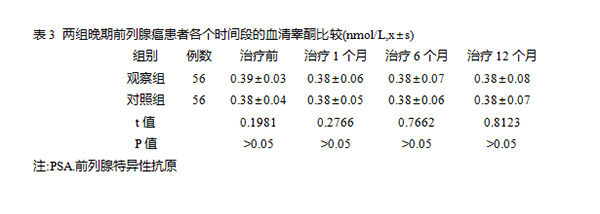
发布时间:2020年03月26日 10:15:53 来源:振东健康网
余坤
【摘要】上皮-间质转化(EMT)是肿瘤细胞获得转移和侵袭能力的重要发育程序。在EMT期间,参与调节过程的转录因子通常被称为EMT的"主要调节因子",包括Snail和ZEB转录因子家族的成员。近年来,多项研究证实(SRY-relatedHMG-box)SOX转录因子家族的SOX4可调节EMT诱导物的表达,激活转化生长因子β(TGF-β)或Wnt/β-catenin通路以促成EMT,赋予细胞转移和凋亡抗性来推进肿瘤发生与进展,而微小RNA(miRNA)与SOX4被认为是主要的调节因子,已被证实在乳腺癌、卵巢癌、肝癌、胃癌、结直肠癌及前列腺癌中发挥着至关重要的作用,然而在肺癌领域的研究比较少。本文就miRNA与SOX4在肺癌侵袭、转移中发生EMT的作用机制做一综述,为后续临床应用及科研工作奠定理论基础。
【关键词】肺肿瘤;上皮-间质转化;微小RNA;综述
Research progress on the mechanism of miRNA andSOX4on epithelial-mesenchymal
transition in invasion and metastasis of lung cancer
YU Kun.
Department of Molecular Diagnostic Center,the Third Affiliated Hospital of Kunming Medical University,Kunming 650118,China
【Abstract】EMT is an important developmental process for cancer cells to acquire metastasis and invasiveness.During EMT,the transcription factors involved in the regulation process are often referred to as the "major regulators" of EMT,including members of the Snail and ZEB transcription factors family.In recent years,many studies have confirmed thatSOX4of SOX transcription factor family(SRY-related HMG-box)can regulate the expression of EMT inducers,activate TGF-βor Wnt/beta-catenin pathway to promote EMT,and endow cell metastasis and apoptotic resistance to promote tumorigenesis and progression.miRNA and SOX4 are considered as major regulators,and have been proved to play a crucial role in breast cancer,ovarian cancer,liver cancer,gastric cancer,colorectal cancer and prostate cancer.However,little research has been done in the field of lung cancer.This article reviews the mechanism of miRNA and SOX4 on the occurrence of EMT invasion and metastasis of lung cancer,and lays a theoretical foundation for the follow-up clinical application and scientific research.
【Key words】Lung neoplasms;Epithelial-mesenchymal transition;miRNA;Review
20世纪90年代,研究发现人类SRY基因,此后以其片段为探针,对生物体基因组文库及cDNA文库进行SRY相似基因的筛选与探究,经图谱分析发现其均名为HMG-box,可编码80个氨基酸的保守序列,(SRY-relatedHMG-box)SOX基因就是HMG-box序列与SRY/Sry产物具有50%以上氨基酸序列相似性的编码基因。SOX4是SOX转录因子家族的C亚群的成员,通过结合特异性蛋白分子及DNA中5'-(A/T)(A/T)CAA(A/T)G-3'序列而参与细胞调节、胚胎发育与命运的决定,是肿瘤转移和侵袭有关的上皮-间质转化(EMT)的关键调节因子。闭锁小带、黏小带、黏着斑、连接蛋白等细胞间黏附作用的丧失;β-catenin、E-cadherin表达的下调以及间充质标志物如Fibronectin、vimentin、N-cadherin表达的增加,EMT上皮标志物发生特征性标志改变[1-3],其与转录因子如Snail,Twist,SOX和ZEB的上调同时发生。Snail1通过与E-cadherin启动子结合以抑制其转录诱导EMT;Twist通过诱导Snail1(Snail)、Snail2(Slug)和Snail3(Smuc)然后与其启动子结合抑制E-cadherin诱导EMT[4];ZEB1和ZEB2通过结合E-cadherin启动子中的E-box序列抑制上皮标记物E-cadherin,同时激活间充质标记物如vimentin、N-cadherin诱导EMT,并募集共抑制剂如染色质重塑复合体(SWI/SNF)、核小体重塑脱乙酰基酶(NuRD)和C末端结合蛋白(CtBP)下调肿瘤抑制剂基因的表达,促进肿瘤的发生与侵袭[5-8]。
此外,转化生长因子β(TGF-β)是调节EMT的关键信号因子,在转录水平上调节Snail和Twist,并在Smad依赖和独立途径中诱导EMT,经典途径包括PI3K/Akt、Wnt/β-catenin、Notch途径和整合素连接激酶(ILK)和整合素信号传导途径。其中,SOX4-Wnt/β-catenin-EMT通路鲜有研究,特别在肺癌领域有潜在的临床及研究价值。微小RNA(miRNA)是内源性,短的单链和非编码RNA的家族,其通过与靶mRNA的3'-非翻译区(3'-UTR)结合而负向调节晚期基因表达,从而导致翻译的降解或抑制[9-10]。越来越多的研究表明,miRNA在晚期非小细胞肺癌(NSCLC)的生理和病理过程中起着至关重要的作用,包括细胞分化,增殖,凋亡,迁移和转移[11-12]。SOX4在通过活化Wnt、TGF-β、TNF-α、Hedgehog、Notch及HIF-1a通路,参与调节肺癌的各种生物学行为中发挥着至关重要的作用。近年来,越来越多的研究证实,SOX4是诱导EMT和肺癌进展的重要调节因子,并因其可作为肺癌的潜在治疗靶标而备受青睐。本文就miRNA与SOX4在肺癌侵袭、转移中发生EMT的作用机制做一综述。
1 miRNA-138
LIU等[6]在前期实验和生物信息学分析的基础上,使用荧光素酶报告基因测定确认miRNA-138直接靶向位于vimentin,锌指E-盒结合同源框2(ZEB2)和zeste同源物2的增强剂(EZH2)基因的mRNA中的特定序列,研究组的功能分析(敲低与过表达)证明miRNA-138通过3种不同的途径调节EMT:(1)直接靶向vimentinmRNA并在转录后水平控制vimentin表达;(2)靶向转录阻遏物(ZEB2)反过来调节E-cadherin基因的转录活性;(3)靶向表观遗传调节因子EZH2,后者又调节其对包括E-cadherin在内的下游基因的基因沉默效应。
LI等[7]通过RT-PCR在人支气管上皮细胞(HBE)和7个NSCLC细胞系,包括H522、H1299、H460、A549、PAA、H1975及Calu-3检测到miRNA-138的水平,结果显示,与HBE相比,这7种NSCLC细胞系中miRNA-138的水平下调(P<0.05)。此外,还发现人类NSCLC组织中miRNA-138水平与癌旁组织相比降低(P<0.001);研究组在线数据库TargetScan6.2显示SOX4预测是miRNA-138的直接靶标;又分别检测了7种NSCLC细胞系和组织中SOX4mRNA水平;证实与mRNA水平的HBE相比,所有NSCLC细胞系中SOX4的表达明显增加(P<0.01);与癌旁组织相比,SOX4在NSCLC组织中的表达也明显上调(P<0.001);研究组预测SOX4可能受miRNA-138的负调控,未来进一步证实SOX4与EMT的关系,使用siRNA寡核苷酸敲低SOX4表达,抑制NSCLC细胞的增殖,侵袭和EMT的发生,其与miRNA-138过表达具有相似的作用。SOX4的恢复逆转了miRNA-138模拟物的抑制作用,表明SOX4可能在NSCLC进展和转移中起关键作用。据报道,siRNA对SOX4mRNA的缺失可诱导癌细胞凋亡,并可调节p53稳定性,提示SOX4可能与p53介导的细胞凋亡有关,而miRNA-138可以通过下调SOX4来增加p53的表达[8]。此外,SOX4的抑制明显增加p53表达,导致miRNA-138水平的上调。p53的下调可以明显逆转miRNA-138对SOX4就NSCLC细胞进展的抑制作用。因此,研究证明了在NSCLC组织和细胞中相对miRNA-138表达明显降低。miRNA-138的上调通过直接调节SOX4/p53抑制NSCLC细胞的增殖,侵袭EMT。这种miRNA-138/SOX4/p53/EMT反馈环可能为NSCLC进展和转移的分子机制提供新的见解,miRNA-138的过表达可能是未来治疗NSCLC的可行治疗策略。
2 miRNA-212
miRNA-212可作为细胞侵袭、转移、增殖和药物敏感性的调节因子。FU等[9]证实miR-132/212的过表达可以在mRNA和蛋白质表达水平上抑制Vcap和Lncap细胞中的TGF-β诱导的EMT。LIN等[10]用蛋白质印迹和双荧光素酶测定证实miRNA-212可以靶向SOX4mRNA的3'UTR中的相同位点并抑制其在卵巢癌细胞中的表达,降低EMT特性,形成miRNA-212-SOX4-EMT反馈环。此外,miRNA-212还可上调通过靶向SOX4抑制乳腺癌、胰腺癌、食道癌等癌种TGF-β介导的EMT。关于NSCLC,YUAN等[11]报道miRNA-212参与肿瘤发生,并且miRNA-212在NSCLC细胞中的致癌活性部分是由于抑制PTCH1。与此相反,YU等[12]研究表明miRNA-212和ZEB2的水平在NSCLC样本中负相关,荧光素酶报告基因测定证实miRNA-212靶向ZEB2mRNA的3'-UTR以抑制其翻译;此外,miRNA-212的缺失促进ZEB2介导的癌症转移与侵袭。miRNA-212的表达水平及其在NSCLC中的功能矛盾。因此,从分子水平确定miRNA-212在NSCLC中的作用机制显得格外重要。
TANG等[13]确定miRNA-212在NSCLC中的表达水平,研究组首先评估115对配对的NSCLC和邻近正常肺组织中miRNA-212的表达,与匹配的肿瘤相邻组织中注意到的相比,NSCLC组织中miRNA-212明显降低(P<0.05);为了研究miRNA-212在NSCLC中的潜在作用,研究组进行了基于miRNA-212模拟物和抑制剂的功能获得和功能丧失实验,将其转染到A549和H1299细胞,通过Matrigel-uncoated(用于迁移测定)和Matrigel包被(用于侵袭测定)Transwell测定,miRNA-212在A549细胞中的异位表达导致细胞迁移和侵袭能力的明显降低(P<0.05)。相反用miRNA-212抑制剂转染H1299细胞明显增加细胞迁移和侵袭(P<0.05);为了研究miRNA-212在调节NSCLC转移中EMT的作用,研究组评估EMT标志物,发现miRNA-212过表达增加上皮标志物E-Cadherin并抑制N-Cadherin和波形蛋白表达(P<0.05);相反,miRNA-212敲低降低E-Cadherin表达并增加N-Cadherin和波形蛋白表达(P<0.05)。此外,研究组进一步探讨了miRNA-212表达与NSCLC组织中EMT标志物之间的相关性,发现高miRNA-212组中的E-Cadherin表达高于低miRNA-212组,而高miRNA-212组中波形蛋白的表达水平明显低于低miRNA-212组中的表达水平(P<0.05)。总之,这些结果表明miRNA-212在NSCLC细胞中起EMT抑制剂的作用。SOX4是miRNA-212的直接靶标,为了探索miRNA-212抑制NSCLC迁移和侵袭的分子机制,研究组使用公共生物信息学算法(TargetScan6.2和MiRanda)来搜索候选靶基因,选择性别决定区Y-box4(SOX4)进行试验性鉴别,这在其他癌症中得到了证实。SOX4mRNA的3'-UTR含有推定的miRNA-212互补位点。为了确定预测,研究组构建了SOX4质粒的野生型(WT)和突变体(MUT)3'-UTR。荧光素酶报告基因测定显示,异位miRNA-212表达明显抑制含有WT3'-UTR的SOX4的荧光素酶活性,但不抑制具有MUT3'-UTR的SOX4的活性。相反,miRNA-212抑制增加野生型SOX4的3'-UTR的荧光素酶活性,而对突变体SOX43'-UTR没有影响(P<0.01)。此外,研究组证明miRNA-212过表达明显抑制A549细胞中SOX4mRNA和蛋白表达,而miRNA-212的下调明显增加H1299细胞中SOX4的mRNA和蛋白水平(P<0.05)。随后,研究组检查NSCLC组织中miRNA-212表达与SOX4之间的相关性,发现miRNA-212高表达肿瘤中SOX4mRNA和蛋白的表达明显低于miRNA-212低表达肿瘤中的表达(P<0.05)。总之,这些结果表明miRNA-212通过直接结合SOX4的3'-UTR来抑制SOX4表达,SOX4表达的改变逆转了miRNA-212在NSCLC细胞中的功能性作用。为了阐明SOX4是miRNA-212的功能性靶标,通过质粒载体在过表达miRNA-212的A549细胞中恢复SOX4(P<0.05)。此外,SOX4过表达增加细胞迁移,侵袭和促进EMT。类似地,在miRNA-212抑制性H1299细胞中通过特异性siRNA敲低SOX4明显抑制细胞迁移,侵袭和EMT,表明SOX4是miRNA-212在NSCLC中的功能的下游递质,miRNA-212通过靶向SOX4信号传导来调节EMT和NSCLC的转移,起到肿瘤抑制基因的作用,并且可能代表NSCLC的新的潜在治疗靶标和预后标志物。
3 miRNA-338-3p
miRNA-338-3p被定位于凋亡相关酪氨酸激酶(AATK)基因的第7个内含子,作为重要的调节因子,通过调节细胞增殖,凋亡和转移在肾癌发展中起关键作用。TONG等[14]证实在RCC组织和细胞系中miRNA-338-3p表达水平明显下调,miRNA-338-3p的低表达与晚期TNM分期和淋巴结转移明显相关;功能测定显示,RCC细胞中miRNA-338-3p的恢复明显抑制细胞增殖,集落形成,迁移和侵袭。但需要注意SOX4通过荧光素酶报告基因测定,qPCR、WB鉴定为RCC细胞中miRNA-338-3p的直接靶标,并且miRNA-338-3p能通过下调SOX4表达,抑制细胞增殖、迁移、侵袭及EMT。
LIANG等[15]通过估算肾小球滤过率(eGFR)下调miRNA-338-3p肿瘤抑制因子和激活EYA转录共激活因子和磷酸酶2(EYA2)癌蛋白来促进乳腺肿瘤生长和转移,eGFR主要通过HIF1α转录因子抑制miRNA-338-3p的表达。miRNA-338-3p通过与EYA2的3'非翻译区结合来抑制EYA2的表达,eGFR通过miRNA-338-3p的HIF1α抑制增加EYA2表达。通过miRNA-338-3p/EYA2途径,eGFR在体内和体内同种异体移植肿瘤小鼠模型中增加乳腺癌细胞生长、侵袭、EMT的发生,最终肺转移,表明miRNA-338-3p/EYA2/EMT轴有助于EGFR介导的肿瘤生长和肺转移机制研究。PENG等[16]过miRNA-338-3p模拟转染miRNA-338-3p的瞬时过表达明显抑制NSCLC细胞增殖,迁移,侵袭和诱导G1期细胞凋亡和细胞周期。此外,研究发现miRNA-338-3p和癌基因胰岛素受体底物2(IRS2)在NSCLC组织中的表达呈负相关,认为IRS2的过表达逆转miRNA-338-3p在NSCLC细胞中对细胞增殖周期,凋亡,迁移,侵袭及EMT的影响,表明miRNA-338-3p可能通过直接靶向NSCLC中的IRS2而起到肿瘤抑制剂的作用。
ZHANG等[17]用荧光素酶报告基因测定和Western印迹用于确认鞘氨醇激酶2(SphK2)是miRNA-338-3p的直接靶标。并证实miRNA-338-3p抑制细胞增殖、迁徙与侵袭,提示NSCLC进展的潜在机制证明miRNA-338-3p在高转移性NSCL细胞系和临床转移组织中明显下调。然后,研究组发现miRNA-338-3p的引入明显抑制了体外和体内肺癌细胞的迁移和侵袭。LI等[18]发现miRNA-338-3p经常在高转移性NSCLC细胞系和组织标本中下调。此外,统计分析显示miRNA-338-3p与晚期病理分期和NSCLC淋巴结转移相关,而启动子区域中激活的组蛋白H3lys27(H3K27me3)是miRNA-338-3p在NSCLC中表达降低的原因,表明miRNA-338-3p可能是一种新型肿瘤抑制因子。研究者通过荧光素酶报告基因测定和蛋白质印迹证实SOX4是miRNA-338-3p的功能靶标,miRNA-338-3p与SOX4的3'非翻译区(3'UTR)的直接结合证明了这一点。此外,miRNA-338-3p可以降低SOX4在mRNA和蛋白水平的表达。但需注意EMT标记物E-Cadherin或vimentin(SOX4的下游调节因子)也在miRNA-338-3p处理时分别有下调或上调表现。另外,过表达或沉默SOX4可以升高或抑制肺癌细胞的迁移和侵袭,与miRNA-338-3p对肺癌细胞的作用平行。同时,SOX4的敲低逆转了miRNA-338-3p介导的增强的迁移和侵袭,表明miRNA-338-3p通过靶向EMT调节剂SOX4抑制NSCLC细胞的迁移和侵袭。
4 其他
miRNAZHOU等[19]对96例宣威肺癌患者手术肿瘤样本进行分析,发现SOX4mRNA和蛋白表达明显上调。同年,研究者成功构建重组质粒pGFP-V-RS-A-SOX4shRNA并有效转染到XWLC-05细胞中,转染后48h和72hCaspase-3mRNA和蛋白表达明显上调,并猜想转录因子SOX4可能通过抑制Caspase-3依赖的凋亡途径,随后采用RNA干扰技术向女性肺癌细胞系XWLC-05转染SOX4-siRNA(Forward:
GGACCAAAUUUUUUCUCAGTT;Reverse:CUGAGAAAAAAUUUGGUCCTG),同时以未转染XWLC-05为对照。转染SOX4-siRNA后48h和72h,XWLC-05细胞中SOX4mRNA和蛋白的表达明显下调,细胞的迁移和侵袭能力明显降低,且细胞的凋亡率明显高于空白和阴性对照细胞。随后,研究组采用qPCR和Westernblot方法检测两组SOX4的表达水平,上皮标记物β-catenin,E-cadherin,间充质标记物Fibronectin,vimentin,N-cadherin的表达。通过MTT,Transwell和细胞划痕试验检测转染和未转染细胞的增殖,侵袭和迁移能力,结果观察组SOX4和蛋白mRNA水平明显高于对照组(P<0.05);转染组SOX4mRN和蛋白表达水平明显低于非转染组(P<0.05);qPCR结果显示,转染组β-catenin,E-cadherin水平明显高于未转染组(P<0.05)。转染组的N-catenin,Fibronectin,vimentin水平明显低于非转染组(P<0.05),Westernblot和qPCR检测结果一致;MTT结果显示,转染的SOX4-siRNA细胞,XWLC-05细胞增殖与非转染组(P<0.05)。Transwell无明显差异,试验结果显示转染SOX4-siRNA细胞后,XWLC非转染组-05细胞侵袭和迁移能力明显降低,表明SOX4可能通过下调β-E-cadherin,β-catenin的表达,上调Fibronectin,vimentin,N-cadherin的表达,促进上皮间质转化的发生,诱导人肺癌细胞的侵袭和转移。PENG等[20]研究发现SOX4上调EMT转录因子Twist1,snail1和zeb1以及干细胞转录因子SOX2和OCT4的表达,活化TGF-β信号传导,促进β-catenin的核转位,加强癌细胞的转移能力、EMT和干细胞特征,揭示SOX4/TGF-β/EMT轴在调节肿瘤恶性行为中的新作用。miR-204通过重组人SMAD家族成员4(SMAD4)直接调节EMT发挥作用。此外,还有miRNA-130a-3p可直接靶向SOX4以抑制EMT发生[21];lncRNACASC2通过下调SOX4抑制人肺癌细胞LAC的转移和EMT的发生[22]。LI等[23]发现miR-132的过表达明显抑制了体外肺癌细胞的迁移、侵袭及EMT的形成,但SOX4重新引入可以逆转miR-132的抗侵袭作用,强调了miRNA与SOX4在各种癌症中的相互作用。
5 小结
miRNA通过作用于多种信号传导途径在肿瘤发生与进展中起着至关重要的作用。近年来,众多研究据提供了对NSCLC进展分子机制的新见解。在治疗上miRNA可以作为针对SOX4在EMT作用上治疗肺癌的潜在靶标,抑或能发展多位点综合靶向治疗。但miRNA在肺癌领域的研究屈指可数,特别是肿瘤发生转移的关键步骤EMT的发生及针对个别转录因子SOX4的探究只停留于浅表,尚有许多不明确的机制亟待深入探究。
参考文献
[1]PAL M,BHATTACHARYA S,KALYAN G,et al.Cadherin profiling for therapeutic interventions in Epithelial Mesenchymal Transition (EMT) and tumorigenesis[J].Exp Cell Res,2018,368(2):137-146.
[2]ZHOU Y C,CHEN Y L,HUANG Y C.The function and mechanism ofSOX4in the epithelial mesenchymal transition of human lung cancer cells[J].Chinese Journal of Gerontology,2017.
[3]JIA Z,ZHANG Y,XU Q,et al.miR-126 suppresses epithelial-to-mesenchymal transition and metastasis by targeting PI3K/AKT/Snail signaling of lung cancer cells[J].Oncology Letters,2018,15(5):7369-7375.
[4]ZHAO W,ZHOU Y,XU H,et al.Snail family proteins in cervical squamous carcinoma:expression and significance[J].Clinical & Investigative Medicine Médecine Clinique Et Experimentale,2013,36(4):E223.
[5]DCONA M M,MORRIS B L,ELLIS K C,et al.CtBP-an emerging oncogene and novel small molecule drug target:Advances in the understanding of its oncogenic action and identification of therapeutic inhibitors[J].Cancer Biology & Therapy,2017,18(6):379-391.
[6]LIU X,WANG C,CHEN Z,et al.MicroRNA-138 suppresses epithelial-mesenchymal transition in squamous cell carcinoma cell lines[J].Biochemical Journal,2011,440(1):23-31.
[7]LI D,HE C,WANG J,et al.Microrna-138 inhibits cell growth,invasion,andEMTof non-small cell lung cancer via sox4/p53 feedback loop[J].Oncology Research,2017,26(3):385-400.
[8]LI J,XIA W,SU X,et al.Species-specific mutual regulation of p53 and miR-138 between human,rat and mouse[J].Scientific Reports,2016,6:26187.
[9]FU W,TAO T,QI M,et al.MicroRNA-132/212 Upregulation inhibits tgf-β-mediated epithelial-mesenchymal transition of prostate cancer cells by targeting sox4[J].Prostate,2016,76(16):1560-1570.
[10]LIN L,WANG Z,JIN H,et al.MiR-212/132 is epigenetically downregulated by SOX4/EZH2-H3K27me3 feedback loop in ovarian cancer cells[J].Tumour Biology the Journal of the International Society for Oncodevelopmental Biology & Medicine,2016,37(12):1-9.
[11]YUAN L,ZHANG D,CHEN C,et al.MicroRNA-212 displays tumor-promoting properties in non-small cell lung cancer cells and targets the hedgehog pathway receptor PTCH1[J].Molecular Biology of the Cell,2012,23(8):1423-1434.
[12]YU D,CHU X,LIN M,et al.MiR-212 suppressed the metastases of non-small cell lung cancer by reducingZEB2expression[J].Int J Clin Exp Pathol,2016,9(2):766-772.
[13]TANG T,HUAN L,ZHANG S,et al.MicroRNA-212 functions as a tumor-suppressor in human non-small cell lung cancer by targeting SOX4[J].Oncology Reports,2017,38(4):2243-2250.
[14]TONG Z,MENG X,WANG J,et al.MicroRNA-338-3p targetsSOX4and inhibits cell proliferation and invasion of renal cell carcinoma[J].Experimental & Therapeutic Medicine,2017,14 (5):5200-5206.
[15]LIANG Y,XU X,WANG T,et al.The EGFR/miR-338-3p/EYA2 axis controls breast tumor growth and lung metastasis[J].Cell Death & Disease,2017,8(7):e2928.
[16]PENG Z,SHAO G,LIN X,et al.MiR-338-3p inhibits the growth and invasion of non-small cell lung cancer cells by targeting IRS2[J].American Journal of Cancer Research,2017,7(1):53.
[17]ZHANG G,ZHENG H,ZHANG G,et al.MicroRNA-338-3p suppresses cell proliferation and induces apoptosis of non-smallcell lung cancer by targeting sphingosine kinase 2[J].Cancer Cell International,2017,17(1):46.
[18]LI Y,CHEN P,ZU L,et al.MicroRNA-338-3p suppresses metastasis of lung cancer cells by targeting theEMTregulator Sox4[J].American Journal of Cancer Research,2016,6(2):127.
[19]ZHOU Y C,WANG X C,CHEN Y,et al.Expression of transcription factorSOX4and its clinical significance in female lung cancer patients in Xuanwei area,Yunnan Province[J].Zhonghua zhong liu za zhi[Chinese journal of oncology],2013,35(3):202.
[20]PENG X,LIU G,PENG H,et al.SOX4 contributes to TGF-β-induced epithelial-mesenchymal transition and stem cell characteristics of gastric cancer cells[J].Genes & Diseases,2018,5(1):49-61.
[21]HU B,ZHANG H,WANG Z,et al.LncRNA CCAT1/miR-130a3p axis increases cisplatin resistance in non-small-cell lung cancer cell line by targeting SOX4[J].Cancer Biology & Therapy,2017,18(12):974-983.
[22]WANG D,GAO Z M,HAN L G,et al.Long noncoding RNA CASC2 inhibits metastasis and epithelial to mesenchymal transition of lung adenocarcinoma via suppressing SOX4[J].Eur Rev Med Pharmacol Sci,2017:4584-4590.
[23]LI Y,ZU L,WANG Y,et al.miR-132 inhibits lung cancer cell migration and invasion by targeting SOX4[J].Journal of Thoracic Disease,2015,7(9):1563.
(临床合理用药2019年8月第12卷第8C期)