发布时间:2020年11月10日 09:07:28 来源:振东健康网
张明晖1,2孙雅丽2赵妍2牛意2白玉勤3
(1、锦州医科大学赤峰市医院研究生培养基地肿瘤内科,内蒙古赤峰024000;
2、赤峰市医院肿瘤内科;
3、赤峰市肿瘤医院病理科)
【摘要】目的:探讨miR-489-3p对肺癌细胞增殖和凋亡的影响及潜在的作用机制。方法:将miR-NC组(转染miR-NC)、miR-489-3p组(转染miR-489-3pmimics)、si-NC组(转染si-NC)、si-微小染色体维持蛋白(MCM)2组(转染si-MCM2)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-489-3p组(转染anti-miR-489-3p)、miR-489-3p+pcDNA组(共转染miR-489-3p和pcDNA)、miR-489-3p+pcDNA-MCM2组(共转染miR-489-3p和pcDNA-MCM2)、miR-NC+WT-MCM2组(共转染miR-NC和WT-MCM2)、miR-NC+MUT-MCM2组(共转染miR-NC和MUT-MCM2)、miR-489-3p+WT-MCM2组(共转染miR-489-3p和WT-MCM2)、miR-489-3p+MUT-MCM2组(共转染miR-489-3p和MUT-MCM2),均用脂质体法转染至肺癌A549细胞;运用qRT-PCR检测miR-489-3p和MCM2mRNA的表达水平;CCK-8法检测细胞增殖;流式细胞术检测细胞凋亡;Western印迹检测蛋白表达;双荧光素酶报告基因检测实验检测细胞的荧光活性。结果:相较于正常肺上皮细胞BEAS-2B,肺癌细胞A549、H1299、SPC-A1中miR-489-3p表达水平均显著降低,MCM2mRNA和蛋白表达水平显著升高(P<0.05)。miR-489-3p过表达、MCM2抑制表达均可抑制A549细胞增殖活力,促进细胞凋亡;抑制细胞周期蛋白(Cyclin)D1、B细胞淋巴瘤(Bcl)-2蛋白表达水平,促进p21、裂解的半胱氨酸天冬氨酸蛋白酶(cleavedcaspase)-3、Bcl-2相关x蛋白(Bax)蛋白表达。miR-489-3p可靶向调控MCM2表达;MCM2过表达逆转了miR-489-3p过表达对肺癌A549细胞增殖抑制和凋亡促进的作用。结论:miR-489-3p可抑制肺癌A549细胞的增殖、促进其凋亡,其机制可能与靶向MCM2有关,将可为肺癌的预防和治疗提供新靶点。
【关键词】miR-489-3p;MCM2;肺癌;增殖;凋亡
[中图分类号]R734.2 [文献标识码]A [文章编号]1005-9202(2020)14-3064-06
肺癌是世界上死亡率和发病率都非常高的恶性肿瘤,呈逐年上升趋势,其中非小细胞肺癌NSCLC)占绝大多数[1]。而传统的手术和放化疗对肺癌的治疗有一定的局限性和毒副作用,靶向治疗可以针对某一特定位点直接杀死肺癌细胞或抑制其生长,疗效好,副作用少,可用于治疗肺癌,而更多的特定靶点是靶向治疗急需的[2]。微小RNA(miR-NA)是一类长约22个碱基的非编码RNA小分子,miRNA参与了细胞的分化、增殖、存活等调节过程,其异常表达与肺癌的发生、发展和预后及耐药密切相关,miRNA可作为肺癌诊断标志及治疗的特异性靶点[3,4]。miR-489-3p作为一种miRNA,研究发现miR-489-3p通过激活磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)途径抑制神经元的增殖并促进细胞凋亡[5]。miR-489在膀胱癌组织和细胞系中低表达,miR-489过表达抑制人膀胱癌细胞的增殖和侵袭[6]。微小染色体维持蛋白(MCM)2是细胞增殖相关因子,只在处于细胞周期的细胞中表达,成熟和静止期的细胞不表达,NSCLC中MCM2高表达,细胞具有更高增殖活性,MCM2反映NSCLC细胞的增殖能力,对判断NSCLC的发展及预后具有一定的临床意义,为NSCLC的靶向治疗提供了潜在的靶点[7]。敲低MCM2抑制细胞周期蛋白D1和周期素依赖性激素(CDK)4表达,增加p21和p53表达,表明MCM2沉默引发细胞周期停滞,且还诱导细胞亡[8]。MCM2在结直肠癌中也高表达,且与淋巴结转移,浸润深度和Dukes分期呈正相关[9]。但miR-489-3p在肺癌细胞中的表达及其对肺癌细胞增殖和凋亡的影响,且miR-489-3p是否通过靶向调控MCM2的表达影响肺癌细胞的增殖和凋亡目前还尚未可知。本实验旨在研究miR-489-3p对肺癌细胞增殖和凋亡的影响及其作用机制与MCM2是否相关。
1、材料与方法
1.1材料与试剂肺癌细胞A549、H1299、SPC-A1和正常肺上皮细胞BEAS-2B均购自中国科学院上海细胞库。胎牛血清(FBS)、RPMI1640培养基均购自美国Gibco公司;RNA提取试剂盒、反转录试剂盒和qPCR试剂盒购自日本Takara公司;Lipofectami-neTM2000转染试剂盒购自美国Invitrogen公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;二喹啉甲酸(BCA)试剂盒、细胞计数试剂盒(CCK)-8、膜联蛋白V-异硫氰酸荧光素(AnnexinVFITC)和碘化丙锭(PI)试剂盒购自碧云天生物技术研究所;细胞板、酶标仪购自赛默飞公司。
1.2细胞培养肺癌细胞A549、H1299、SPC-A1和正常肺上皮细胞BEAS-2B用含10%FBS的RP-MI1640培养基,置于37℃,含5%CO2恒温箱培养,每2~3d传代一次,取对数生长期细胞用于实验。
1.3细胞转染和分组取常规培养的肺癌A549细胞消化后接种于96孔板中,待细胞生长至80%融合,更换为无血清培养基,继续培养12h,随后进行转染。转染分为miR-NC组(转染miR-NC)、miR-489-3p组(转染miR-489-3pmimics)、si-NC组(转染si-NC)、si-MCM2组(转染si-MCM2)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-489-3p组(转染anti-miR-489-3p)、miR-489-3p+pcDNA组(共转染miR-489-3p和pcDNA)、miR-489-3p+pcDNA-MCM2组(共转染miR-489-3p和pcDNA-MCM2),转染按照LipofectamineTM2000试剂盒进行操作。
1.4qRT-PCR分析miR-489-3p及MCM2mRNA表达水平按照Trizol说明书提取总RNA,用反转录试剂盒逆转录成cDNA,按照AceQqPCRSYBRGreenMix说明书进行qRT-PCR方法扩增。循环条件为95℃30s,60℃30s;72℃30s,共40个循环;60℃延长5min。相对表达量采用2-△△Ct法计算。
1.5Western印迹检测蛋白表达收集各组细胞,加入放射免疫沉淀法(RIPA)裂解液裂解,4℃,12000r/min离心15min,收集蛋白上清液,用BCA蛋白定量试剂盒进行蛋白定量。各组蛋白上样量60μg,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,经电转将蛋白转移至聚偏氟乙烯(PVDF)膜上。用5%脱脂牛奶室温封闭90min,分别加入相应的一抗,4℃孵育过夜,磷酸盐缓冲液(PBS)洗涤3次,每次5min;再加入相对应的二抗室温孵育2h,PBS洗涤3次,每次10min,后在暗室中曝光显影,再浸入定影,最后洗去残液晾干,将胶片用QuantityOne凝胶分析软件处理,测定各组蛋白条带的吸光度,以目的条带和GAPDH条带的比值作为蛋白表达水平。
1.6CCK-8法测定肺癌细胞增殖在各组细胞培养至24、48、72h时每孔加入10μlCCK-8试剂继续孵育2h。酶标仪测定各孔490nm波长处OD值。细胞增殖活力(%)=实验组OD值/空白对照组OD值×100%,每组重复3次取平均值。
1.7流式细胞术检测细胞凋亡用不含乙二胺四乙酸(EDTA)的胰酶消化各组细胞,离心收集各组细胞,PBS漂洗2次,加结合缓冲液重悬细胞。依据试剂盒说明书,先后加入AnnexinV-FITC和PI避光孵育。流式细胞仪检测激发波长488nm和发射波长530nm处的荧光强度。实验重复3次。
1.8荧光素酶报告基因检测实验检测miR-489-3p对MCM2的靶向调控TargetScan数据库显示MCM23'非编码区域(UTR)有miR-489-3p结合位点。构建野生型(WT)和突变型(MUT)基因靶点MCM2的3'UTR-荧光素酶表达载体(WT-MCM2和MUT-MCM2),取对数生长期肺癌A549细胞接种于24孔板(5×104个/孔),待细胞生长至80%融合时,用LipofectamineTM2000将WT-MCM2和MUT-MCM2组细胞分别转染miR-NC和miR-489-3p。依据说明书要求,使用荧光素酶报告基因检测仪进行双荧光素酶报告实验测定。实验结果以荧光素酶活性和Renilla活性的比值进行统计学分析。实验重复3次。
1.9统计学分析采用SPSS20.0软件进行t检验,方差分析。
2、结果
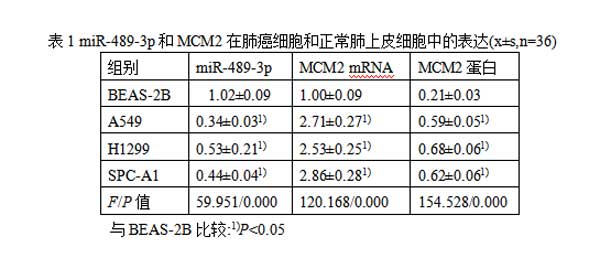
2.1miR-489-3p和MCM2在肺癌细胞和正常肺上皮细胞中的表达相较于正常肺上皮细胞BEAS-2B,肺癌细胞A549、H1299、SPC-A1中miR-489-3p的表达水平显著降低,MCM2mRNA的表达水平显著升高(P<0.05)。与正常肺上皮细BEAS-2B相比,肺癌细胞A549、H1299、SPC-A1中MCM2蛋白的表达水平显著升高(P<0.05)。见图1,表1。

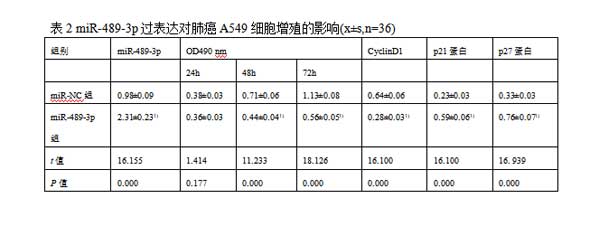
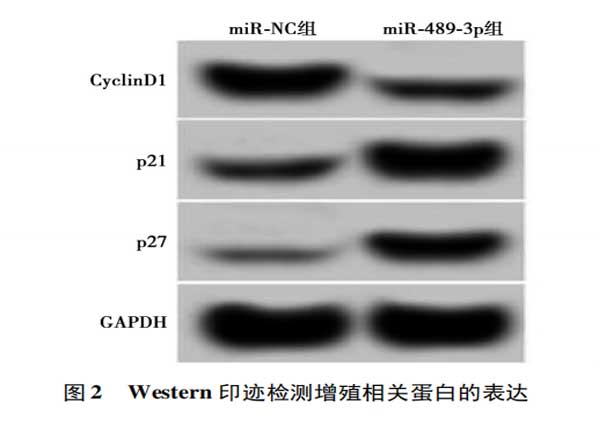
2.2miR-489-3p过表达对肺癌A549细胞增殖的影响与miR-NC组比较,miR-489-3p组A549细胞中miR-489-3p的表达水平均显著升高(P<0.05)。与miR-NC组相比,miR-489-3p组A549细胞中细胞周期蛋白(Cyclin)D1表达水平显著降低,p21、p27蛋白表达水平显著升高(P<0.05)。与miR-NC组比较,miR-489-3p组A549细胞的活力在48h和72h时显著降低(P<0.05)。见图2,表2。
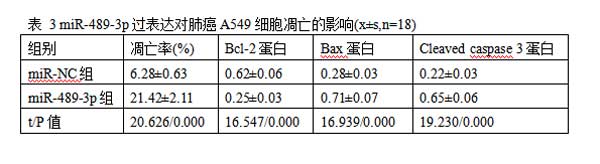
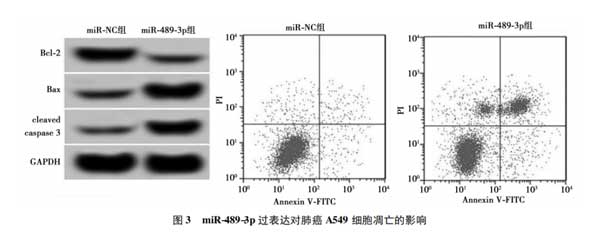
2.3miR-489-3p过表达对肺癌A549细胞凋亡的影响与miR-NC组相比,miR-489-3p组A549细胞中B细胞淋巴瘤(Bcl)-2蛋白表达水平显著降低,裂解的半胱氨酸天冬氨酸蛋白酶(cleavedcaspase)-3、Bcl-2相关X蛋白(Bax)蛋白表达水平显著升高(P<0.05)。与miR-NC组比较,miR-489-3p组A549细胞的凋亡率显著升高(P<0.05)。见图3,表3。
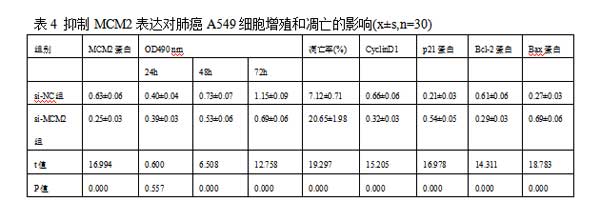
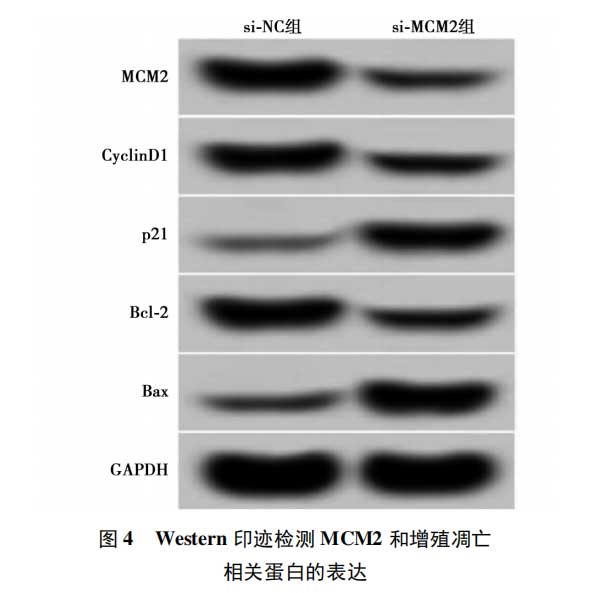
2.4抑制MCM2表达对肺癌A549细胞增殖和凋亡的影响与si-NC组比较,si-MCM2组A549细胞中MCM2、CyclinD1、Bcl-2蛋白表达水平均显著降低,p21、Bax蛋白表达水平均显著升高(P<0.05)。与si-NC组相比,si-MCM2组A549细胞活力在48h和72h时显著降低(P<0.05)。与si-NC组相比,si-MCM2组A549细胞的凋亡率显著升高(P<0.05)。可见,抑制MCM2表达抑制肺癌A549细胞增殖,促进细胞凋亡。见表4,图4。
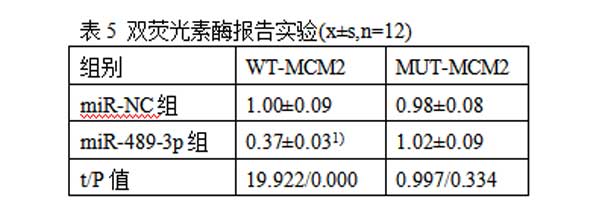
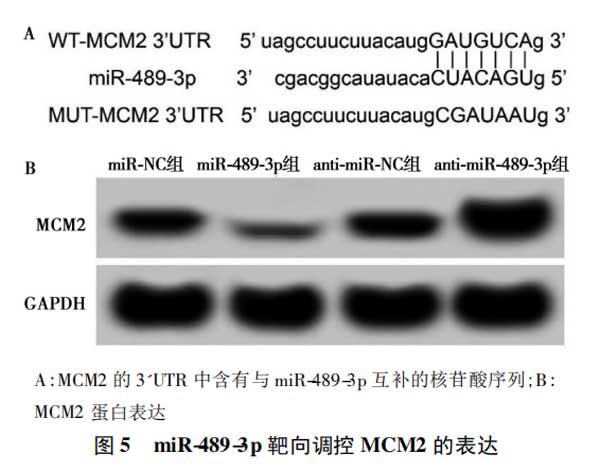
2.5miR-489-3p靶向调控MCM2的表达(TargetScan在线软件)通过TargetScan数据库预测到MCM2与miR-489-3p存在结合位点(图5A)。与miR-NC组比较,miR-489-3p组WT-MCM2肺癌细胞的荧光素酶活性显著降低(P<0.05)。见表5。Western印迹检测结果显示,与miR-NC组(0.58±0.05)比较,miR-489-3p组肺癌细胞中MCM2的表达水平(0.22±0.03)显著降低;而与anti-miR-NC组(0.56±0.04)比较,anti-miR-489-3p组肺癌细胞中MCM2的表达水平显著升高(0.93±0.09,P<0.05)。见图5B。
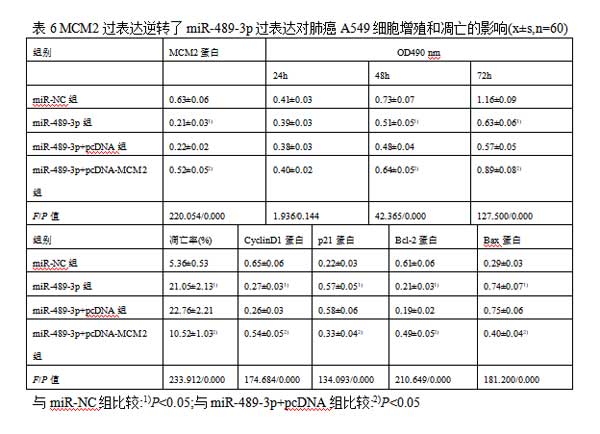
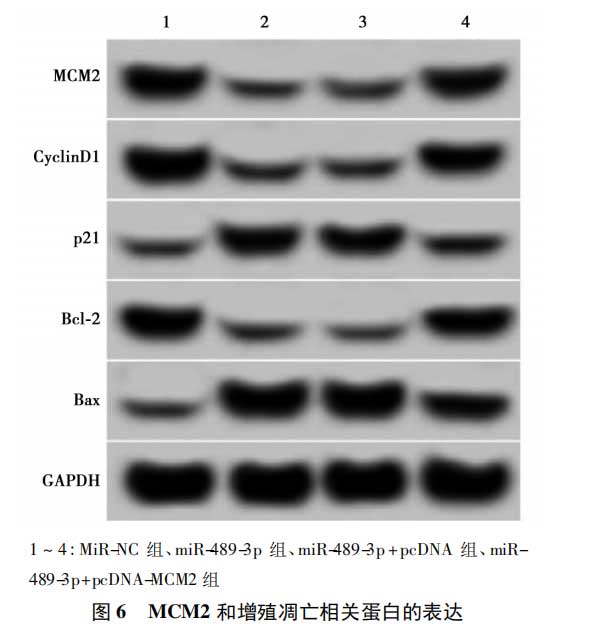
2.6MCM2过表达逆转了miR-489-3p过表达对肺癌A54细胞增殖和凋亡的影响与miR-NC组相比,miR-489-3p组A549细胞中MCM2、CyclinD1、Bcl-2蛋白表达水平显著降低,p21、Bax蛋白表达水平显著升高(均P<0.05);而与miR-489-3p+pcDNA组相比,miR-489-3p+pcDNA-MCM2组A549细胞中MCM2、CyclinD1、Bcl-2蛋白表达水平显著升高,p21、Bax蛋白表达水平显著降低(均P<0.05)。与miR-NC组相比,miR-489-3p组A549细胞活力在48h和72h时显著降低;与miR-489-3p+pcDNA组相比,miR-489-3p+pcDNA-MCM2组A549细胞活力在48h和72h时显著升高(均P<0.05)。与miR-NC组相比,miR-489-3p组A549细胞凋亡率显著升高;与miR-489-3p+pcDNA组相比,miR-489-3p+pcDNA-MCM2组A549细胞凋亡率显著降低(均P<0.05)。见图6,表6。
3、讨论
肺癌是目前最常见的恶性肿瘤之一,其发病机制之一可能源于致癌启动基因的突变,因此,针对基因突变的靶向药物治疗的出现为肺癌治疗提供了新的方向和新思路[10]。miRNA与肺癌细胞的增殖、凋亡,侵袭转移及耐药性等密切相关,通过调控相应靶基因的表达和多种信号通路,参与了肺癌的发生发展,可作为靶向治疗靶点[11]。miR-489-3p在多种肿瘤细胞中下调表达,过表达可抑制肿瘤生长,是一种抑癌因子;有研究报道miR-489-3p在骨肉瘤细胞中下调表达,通过下调PAX3的表达抑制骨肉瘤细胞的侵袭和转移[12]。miR-489-3p过表达还可抑制胶质瘤细胞的增殖和侵袭[13]。miR-489-3p通过调节Wnt/β-catenin信号通路能抑制宫颈癌细胞的迁移和侵袭[14]。此外,miR-489-3p还可以预防缺血性肾损伤[15]。本实验结果显示,miR-489-3p在肺癌细胞中同样低表达,miR-489-3p过表达可抑制Cy-clinD1、Bcl-2蛋白表达水平,促进p21、cleavedcaspase-3、Bax蛋白表达;抑制A549细胞增殖活力,促进细胞凋亡。
MCM蛋白家族是DNA复制中的必需因子,起关键作用,lnc-FTX与DNA复制许可因子MCM2结合,可阻碍DNA复制并抑制肝癌细胞增殖[16]。MCM2是非小细胞肺癌患者生存的独立预测因子[17]。乳腺肿瘤组织中MCM2mRNA和蛋白表达水平均高,且随着肿瘤恶性程度的升高呈逐渐增高趋势[18];MCM2在子宫内膜癌组织中高度表达,与肿瘤的分期、分化程度、淋巴结转移密切相关[19]。MCM2的高表达还与大肠癌肝脏转移呈正相关[20]。本研究结果显示,肺癌细胞中MCM2也显著高表达,抑制MCM2表达可抑制CyclinD1、Bcl-2蛋白表达水平,促进p21、cleaved caspase-3、Bax蛋白表达;抑制肺癌A549细胞增殖活力,促进细胞凋亡。而且miR-489-3p可靶向调控MCM2;MCM2过表达还逆转了miR-489-3p过表达对肺癌A549细胞增殖抑制和凋亡促进的作用。以上结果表明,miR-489-3p可能通过调控MCM2影响肺癌细胞的增殖和凋亡。
参考文献
[1]陈诺,石毓君。肺癌发病、诊断及治疗相关研究进展[J]。世界最新医学信息文摘,2018;18(6):114-6。
[2]周杨,董佑红。肺癌药物靶向治疗的研究进展[J]。中国老年学杂志,2017;37(13):3357-60。
[3]冯涛,肖向茜,盛望。miRNA在肺癌及肺癌耐药中的作用机制及治疗的研究进展[J]。医学综述,2018;24(1):61-5。
[4]王新颖,顾玉海。miRNA在肺癌诊断、治疗及预后判断中的应用进展[J]。山东医药,2017;57(31):108-11。
[5]Jiang R,Zhang C,Gu R,et al.MicroRNA-489-3p inhibits neurite growth by regulating PI3K/AKT pathway in spinal cord injury[J].Pharmazie,2017;72(5):272-8.
[6]Li J,Qu W,Jiang Y,et al.miR-489 suppresses proliferation and inva-sion of human bladder cancer cells[J].Oncol Res,2016;24(6):391-8.
[7]陈玉,聂秀红,支修益,等.微小染色体维持蛋白2在非小细胞肺癌的表达及其预后意义[J]。肿瘤研究与临床,2010;22(1):29-31。
[8]Zhang X,Teng Y,Yang F,et al.MCM2 is a therapeutic target of lovastatin in human non-small cell lung carcinomas[J].Oncol Rep,2015;33( 5):2599-605.
[9]Wang FR,Zhao CR,Yuan XX,et al.Expression of E2F3,MCM2 and HIF-1α in colorectal carcinoma[J].World Chin J Digestol,2011;19(21):2292-6.
[10]杨瑜.肺癌靶向药物治疗研究进展[J].中国药师,2019;22(1):144-7。
[11]蒋丽媛,卢忠心,宁勇.微小RNA参与肺癌发生发展的研究进展[J].湖北中医药大学学报,2018;20(2):119-23。
[12]Liu Q,Yang G,Qian Y.Loss of MicroRNA-489-3p promotes osteo-sarcoma metastasis by activating PAX3-MET pathway[J].Mol Car-cinog,2016;56(4):1312-21.
[13]Li Z,Qin W,Fei W,et al.LncRNA LINC01446 promotes glioblastoma progression by modulating miR-489-3p/TPT1 axis[J].Biochem Biophys Res Commun,2018;503(3):1484-90.
[14]Pan Y,Dai J,Liao Y,et al.MiR-489-3p inhibits cervical cancer cell migration and invasion through regulating Wnt/β-catenin signaling pathways[J].Int J Clin Exp Pathol,2017;10(1):290-7.
[15]Wei Q,Liu Y,Liu P,et al.MicroRNA-489 induction by hypoxia-in-ducible factor-1 protects against ischemic kidney injury[J].J Am Soc Nephrol,2016;27(9):2784-96.
[16]Liu F,Yuan JH,Huang JF,et al.Long noncoding RNA FTX inhibits hepatocellular carcinoma proliferation and metastasis by binding MCM2 and miR-374a[J].Oncogene,2016;35(41):5422-34.
[17]Ramnath N,Hernandez FJ,Tan DF,et al.MCM2 is an independent predictor of survival in patients with non-small-cell lung cancer[J].J Clin Oncol,2001;19(22):4259-66.
[18]程甜甜,杨贤子,骆志国。MCM2基因和蛋白在乳腺癌组织中的表达及其临床意义[J]。实用癌症杂志,2014;29(9):1067-9。
[19]张红.MCM2蛋白在子宫内膜癌中的表达及意义[D]。石家庄:河北医科大学,2012。
[20]黄元哲.MCM2在大肠癌肝转移中的表达及意义[D]。苏州:苏州大学,2014。
(中国老年学杂志2020年7月第40卷)
