发布时间:2020年11月11日 08:55:42 来源:振东健康网
延敏博1,练文飞1,黄书畅1,程文杰1,路静2,戴英波1
1中山大学附属第五医院泌尿外科,广东珠海
2中山大学附属第五医院消化内科,广东珠海
【摘要】目的:探讨程序性死亡配体-1(Programmed cell death-ligand1,PD-L1)及程序性死亡受体-1(Pro-grammed cell death-1,PD-1)在前列腺癌中的表达水平,及其与前列腺癌临床病理特征的相关性。方法:收集2014年2月至2018年10月在中山大学附属第五医院泌尿外科进行前列腺癌根治术,并经术后病理确诊的前列腺癌组织63例,另取癌旁2cm外前列腺组织为正常对照组。用免疫组化法检测PD-L1和PD-1在前列腺癌及正常前列腺组织中的表达情况,并分析二者的表达与前列腺癌临床病理特征的关系。结果:63例前列腺癌组织中,PD-L1和PD-1的阳性表达均明显增高,而正常前列腺组织中未检测到PD-L1和PD-1表达(P=0.000);有淋巴结转移的前列腺癌组织中PD-L1和PD-1的表达明显高于无淋巴结转移组(PD-L1:75.00%vs35.29%;PD-1:66.67%vs33.33%,均P<0.05);有骨结转移组PD-L1和PD-1的表达也高于无骨转移组(PD-L1:75.00%vs38.18%;PD-1:75.00%vs34.55%,均P<0.05)。结论:PD-L1和PD-1在前列腺癌中的高表达与患者局部或远处转移密切相关,可能参与了前列腺癌的免疫逃逸。
【关键词】前列腺癌,PD-L1,PD-1
Expressions and Clinical Significance of PD-L1 and PD-1 in Prostate Cancer
Minbo Yan1, Wenfei Lian1, Shuchang Huang1, Wenjie Cheng1, Jing Lu2*, Yingbo Dai1
1Department of Urology, The Fifth Affiliated Hospital of Sun Yat-sen University, Zhuhai Guangdong
2Department of Gastroenterology, The Fifth Affiliated Hospital of Sun Yat-sen University, Zhuhai Guangdong
Received: May 27th, 2019; accepted: Jun. 11st, 2019; published: Jun. 18th, 2019
【Abstract】Objective: To explore the expressions of programmed cell death-ligand 1 (PD-L1) and pro- grammed cell death-1 (PD-1) in prostate cancer (PCa), and the correlation between PD-L1/PD-1 expressions with the clinical pathological features of PCa. Methods: Data of 63 patients who un- derwent radical prostatectomy in Department of Urology, the Fifth Affiliated Hospital of Sun Yat-sen University with PCa diagnosed by postoperative pathology from February 2014 to October 2018 were collected. We took normal prostate tissue 2 cm away from prostate cancer as a control group. The expressions of PD-L1 and PD-1 in PCa and normal prostate tissues were detected by immunohistochemistry, and the correlation between them with the clinical pathological features of PCa was analyzed. Results: The positive expressions of PD-L1 and PD-1 were significantly increased in 63 PCa tissues, while the expression of PD-L1 and PD-1 was not detected in normal prostate tis- sues (P = 0.000). The expressions of PD-L1 and PD-1 in lymph node metastasis group were signifi- cantly higher than those without lymph node metastasis (PD-L1: 75.00% vs 35.29%; PD-1: 66.67% vs 33.33%, P < 0.05). The expressions of PD-L1 and PD-1 in the bone metastasis group were also higher than that in the non-bone metastasis group (PD-L1: 75.00% vs 38.18%; PD-1: 75.00% vs 34.55%, P < 0.05). Conclusion: The high expressions of PD-L1 and PD-1 in PCa are closely related to local or distant metastasis of patients, and may be involved in immune escape of PCa.
【Keywords】Prostate Cancer, PD-L1, PD-1
1、引言
前列腺癌是男性泌尿生殖系统最常见的肿瘤之一,近年来,前列腺癌的免疫治疗成为了新的研究热点[1]。程序性死亡配体-1(PD-L1)是近年来发现与肿瘤免疫逃逸密切相关的重要免疫抑制分子[2],其与受体程序性死亡因子-1(PD-1)结合后,在T细胞免疫应答的初始阶段和效应阶段均可抑制T细胞的活化[3][4],从而抑制T细胞介导的免疫应答。近年来,D-L1和PD-1参与的免疫逃逸,及其免疫学机制引起了恶性肿瘤研究领域的广泛关注,但他们在前列腺癌中的作用尚未确定。本研究中我们应用免疫组织化学法检测PD-L1和PD-1在前列腺癌组织中的表达情况,并探讨其临床意义。
2、资料与方法
2.1.临床资料
收集2014年2月至2018年10月在中山大学附属第五医院泌尿外科行前列腺癌根治术,并经术后病理证实为前列腺腺癌的肿瘤组织63例,另取癌旁2cm外前列腺组织为正常对照组。纳入标准:术前诊断为前列腺癌,于我院行前列腺癌根治术(术式不限),术后病理证实术前诊断。排除标准:术前行放化疗者;术后病理排除前列腺癌者。本研究已通过医院伦理委员会审核,所有患者均充分知情告知,并签署知情同意书。
患者年龄56~78岁,平均68岁。根据PSA不同分成三组,PSA<10ng/ml者14例,10~20ng/ml者26例,>20ng/ml者23例。临床分期按2017AJCC标准分为三组:T2期38例,T3期20例,T4期5例。术后病理根据Gleason评分不同分为三组,≤6分12例,7分19例,>7分32例。其中有淋巴结转移者12例,有骨转移者8例,术前行新辅助内分泌治疗者11例。
2.2.主要试剂
鼠抗PD-1(NAT)抗体一抗、兔抗PD-L1(SP142)抗体二抗、即用型快速免疫组化MaxVisionTM检测试剂盒、DAB显色试剂盒均购自福州迈新生物技术开发有限公司。
2.3.免疫组化检测PD-L1和PD-1在前列腺癌及正常前列腺组织中的表达水平所有标本经4%多聚甲醛固定,石蜡包埋制备,连续切片厚约4μm,切片常规脱腊至水,每张组织切片上滴加过氧化物酶阻断剂,室温下孵育10min,PBS冲洗3次,滴加1滴配置好的一抗,各抗体的工作滴度为:鼠抗PD-1(NAT)抗体(MAB-06540.2ml,1:20),兔抗PD-L1(SP142)抗体(RAB-07240.2ml,1:40);PBS冲洗3次,每张切片上滴加50μlMaxVisionTM试剂,室温下孵育15min,每张切片上滴加两滴新鲜配制的DAB显色试剂显色。自来水反复冲洗,复染,脱水,透明,封片。所有切片均在同一条件下同一批次内完成免疫组织化学染色。PBS代替一抗作为阴性对照。
2.4.免疫组化结果判读
PD-L1和PD-1的阳性显色是指细胞膜或细胞质中出现黄至棕褐色颗粒者[5]。在高倍镜下(400倍)随机观察3个不连续视野,计算阳性细胞占细胞总数百分比,并结合阳性细胞表达强度对表达情况进行评分。阳性细胞百分比分级为:阳性细胞率≤10%为1分,11%~50%为2分,>50%为3分;染色强度分级如下:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;两项评分的乘积>3分为阳性表达。细胞质或细胞膜上任一项阳性均为阳性表达;癌细胞或癌间质浸润淋巴细胞上任一项阳性,该标本也为阳性表达。所有肿瘤标本的免疫组化切片均由2名资深病理科医生双盲独立观察。
2.5.统计学处理
采用SPSS13.0统计软件进行分析,两组间PD-L1和PD-1表达水平的比较,及PD-L1和PD-1表达情况与患者临床特征的关系分析采用χ2检验,以P<0.05或P<0.01表示差异有统计学意义。
3、结果
3.1.PD-L1和PD-1在前列腺癌及正常前列腺组织中的表达
63例前列腺癌组织中,PD-L1和PD-1的阳性表达分别为27例(42.86%)和25例(39.68%),而正常前列腺组织中PD-L1和PD-1均呈阴性表达。两组比较差异均有显著的统计学意义(P=0.000,P=0.000)。
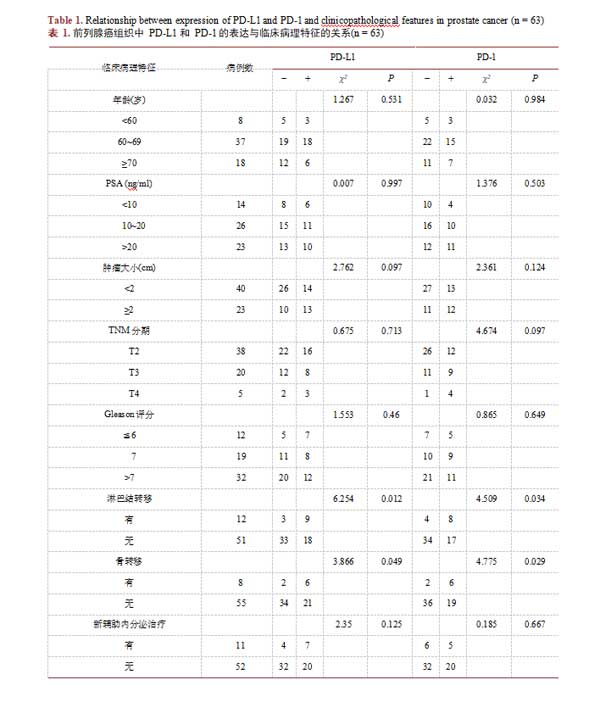
3.2.PD-L1和PD-1的表达与前列腺癌临床病理特征的关系
有淋巴结转移的前列腺癌组织中PD-L1和PD-1的表达明显高于无淋巴结转移组(PD-L1:75.00%vs35.29%;PD-1:66.67%vs33.33%,均P<0.05);有骨结转移组PD-L1和PD-1的表达也高于无骨转移组(PD-L1:75.00%vs38.18%;PD-1:75.00%vs34.55%,均P<0.05);这提示PD-L1和PD-1在前列腺癌中的表达与患者有无局部或远处转移密切相关。而前列腺癌中PD-L1和PD-1的表达与患者年龄、肿瘤大小、PSA水平、Gleason评分、临床分期以及是否接受新辅助内分泌治疗无明显相关性(P>0.05)(表1)。
4、讨论
前列腺癌在全球发病率占男性恶性肿瘤第二位,全球病死率占恶性肿瘤的第五位,虽然前列腺癌在早期通过手术或放射治疗可治愈,但许多局部晚期或转移性疾病患者仍然无法治愈[6][7]。近年来,关于前列腺癌的免疫机制研究成为了新的热点。
T细胞介导的细胞免疫是机体抗肿瘤免疫的主要形式之一。肿瘤免疫应答的产生需要免疫系统有效识别和提呈肿瘤抗原,并活化特异性T细胞,从而产生免疫杀伤作用。而肿瘤细胞往往可以通过异常表达和(或)缺如某些免疫分子,使特异性T细胞处于无反应或免疫耐受状态,甚至导致T细胞凋亡,从而逃避机体的免疫杀伤作用,即发生免疫逃逸现象[8]。
程序性死亡配体1(Programmed death-ligand1,PD-L1)是共刺激分子B7家族的新成员,它是一种I型跨膜糖蛋白,含290个氨基酸,由细胞外区、疏水跨膜区及含30个氨基酸的细胞质区组成,它是最近新被发现的与肿瘤免疫逃逸密切相关的抑制性共刺激分子[9],正常情况下主要表达于活化的单核细胞和DCs表面[10]。而近期大量研究表明,PD-L1在癌症中的过度表达与这些恶性肿瘤的不良预后和抵抗抗癌治疗有关;包括肺、肝、结肠直肠、胰腺、乳腺、宫颈、鼻咽部、食管、肾、皮肤等[11][12][13][14][15]等。
程序性死亡蛋白1(Programmed cell death1,PD-1)是PD-L1的受体,属于CD28超家族成员,主要表达于活化的T细胞表面,其与PD-L1结合后,可以提供抑制性信号抑制T细胞的活化,诱导活化T细胞凋亡[16][17],从而抑制T细胞介导的免疫应答。有研究证实,在多种恶性肿瘤中PD-1/PD-L1免疫检查点可传递抑制性信号,通过抑制T细胞的活化致使肿瘤免疫耐受导致免疫逃逸的发生[18]。因此我们推测:前列腺癌细胞也可通过表达PD-L1抑制肿瘤周围微环境中的免疫T细胞,产生免疫逃逸,促进肿瘤的复发和进展。
在本研究中,我们应用免疫组化法检测PD-L1和PD-1在前列腺癌及正常前列腺组织中的表达情况,并分析PD-L1和PD-1的表达与前列腺癌临床病理特征的关系。结果提示,63例前列腺癌组织中,PD-L1和PD-1的阳性表达均明显增高(P=0.000,P=0.000);在前列腺癌的临床病理特征相关因素分析中,PD-L1和PD-1在有淋巴结转移或骨转移组的表达均明显高于无淋巴结或骨转移组(均P<0.05);而在年龄、PSA水平、肿瘤大小、TNM分期、Gleason评分及有无新辅助内分泌治疗方面两组比较无明显统计学差异。这提示PD-L1和PD-1在前列腺癌中的表达与患者有无局部或远处转移密切相关。
YangS等[19]研究发现,PD-1、PD-L1和PD-L2的表达可以通过建立免疫抑制肿瘤微环境来增强小鼠前列腺癌的发展。GraffJN等[20]使用抗PD-1抗体pembrolizumab对mCRPC患者进行治疗(200mg,IV,每3周治疗4次),结果产生了意想不到的抗肿瘤活性,有3例患者前列腺特异抗原(PSA)快速降低至≤0.2ng/ml。这提示PD-1可能在前列腺癌的发生中起重要作用。这些均与我们的研究结果相符合。
综上所述,我们认为,PD-L1和PD-1在T细胞免疫应答的初始阶段亦参与了前列腺癌免疫逃逸的发生,这对于探索前列腺癌浸润转移的原因,并在此基础上寻求前列腺癌免疫治疗的新策略有着重要意义。而PD-L1和PD-1表达上调的具体机制尚有待进一步的深入研究。
参考文献
[1]Modena, A.Ciccarese, C.Iacovelli, R., et al. (2016) Immune Checkpoint Inhibitors and Prostate Cancer: A New Frontier? Oncology Reviews, 10, 293.
[2]Chemnitz, J.M.Parry, R.V.Nichols, K.E.June, C.H. and Riley, J.L. (2004) SHP-1 and SHP-2 Associate with Im- munoreceptor Tyrosine-Based Switch Motif of Programmed Death 1 Upon Primary Human T Cell Stimulation, but Only Receptor Ligation Prevents T Cell Activation. The Journal of Immunology, 173, 945-954.
[3]Fife, B.T.Guleria, I.Gubbels Bupp, M.et al. (2006) Insulini-Induced Remission in New-Onset NOD Mice Is Maintained by the PD-1-PD-L1 Pathway. The Journal of Experimental Medicine, 203, 2737-2747.
[4]Tsushima, F.Yao, S.Shin, T.et al. (2007) Interaction between B7-H1 and PD-1 Determines Initiation and Reversal of T-Cell Anergy. Blood, 110, 180-185.
[5]Mountzios, G.Linardou, H. and Kosmidis, P. (2016) Immunotherapy in Non-Small Cell Lung Cancer: The Clinical impact of Immune Response and Targeting. Annals of Translational Medicine, 4, 268.
[6]Albertsen, P. (2008) Predicting Survival for Men with Clinically Localized Prostate Cancer: What Do We Need in Contemporary Practice? Cancer, 112, 1-3.
[7]So, A., Gleave, M.Hurtado-Col, A. and Nelson, C. (2005) Mechanisms of the Development of Androgen Independence in Prostate Cancer. World Journal of Urology, 23, 1-9.
[8]Gajewski,T.F.Meng,Yand Harlin,H. (2006) Immune Suppression in the Tumor Microenvironment.Journal of Immunotherapy, 29, 233-240.
[9]Dong, H., Strome, S.E., Salomao, D.R., et al. (2002) Tumor-Associated B7-H1 Promotes T-Cell Apoptosis: A Potential Mechanism of Immune Evasion. Nature Medicine, 8, 793-800.
[10]Keir, M.E.Butte, M.J.Freeman, G.J. and Sharpe, A.H. (2008) PD-1 and Its Ligands in Tolerance and Tolerance and Immunity. Annual Review of Immunology, 26, 677-704.
[11]Wang, L.Ma, Q.Chen, X.et al. (2010) Clinical Significance of B7-H1 and B7-1 Expressions in Pancreatic Carcinoma. World Journal of Surgery, 34, 1059-1065.
[12]Hasan, A.Ghebeh, H.Lehe, C.Ahmad, R. and Dermime, S. (2011) Therapeutic Targeting of B7-H1 in Breast Can cer. Expert Opinion on Therapeutic Targets, 15, 1211-1225.
[13]Karim, R.Jordanova, E.S., Piersma, S.J.et al. (2009) Tumor-Expressed B7-H1 and B7-DC in Relation to PD-1+T-Cell Infiltration and Survival of Patients with Cervical Carcinoma. Clinical Cancer Research, 15, 6341-6347.
[14]Hsu, M.C.Hsiao, J.R.Chang, K.C.et al. (2010) Increase of Programmed Death-1-Expressing Intratumoral CD8 T Cells Predicts a Poor Prognosis for Nasopharyngeal Carcinoma. Modern Pathology, 23, 1393-1403.
[15]Loos, M.Langer, R., Schuster, T.et al. (2011) Clinical Significance of the Costimulatory Molecule B7-H1 in Barrett Carcinoma. The Annals of Thoracic Surgery, 91, 1025-1031.
[16]Seo, S.K., Seo, H.M., Jeon, H.Y.et al. (2006) Co-Inhibitory Role of T Cell Associated B7-H1 and B7-DC in the T-Cell Immune Response. Immunology Letters, 102, 222-228.
[17]Hinrichs, C.S.Spolski, R.Paulos, C.M., et al. (2008) IL-2 and IL-24 Confer-Opposing Differentiation Programs to CD8+T Cells for Adoptive Immunotherapy. Blood, 111, 5326-5333.
[18] 王永华. 共刺激分子 B7-H1 和 Fasl 在膀胱移行细胞癌免疫逃逸中的机制研究及临床意义[J]. 临床泌尿外科杂志, 2008, 23(9): 684-486.
[19]Yang, S.Zhang, Q., Liu, S., et al. (2016) PD-1, PD-L1 and PD-L2 Expression in Mouse Prostate Cancer. American Journal of Clinical and Experimental Urology, 4, 1-8.
[20]Graff, J.N.Alumkal, J.J.Drake, C.G.et al. (2016) Early Evidence of Anti-PD-1 Activity in Enzalutamide-Resistant Prostate Cancer. Oncotarget, 7, 52810-52817.
编译者按:
为了更好地反映国际前沿医学学术研究现状和趋势、使《振东学术》更好服务于医务工作者,振东文宣编辑部选取具有较高影响力的国际医学学术杂志,对其临床研究方面的最新文献进行编译。本文在2020年最新的美国医学期刊《科研广场》(Research Square)首次刊发。文献建立了基于双螺旋CT的一站式心脑综合扫描方案,适合心脑、放射、综合内科等科室人员阅读参考。《振东学术》杂志公众号还会持续推出国际前沿论文翻译。如对往期翻译内容感兴趣,欢迎扫描右侧二维码关注公众号“国际前沿医学论文翻译”;如有翻译内容推荐,也可通过此公众号联系振东文宣编辑部翻译特定领域文献。
