发布时间:2020年12月18日 08:56:46 来源:振东健康网
曾建昌1,刘艳2,杨俊1,李奔1,周翔1,陈丹1,李荣1,
姚驰1,杨柳1,刘君丽1,王楚明1,苏彦奇1,罗蓉1
(1、华中科技大学协和江北医院,湖北武汉,430100;2、武汉国药东风总医院,湖北武汉,442001)
【摘要】目的:本研究旨在探讨复方苦参注射液联合奥希替尼对肺腺癌细胞H1975的影响并探讨其具体作用机制。方法:使用生理盐水、复方苦参注射液、奥希替尼以及PI3K/AKT/mTOR信号通路抑制剂(BEZ235)对H1975细胞进行干预,MTT检测各组细胞活力,Transwell实验检测各组细胞侵袭,流式细胞术检测细胞凋亡情况。qRT-PCR和Westernblot检测各组细胞凋亡相关因子(Bax、Bcl-2)、上皮间质转化相关因子(E-cadherin、N-cadherin、Vimentin)的表达。结果:相对于NC组,复方苦参注射液、奥希替尼干预能够显著抑制H1975细胞的增殖、侵袭、诱导细胞凋亡且联合作用效果更显著(均P<0.05)。此外,BEZ235处理H1975细胞能够抑制细胞增殖、侵袭以及上皮间质转化,促进细胞凋亡且苦参注射液+奥希替尼+BEZ235共同作用效果更显著(均P<0.05)。结论:复方苦参注射液联合奥希替尼在抑制H1975细胞增殖、侵袭、诱导细胞凋亡方面具有较好作用,且该作用可能与抑制PI3K/AKT/mTOR通路的激活有关。
【关键词】复方苦参注射液;奥希替尼;PI3K/AKT/mTOR通路;肺腺癌
[中图分类号]R734.2 [文献标志码]A
Mechanism of compound sophora flavescens injection combined with Osimertinib in lung adenocarcinoma cell H1975 via PI3K/AKT/mTOR signaling pathway
Zeng Jianchang1,Liu Yan2,Yang Jun1,Li Ben1,Zhou Xiang1,Chen Dan1,Li Rong1,Yao Chi1,
Yang Liu1,Liu Junli1,Wang Chuming1,Su Yanqi1,Luo Rong1
(1.Xiehe Jiangbei Hospital of Huazhong University of Science and Technology,Hubei Wuhan,
430100;2.Wuhan Guoyao Dongfeng General Hospital,Hubei Wuhan,442001)
【Abstract】Purpose:The aim of the present research is to investigate the effect of Compound sophora flavescens injection combined with Osimertinib on lung adenocarcinoma cell H1975 and its specific mechanism.Methods:H1975 cells were intervened with normal saline,compoundsophora flavescens injection,Osimertinib,and PI3K/AKT/mTOR signaling pathway inhibitor(BEZ235).Then MTT,Transwell assay,and flow cytometry were employed to test cell proliferation activity,invasion,and apoptosis in each group respectively.qRT-PCR and Western blot were utilized to detect the expression of apoptosis-related factors (Bax,Bcl-2)and epithelial-mesenchymal transition(EMT)related factors(E-cadherin、N-cadherin、Vimentin)in each group.Results:Compared with NC group,the proliferation,invasion,and apoptosis of H1975 cells were inhibited significantly by the Compound sophora flavescens injection and Osimertinib.The Compound sophora flavescens injection in combination with Osimertinib had more significant effect on H1975(all P<0.05).In addition,H1975 cells administrated with BEZ235 showed lower proliferation,invasion and epithelial-mesenchymal transition ability but higher apoptosis rate,the combination of Compound sophora flavescens injection,Osimertinib and BEZ235 could provide better therapeutical effect.(all P<0.05).Conclusion:Based on the results observed during this study,the paper suggests that Compound sophora flavescens injection combined with Osimertinib have a quite satisfactory effect on inhibiting the proliferation,invasion and inducing apoptosis of H1975 cells,and this effect may through activating PI3K/AKT/mTOR pathway.
【Key words】compound sophora flavescens injection;Osimertinib;PI3K/AKT/mTOR pathway;lung Adenocarcinoma
肺腺癌是非小细胞肺癌的一种,该病主要起源于支气管粘膜上皮,早期无明显症状,手术、放射治疗以及药物治疗仍是当前针对肺腺癌治疗的主要手段[1]。奥希替尼为第三代表皮生长因子受体酪氨酸激酶抑制剂,该药已被证实在延长非小细胞肺癌患者生存期,减轻患者痛苦和疾病风险中效果显著,被广泛应用于非小细胞肺癌的治疗[2]。复方苦参注射液由中国 中医科学院中药所研制,主要由苦参和白土苓两味药组成,在清热利湿、凉血解毒、解结止痛,环节癌性疼痛、出血以及提升化疗效果以及免疫功能方面具有良好效果[3]。当前复方苦参注射液近年来被越来越多的应用于乳腺癌、结肠癌、肺癌等多种癌症的治疗中并且效果显著[4-6]。何敏等在研究中发现,复方苦参注射液联合顺铂、拓扑替康等能够显著减轻肺癌患者疼痛,提高机体免疫能力并减少不良反应的发生[7]。研究发现绝大多数非小细胞肺癌患者体内存在PI3K/AKT/mTOR通路激活的情况,PI3K/AKT/mTOR通路抑制剂联合免疫治疗等手段也被越来越多的应用于肺癌的治疗中[8-9]。现阶段奥希替尼联合中药处方治疗肺腺癌逐渐成为医疗领域的研究热点,但其具体作用机制仍有待探讨。本研究旨在分析复方苦参注射液联合奥希替尼对肺腺癌H1975细胞的影响及作用机制,为后续治疗奠定研究基础。现报告如下。
1、方法
1.1材料与试剂
H1975细胞由美国物种保留中心(Amer-ican Type Culture Collection,ATCC)提供,RPMI 1640培养基购自Invitrogen;Trizol试剂盒购自Gibco;RT-PCR试剂盒购自大连宝生物;PCR引物序列由华大基因合成;BCA蛋白定量试剂盒购自Sigma;Western blot中抗体购自ABCAM;MTT溶液、Matrigel基质胶购自北京索莱宝;Annexin V-FITC/PI双染试剂盒购自贝博生物;PI3K/AKT/mTOR通路抑制剂特异性抑制剂BEZ235购自Selleck。
1.2实验方法
1.2.1细胞分组 使用含有10%胎牛血清的培养液作为培养基,在5%CO2、37 ℃培养箱中进行培养,使用0.25%胰蛋白酶进行消化传代。之后将人肺腺癌H1975细胞分为如下组:阴性对照组(Negative control,NC组,生理盐水干预)、苦参注射液组(苦参注射液干预)、奥希替尼组(奥希替尼干预)、苦参注射液+奥希替尼组(苦参注射液+奥希替尼干预)、BEZ235组(PI3K/AKT/mTOR通路抑制剂干预)、苦参注射液+奥希替尼+BEZ235组(苦参注射液+奥希替尼+PI3K/AKT/mTOR通路抑制剂干预)。苦参注射液使用浓度为1mg/mL,奥希替尼为10 µmol/L,BEZ235溶于无菌二甲基亚砜(DMSO)配制为浓度为5 mmol/L的原液,使用前将原液用无血清培养基稀释至0.1 μmol/L。
1.2.2MTT细胞活力检测 将转染后的细胞接种至96孔板,每孔4×105个细胞,每组设置3个复孔。加入培养液进行培养,分别于培养24 h、48 h和72 h时换液并加入20 μL MTT溶液到每孔。孵育4 h后弃上清,加入100 μL Formanzan溶液后继续孵育4 h。最后借助酶标仪检测492 nm波长下的各孔吸光度值。
1.2.3Transwell实验 按照1:10的比例将Matrigel胶用无血清DMEM培养基进行稀释,之后于上室加入100 μL Matrigel胶,重悬细胞后稀释细胞浓度至3×105个/mL将100 μL细胞加入上室,于Transwell下室加入600 μL DMEM培养基(含10%血清),依据Transwell说明书进行结晶紫染色。染色结束后于光学显微镜下观察染色结果,计算侵袭细胞数目。
1.2.4Annexin V-FITC/PI双染法 采用Annexin V-FITC/PI双染试剂盒检测 MKN-45细胞凋亡情况,实验步骤如下:PBS洗涤细胞,以2000 r/min转速离心5 min,加入500 µL结合缓冲液,调整细胞密度为4×105个/mL,加入5 µL Annexin V-FITC并混匀,避光室温温育10 min。之后加入5 µL的PI并混匀,于5min内上流式细胞仪进行检测。激发波长为480 nm,530 nm检测FITC,大于575 nm检测PI。
1.2.5qRT-PCR检测 Trizol试剂盒一步法提取总RNA,取3 μg总RNA,用M-MLV逆转录酶进行反转录。SYBR®Premix Ex TaqTM II试剂盒进行荧光定量PCR,操作步骤依据试剂盒说明书进行,使用实时荧光定量PCR仪进行扩增,相对表达水平以GAPDH为内参。记录各孔Ct值((扩增动力曲线拐点))。用2-ΔΔCt法计算目的基因的相对表达水平。

1.2.6Western blotting检测 取对数生长期细胞进行实验,将200 μL含有蛋白酶抑制剂的细胞裂解液加入培养孔。细胞离心后借助BCA蛋白定量试剂盒对蛋白浓度进行测定。之后每孔50 μg 蛋白行SDS-PAGE凝胶电泳。转膜,脱脂牛奶封闭后加入兔抗人一抗p-PI3K、p-AKT、p-mTOR、Bax、Bcl-2、E-cadherin、N-cadherin、Vimentin,4 ℃孵育过夜,TBST冲洗后加入山羊抗兔二抗IgG,37 ℃孵育1 h,TBST冲洗,使膜与ECL反应液反应1 min,之后观察结果。蛋白质相对表达量为目标条带与内参条带的灰度值之比。
1.3统计学方法 采用SPSS21.0软件对本研究中数据进行统计分析,计量资料以均值±标准差的形式表示,两组间比较采用Student t检验,多组间比较采用单因素方差分析。细胞增殖实验数据使用重复测量方差分析。P<0.05表示差异具有显著性统计学意义。
2、结果
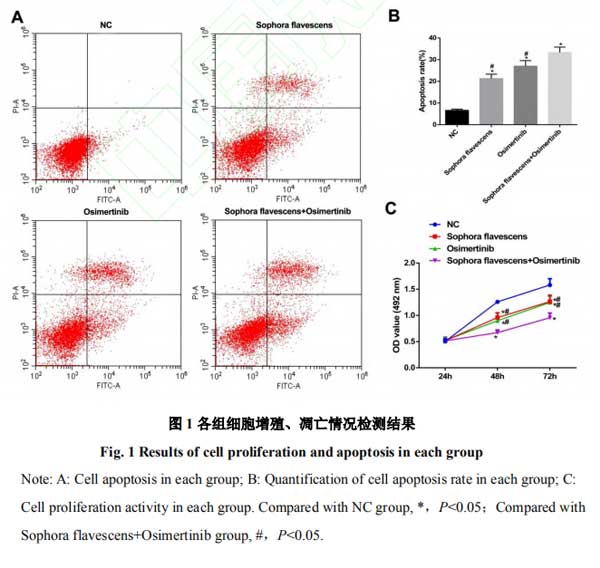
2.1复方苦参注射液和奥希替尼抑制H1975细胞增殖、诱导细胞凋亡且联合作用效果更显著 使用MTT以及流式细胞术对各组细胞增殖、凋亡情况进行检测,结果发现,相对于NC组,苦参注射液组和奥希替尼组凋亡被诱导,且细胞增殖活力被抑制,苦参注射液+奥希替尼组效果更显著(均P<0.05)。见图1。
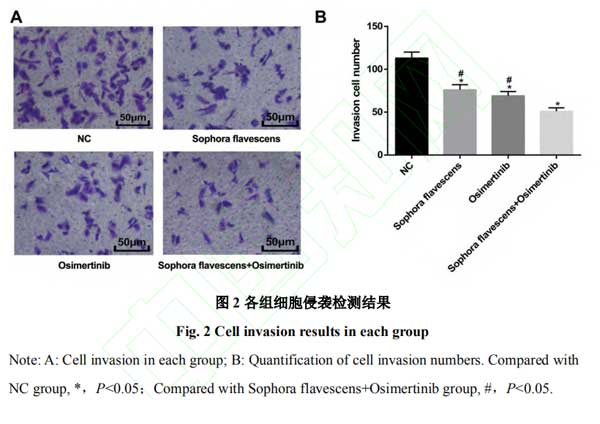
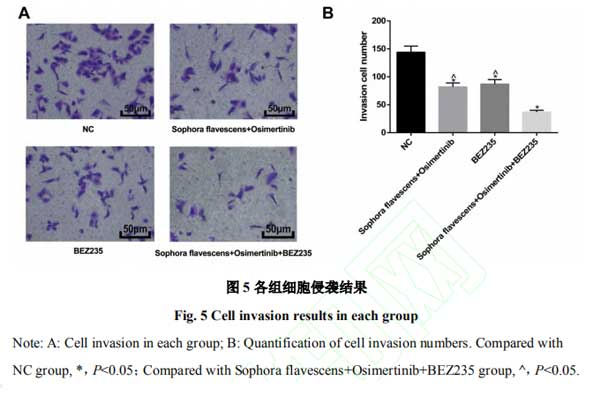
2.2复方苦参注射液和奥希替尼抑制H1975细胞侵袭且联合作用效果更显著 Transwell检测结果显示,相对于NC组,苦参注射液组和奥希替尼组中细胞侵袭数目减少(均P<0.05),同时,与苦参注射液+奥希替尼组比较,苦参注射液组和奥希替尼组细胞侵袭数目增多(均P<0.05),表明苦参注射液和奥希替尼二者联合使用在抑制H1975细胞侵袭中效果更显著。见图2。
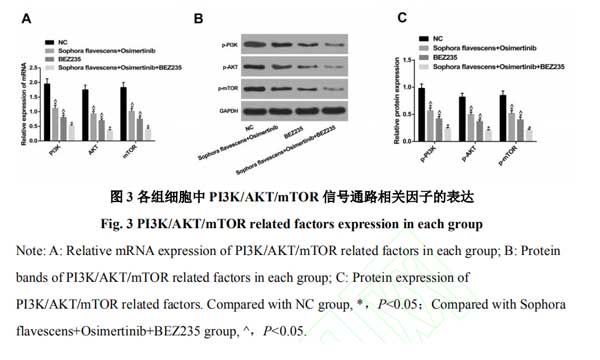
2.3复方苦参注射液和奥希替尼抑制H1975细胞中PI3K/AKT/mTOR信号通路的激活 为进一步探讨复方苦参注射液和奥希替尼调控H1975细胞生物学特性的具体机制,对细胞给予了BEZ235处理,qRT-PCR和Western blot检测检测各组细胞中PI3K/AKT/mTOR通路相关因子的表达,结果发现,相对于NC组,苦参注射液+奥希替尼组、BEZ235组中PI3K/AKT/mTOR通路相关因子的表达被显著抑制,且苦参注射液+奥希替尼+BEZ235组中抑制效果更显著(均P<0.05)。见图3。
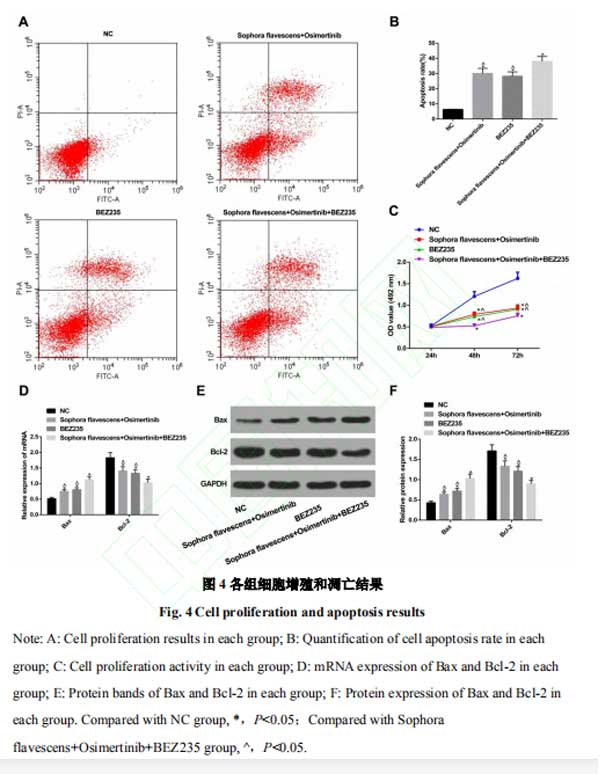
2.4复方苦参注射液和奥希替尼通过PI3K/AKT/mTOR信号通路抑制H1975细胞增殖,促进凋亡 相对于NC组,苦参注射液+奥希替尼组、BEZ235组细胞凋亡增多,细胞增殖活力被抑制,Bax表达增多,Bcl-2表达降低,且苦参注射液+奥希替尼+BEZ235组效果更显著(均P<0.05)。表明苦参注射液+奥希替尼能够通过调节PI3K/AKT/mTOR信号通路进而影响H1975细胞的增殖凋亡。见图4。
2.5复方苦参注射液和奥希替尼通过PI3K/AKT/mTOR信号通路抑制H1975细胞侵袭 对各组细胞侵袭情况进行检测,结果发现,相对于NC组,苦参注射液+奥希替尼组、BEZ235组细胞侵袭被抑制,且苦参注射液+奥希替尼+BEZ235组侵袭数目减少更显著(均P<0.05)。
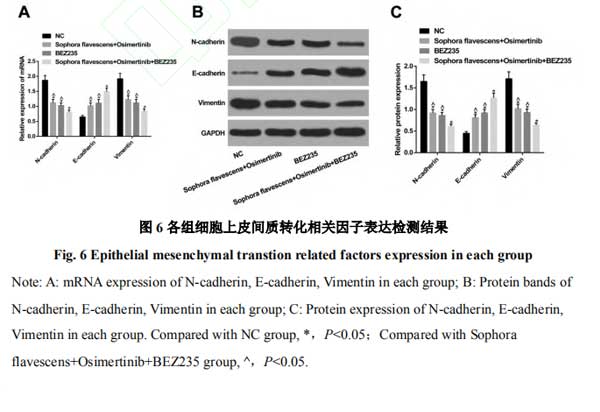
2.6复方苦参注射液和奥希替尼通过PI3K/AKT/mTOR信号通路抑制H1975细胞上皮间质转化 对各组细胞上皮间质转化相关因子表达进行检测,结果发现,相对于NC组,苦参注射液+奥希替尼组、BEZ235组细胞中N-cadherin、Vimentin表达被抑制,E-cadherin表达增强,苦参注射液+奥希替尼+BEZ235组各因子变化更明显(均P<0.05)。见图6。
3、讨论
本研究探讨了奥希替尼联合中药复方苦参注射液对肺腺癌H1975细胞增殖、凋亡和侵袭的影响,结果发现,联合使用奥希替尼和复方苦参注射液能够更显著的促进H1975细胞凋亡,抑制细胞增殖和侵袭,而该作用的实现可能与抑制PI3K/AKT/mTOR通路的激活有关。
奥希替尼为临床上用于治疗局部晚期或者转移性肺癌的常用药物之一,相对于传统药物,其具有靶向性强、具有良好治疗效果且不良反应较少等优点[10]。而复方苦参注射液作为中药制剂,被证实能够显著改善放疗患者肺损伤程度、减少放射性肺炎的发生,同时还能够显著改善肺炎患者症状,促进机体的耐受程度增强[11]。本研究首先通过对H1975细胞给予复方苦参注射液、奥希替尼等处理,结果发现,同时给予复方苦参注射液和奥希替尼对于H1975细胞的增殖和侵袭的抑制,以及诱导细胞凋亡的效果更显著。接下来为了探讨复方苦参注射液联合奥希替尼作用于H1975的具体机制,对细胞给予了BEZ235处理。
研究证实PI3K/AKT通路在多种实体瘤中均处于激活状态,AKT是丝氨酸苏氨酸蛋白激酶家族的重要成员,其在PI3K/AKT通路中处于最核心的位置,具有调控细胞增殖凋亡的作用[12-14]。mTOR是在细胞的增殖、代谢以及骨架形成过程中起关键作用的因子,其还能够参与激活AKT的过程,因其在肿瘤学中的作用,也成为多种药物研发的重要针对目标[15]。为探究复方苦参注射液与奥希替尼在肺腺癌细胞H1975中发挥作用的具体机制,使用qRT-PCR和Western blot检测各组PI3K/AKT/mTOR通路相关因子的表达,结果发现,相对于NC组,苦参+奥希替尼组中通路相关因子的表达被显著抑制。同时BEZ235组中细胞增殖、侵袭被抑制,凋亡被显著诱导,同时给予苦参、奥希替尼以及BEZ235则效果更明显。上皮间质转化指的是上皮细胞向间质细胞转化的过程,其能够赋予细胞入侵以及转移的能力,在癌症的发生和发展中起重要作用[16-17]。另外有研究表明PI3K/AKT/mTOR信号通路在上皮源性恶性肿瘤的发生和发展中发挥重要作用,该通路的激活能够促进上皮间质转化过程[18]。本研究进一步探讨了各组H1975细胞中上皮间质转化相关因子的表达,结果发现,BEZ235或苦参+奥希替尼能够显著抑制N-cadherin和Vimentin、促进E-cadherin的表达而联合使用效果更明显,这也进一步说明了奥希替尼、苦参等对肺腺癌的影响可能与调节上皮间质转化有关。
综上所述,本研究发现,复方苦参注射液联合奥希替尼能够抑制H1975细胞细胞增殖、侵袭和上皮间质转化,促进细胞凋亡,该作用的实现可能是通过抑制PI3K/AKT/mTOR信号通路实现的,本研究在探讨药物效果的基础上进一步明确了其具体作用机制,在肺腺癌的治疗中具备一定指导意义。
参考文献
[1]Zhao W,Hu JX,Hao RM,et al.Induction of microRNA-let-7a inhibits lung adenocarcinoma cell growth by regulating cyclin D1[J].Oncol Rep,2018,40(4):1843-1854.
[2]饶晓明,李海燕,李凯.抗非小细胞肺癌药物奥希替尼研究进展[J].安徽医药,2019,23(3):611-614.Rao XM,Li HY,Li K.Research progress of anti NSCLC drug Osimertinib[J].Anhui Med Pharm J,2019,23(3):611-614.
[3]杨雪艳,胡宝玉,姜亚涛.复方苦参注射液联合新辅助化疗对宫颈癌临床效果及生存期的影响[J].中华中医药学刊,2018,36(10):2520-2524.Yang XY,Hu BY,Jiang YT.Effect of Compound Kushen injection combined with neoadjuvant chemotherapy on the clinical effect and survival period of cervical cancer[J].Chin Arch Tradit Chin Med,2018,36(10):2520-2524.
[4]李程,应伟.复方苦参注射液联合XELOX方案对晚期结肠癌患者疗效及免疫功能的影响[J].标记免疫分析与临床,2019,26(2):318-321.Li C,Ying W.The effect of Compound Kushen injection combined with XELOX on the curative effect and immune function of patients with advanced colon cancer[J].Lab Immun Clin Med,2019,26(2):318-321.
[5]王君,任毅.复方苦参注射液联合ET方案治疗乳腺癌的临床研究[J].现代药物与临床,2019,34(7):2137-2141.Wang J,Ren Y.Clinical study on the treatment of breast cancer with compound matrine injection and ET regimen[J].Drugs & Clinic,2019,34(7):2137-2141.
[6]魏世鸿,祁月萧,董玉梅,等.岩舒复方苦参注射液联合放疗治疗肺癌骨转移疼痛的疗效观察[J].中国中西医结合急救杂志,2019,26(3):356-359.Wei SH,Qi YX,Dong YM,et al.Therapeutic effect of Yanshu Compound Kushen injection combined with radiotherapy on bone metastasis pain of lung cancer[J].Chin J Integr Tradit West Med Intensive Crit Care,2019,26(3):356-359.
[7]何敏,张惠玲,杨易.复方苦参注射液配合拓扑替康、顺铂对晚期中央型肺癌患者疗效评价[J].辽宁中医药大学学报,2019,21(4):204-207.He M,Zhang HL,Yang Y.Evaluation of the therapeutic effect of Compound Kushen injection combined with topotecan and cisplatin on patients with advanced central lung cancer[J].J Liaoning Univ Tradit Chin Med,2019,21(4):204-207.
[8]胡志英,朱新江,陈舒晨,等.非小细胞肺癌 PI3K/AKT/MTOR 信号通路的研究现状与进展[J].癌症进展,2018,16(6):671-674.Hu ZY,Zhu XJ,Chen SC,et al.Research status and progress of PI3K/Akt/mTOR signaling pathway in non-small cell lung cancer[J].Oncol Prog,2018,16(6):671-674.
[9]Liu FR,Gao S,Yang YX,et al.Antitumor activity of curcumin by modulation of apoptosis and autophagy in human lung cancer A549 cells through inhibiting PI3K/Akt/mTOR pathway[J].Oncol.Rep,2018,39(3):1523-1531.
[10]刘志强,陈春林,王博龙.中药注射液联合吉非替尼治疗非小细胞肺癌的网状Meta分析[J].中药,2018,40(4):994-1000.Liu ZQ,Chen CL,Wang BL.Mesh meta analysis of Chinese medicine injection combined with gefitinib in the treatment of NSCLC[J].Chin Tradit Patent Med,2018,40(4):994-1000.
[11]刘方雷,王鹏飞,田春香,等.复方苦参注射液对原发性肺癌放射性肺炎的防治探讨[J].辽宁中医杂志,2018,45(2):317-319.Liu FL,Wang PF,Tian CX,et al.Prevention and treatment of radiation pneumonitis in primary lung cancer by Compound Kushen Injection[J].Liaoning J Tradit Chin Med,2018,45(2):317-319.
[12]Yang WB,Zhang WP,Shi JL,et al.MiR-4299 suppresses non-small cell lung cancer cell proliferation,migration and invasion through modulating PTEN/AKT/PI3K pathway[J].Eur Rev Med Pharmacol Sci,2018,22(11):3408-3414.
[13]Liu JG,Xing YR,Rong L.miR-181 regulates cisplatin-resistant non-small cell lung cancer via downregulation of autophagy through the PTEN/PI3K/AKT pathway[J].Oncol Rep,2018,39(4):1631-1639.
[14]Cheng F,Yang ZJ,Huang F,et al.microRNA-107 inhibits gastric cancer cell proliferation and metastasis by targeting PI3K/AKT pathway[J].Microb.Pathog,2018,121:110-114.Doi:10.1016/j.micpath.2018.04.060
[15]邢晓伟,郭祥,涂源源.miR-199-3p介导mTOR对骨肉瘤细胞自噬的影响[J].中国免疫学杂志,2019,35(17):2094-2099.Xing XW,Guo X,Tu YY.The effects of miR-199-3p on autophagy of osteosarcoma cells via regulating mTOR[J].Chin J Immunol,2019,35(17):2094-2099.
[16]He YN,Li L,Liu JH,et al.Iodine-125 seed brachytherapy inhibits non-small cell lung cancer by suppressing epithelial-mesenchymal transition[J].Brachytherapy,2018,17(4):696-701.
[17]Li C,Wan L,Liu ZY,et al.Long non-coding RNA XIST promotes TGF-β-induced epithelial-mesenchymal transition by regulating miR-367/141-ZEB2 axis in non-small-cell lung cancer[J].Cancer Lett,2018,418:185-195.Doi:10.1016/j.canlet.2018.01.036
[18]Li WP,Dong YC,Zhang B,et al.PEBP4 silencing inhibits hypoxia-induced epithelial-to-mesenchymal transition in prostate cancer cells[J].Biomed Pharmacother,2016,81:1-6.Doi:10.1016/j.biopha.2016.03.030
