发布时间:2020年12月29日 09:00:10 来源:振东健康网
李静1,王金铭2,任琛琛1,杨立1,刘泇希1,白杨1
(1.郑州大学第三附属医院妇产科,河南郑州450000;2.河南省人民医院医学遗传研究所,河南郑州450000)
【摘要】目的:探讨miR-558通过对叉头框转录因子C1(ForkheadboxproteinC1,FOXC1)的调控从而对人卵巢癌腺癌细胞(SKOV3)增殖和侵袭能力的影响。方法:选择2014年1月至2017年12月郑州大学第三附属医院妇产科收治的上皮性卵巢癌病人25例、交界性卵巢上皮性肿瘤病人25例和良性卵巢上皮性肿瘤病人25例,三组病例均行手术治疗,取其部分经手术切除的卵巢组织标本,使用实时荧光定量PCR技术来分析微小RNA-558(miR-558)的表达水平。把卵巢癌SKOV3细胞分成三组,分别为miR-558模拟物组、抑制物组和阴性对照组。通过靶基因预测网站来预测miR-558的靶基因(FOXC1基因),通过荧光素酶报告基因实验来验证miR-558对FOXC1基因表达的调控作用。通过实时荧光定量-PCR技术和蛋白印迹法来分析转染后各组细胞的miR-558和FOXC1的表达水平。通过细胞增殖实验(CellCountingKit-8,CCK-8法)检测三组细胞的增殖率。通过基质胶侵袭实验检测三组细胞的侵袭能力。结果:实时荧光定量-PCR结果显示,在上皮性卵巢癌、交界性卵巢上皮性肿瘤和良性卵巢上皮性肿瘤病人的卵巢组织中,miR-558的相对表达水平分别为(3.43±0.42)、(2.47±0.35)、(1.37±0.31);在miR-558模拟物组、抑制物组和阴性对照组中,SKOV3细胞miR-558的表达水平分别为(2.37±0.17)、(0.64±0.17)、(1.14±0.11)。在miR-558模拟物组、抑制物组和阴性对照组中,SKOV3细胞的FOXC1基因转录出的信使RNA(mRNA)表达水平分别为(0.51±0.10)、(2.27±0.12)、(0.99±0.11)。荧光素酶报告基因实验结果显示,SKOV3细胞被含miR-558的质粒以及含FOXC1基因的重组质粒共同转染后,的荧光素酶活性下降了49.50%(P<0.05)。蛋白印迹结果显示,上述三组SKOV3细胞中,FOXC1蛋白的表达水平分别为(0.83±0.07)、(2.17±0.15)、(1.47±0.21)。CCK-8检测结果显示,不同时间miR-558模拟物组SKOV3细胞的增殖率明显高于阴性对照组(P<0.05),不同时间miR-558抑制物组SKOV3细胞的增殖率明显低于阴性对照组(P<0.05)。基质胶侵袭实验结果显示,上述三组SKOV3细胞穿透基底膜的细胞数分别为(158.33±9.45)、(67.01±10.58)、(117.67±16.86)(P<0.05)。结论:miR-558能够通过靶向调控FOXC1的表达,促进SKOV3细胞的增殖能力和侵袭能力,从而参与卵巢癌的发生发展。
【关键词】卵巢肿瘤;叉头转录因子类;微小RNA;增殖;实时聚合酶链反应;荧光免疫测定;实时荧光定量PCR;侵袭
[中图分类号]R737.31[文献标志码]A[文章编号]1009-6469(2020)10-007
MicroRNA-558 promotes the proliferation and invasion of SKOV3 cells by targeting FOXC1
LI Jing1,WANG Jinming2,REN Chenchen1,YANG Li1,LIU Jiaxi1,BAI Yang1
1 Department of Obstetrics and Gynecology,The Third Affiliated Hospital of Zheng zhou
University,Zhengzhou,Henan 450000;2 Institute of Medical Genetics,Henan
Provincial People′s Hospital,Zhengzhou,Henan 450000
【Abstract】Objective:To clarify the role of miR-558 on the proliferation and invasion of SKOV3 cell and the relationship with FOXC1.Methods:We recruited 25 patients with epithelial ovarian cancer,25 patients with borderline epithelial ovarian tumors and 25 patients with benign epithelial ovarian tumors in Department of Obstetrics and Gynecology of the Third Affiliated Hospital of Zhengzhou University from January 2014 to December 2017.The three groups underwent surgical treatment,and some ovarian tissue of patients were taken.Quantitative real-time polymerase chain reaction(qRT-PCR)was used to measure the expression of miR-558 in ovarian tissues.SKOV3 cells were assigned to miR-558 mimics group,inhibitor group,negative control,respectively.Bioinformatics was used for predicting target genes for miRNA-558-5p(FOXC1)and dual-luciferase reporting system for verifying the target gene.MiR-558 expression was evaluated by qRT-PCR.FOXC1 expression was evaluated by western blot and qRT-PCR.Cell proliferation was determined by CCK-8 assay.Invasive activities were assessed by cell Transwell invasion assay.Results:The relative expression of miR-558 measured by qRT-PCR in the ovarian tissues of patients with epithelial ovarian cancer,borderline ovarian epithelial tumor and benign ovarian epithelial tumor were(3.43±0.42),(2.47±0.35),(1.37±0.31),respectively.The expression of miR-558 in SKOV3 cell line in the miR-558 mimics group,inhibitor group and negative control group were(2.37±0.17),(0.64±0.17),(1.14±0.11),respectively.The expression of FOXC1 mRNA in SKOV3 cell line in the miR-558 mimics group,inhibitor group and negative control group were(0.51±0.10),(2.27±0.12),(0.99±0.11),respectively.Luciferase reporter assay results showed that the luciferase activity of SKOV3 cells transfected with miR-558 containing plasmid and FOXC1 containing recombinant plasmid decreased by 49.50%(P<0.05).The expression of FOXC1 protein in SKOV3 cell line in the miR-558 mimics group,inhibitor group and negative control group were(0.83±0.07),(2.17±0.15),(1.47±0.21),respectively.The results of CCK-8 assay showed that the proliferation rate of SKOV3 cells in the miR-558 mimics group at different times was higher than that in the negative control group(P<0.05),and that of the miR-558 inhibitor group at different times was significantly lower when compared with negative control group(P<0.05).The number of SKOV3 cell that passed through the membrane in miR-558 mimics group,inhibitor group and negative control group was(158.33±9.45),(67.01±10.58),(117.67±16.86),respectively(P<0.05).Conclusions:MiR-558 can promote the proliferation and invasion of SKOV3 cells by targeting FOXC1,which participates in the pathogenesis of ovarian cancer.
【Key words】Ovarian neoplasms;Forkhead transcription factors;microRNA(miR);Proliferation;Real-time polymerase chain reaction;Fluoroimmunoassay;Quantitative real-time PCR;Invasion
卵巢癌是常见的妇科恶性肿瘤,在卵巢肿瘤中它的发病率占50%~70%[1]。在早期,卵巢癌多无明显表现,具有较高的病死率[1-2]。目前研究的主要理论认为:细胞的过度增殖和侵袭力的异常参与了肿瘤的发生发展[2],微小RNA(microRNA,miRNA)和卵巢癌的发生发展存在密切关系,通过对下游靶基因的调控表达,miRNA影响了细胞的增殖和侵袭能力,可能导致卵巢癌的发生发展[3]。其中,miR-558是目前被发现参与肿瘤发生发展过程的一种非常重要的新的癌基因,但是miR-558在卵巢癌组织中的表达以及miR-558在卵巢癌发生发展过程中的作用机制尚不明确,并且miR-558和叉头框转录因子C1(FOXC1)之间的调控关系尚未见报道[4]。本研究主要探讨miR-558在卵巢癌组织中的表达情况、miR-558与FOXC1基因之间的调控关系和miR-558对人卵巢癌腺癌细胞SKOV3细胞增殖、侵袭能力的影响,在卵巢癌的发生机制及治疗思路方面提供一些新的方向。
1、资料与方法
1.1一般资料选择2014年1月至2017年12月郑州大学第三附属医院妇产科同期收治的25例上皮性卵巢癌、25例交界性卵巢上皮性肿瘤和25例良性卵巢上皮性肿瘤病人,经过知情同意,取其手术切除的部分卵巢组织标本;上皮性卵巢癌组年龄范围为35~76岁,临床分期Ⅰ~Ⅱ期6例、Ⅲ~Ⅳ期19例,中高分化10例、低分化15例;交界性卵巢上皮性肿瘤组年龄范围为39~65岁,临床分期Ⅰ~Ⅱ期12例、Ⅲ~Ⅳ期13例,中高分化13例、低分化12例;良性卵巢上皮性肿瘤组年龄范围为31~55岁。本研究符合《世界医学协会赫尔辛基宣言》相关要求。病人对研究方案均签署了知情同意书。由第四军医大学病原微生物学教研室惠赠卵巢腺癌细胞系SKOV3细胞。
1.2方法
1.2.1主要试剂从广州锐博科技有限公司购买miR-558的模拟物、抑制物及阴性对照。miR-558、小核RNA6(U6)的特异性引物、FOXC1的引物由上海生工生物工程有限公司合成。β-肌动蛋白(β-ac-tin)抗体、FOXC1抗体购买于美国Abcam生物技术有限公司。实时荧光定量PCR试剂盒购买于北京鼎国公司产品。
1.2.2验证miR-558对FOXC1基因的调控作用借助于权威的生物信息学靶基因预测网站(PicTar、mi-Randa和TargetScan),将miR-558的名称和物种输入,预测与miR-558相关的靶基因FOXC1;通过荧光素酶报告基因实验,验证miR-558对FOXC1基因的靶向调控作用,构建荧光素酶报告基因载体质粒[(含有FOXC1基因3'-非翻译区(UTR)中潜在结合位点)],野生型FOXC1基因3'-UTR(野生型-FOXC1-2-3'-UTR)和突变型FOXC1基因3'-UTR(突变型-FOXC1-3'-UTR),放入-20℃冰箱保存备用。把质粒和miR-558共同转染到SKOV3细胞系中,培养48h,用荧光素酶活性检测试剂盒测定并计算海肾荧光素酶与萤火虫荧光素酶的比值,以此值表示细胞荧光素酶的水平。
1.2.3细胞培养及转染在RPMI1640培养基中(含1%青霉素及链霉素及10%胎牛血清)加入SKOV3细胞,恒温培养箱的温度为37℃,含5%二氧化碳,后续实验选取对数生长期的SKOV3细胞;选取并计数对数生长期的SKOV3细胞,按照2.0×105个/孔接种到6孔培养板中进行培养。转染在细胞生长态势较好的时候进行。将转染实验细胞分成三组,分别为miR-558模拟物组、miR-558抑制物组及阴性对照组。将miRNA转染到SKOV3细胞中,miRNA由羧基荧光素(Carboxyfluorescein,FAM)标记。转染之前,充分混合miRNA和转染试剂,在室温下放置5min,然后放置到培养箱的细胞培养板内,开始转染反应;转染24h以后,在200倍光镜及荧光显微镜下分别观察并计数,把表达荧光蛋白的细胞作为阳性细胞,计算其转染效率,转染效率为阳性细胞数与总细胞数的比值。
1.2.4实时荧光定量PCR技术检测卵巢组织SKOV3细胞中miR-558的表达水平以及SKOV3细胞中FOXC1的mRNA的表达水平将细胞的总RNA用Trizol一步法提取,浓缩,计算总RNA的纯度和质量。采用实时荧光定量PCR技术进行试验后,行融解曲线分析,每个实验均重复3次。对结果采用2-△△ct法分析(ct值为反应的实时荧光强度明显大于背景值时的循环数)。
1.2.5蛋白印迹法检测SKOV3细胞中FOXC1蛋白的表达水平提取总蛋白后测定浓度,依标准进行凝胶电泳,封闭液进行封闭,加入兔抗人FOXC1一抗(1:5000稀释),在室温下孵育2h,然后洗涤3次,加入二抗,室温下再孵育1h,洗涤3次,把β-ac-tin作为内参,分析其灰度值,计算FOXC1蛋白的相对表达水平(FOXC1蛋白与β-actin的灰度值的比值)。该实验重复进行3次。
1.2.6CCK-8法检测转染后SKOV3细胞的增殖情况将对数生长期的SKOV3细胞接种于96孔板中,在转染后24、48、72、96h,采用CCK-8试剂盒来检测细胞处于450nm的吸光度(A)值并且记录。计算细胞增殖率[(实验组A值-空白对照组A值)(/对照组组A值-空白对照组A值)×100%]。本实验重复进行3次。
1.2.7基质胶侵袭实验检测转染后SKOV3细胞的侵袭力将转染后24h的SKOV3细胞进行收集,细胞悬液加入到穿膜小室内,培养36h,取出小室,擦拭掉上室细胞,把那些已经侵入并且贴附于下层微孔膜的细胞用多聚甲醛固定5min,磷酸盐缓冲液(PBS)清洗后在显微镜下观察,随机在每张微孔膜中选5个视野进行细胞计数。此实验重复进行3次。
1.3统计学方法使用SPSS21.0软件包对实验数据进行统计分析。计量资料用x±s来表示,所有数据均进行正态检验并且符合正态分布,采用单因素方差分析进行多组间的比较,采用独立样本t检验对两组间进行比较。P<0.05时,差异有统计学意义。
2、结果
2.1验证miR-558对FOXC1基因的靶向调节作用上述3个权威的生物信息学靶基因预测数据库预测得出miR-558的靶基因是FOXC1,荧光素酶报告基因实验显示,含有miR-558的质粒以及含有FOXC1基因的重组质粒共同转染SKOV3细胞后,模拟物组荧光素酶相对活性为(0.56±0.01),阴性对照组荧光素酶相对活性为(1.12±0.02),与阴性对照组相比较,模拟物组的荧光素酶活性下降了49.50%(P<0.05)。
2.2卵巢组织中的miR-558的相对表达水平比较实时荧光定量-PCR技术结果显示,上皮性卵巢癌、交界性卵巢上皮性肿瘤和良性卵巢上皮性肿瘤病人卵巢组织中miR-558的相对表达水平分别为(3.43±0.42)、(2.47±0.35)、(1.37±0.31),各组之间两两比较,均差异有统计学意义(均P<0.05)。
实时荧光定量-PCR技术的结果显示,在miR-558模拟物组、抑制物组和阴性对照组中,SKOV3细胞miR-558的表达水平分别为(2.37±0.17)、(0.64±0.17)、(1.14±0.11),miR-558各组间两两比较,差异有统计学意义(均P<0.05);在miR-558模拟物组、抑制物组和阴性对照组中,SKOV3细胞的FOXC1基因转录出的mRNA的表达水平分别为(0.51±0.10)、(2.27±0.12)、(0.99±0.11),FOXC1的mRNA表达水平各组间两两比较,差异有统计学意义(均P<0.05)。
蛋白印迹法结果显示,在miR-558模拟物组、抑制物组和阴性对照组SKOV3细胞中,FOXC1蛋白的表达水平分别为(0.83±0.07)、(2.17±0.15)、(1.47±0.21),FOXC1蛋白的表达水平各组间两两比较,差异有统计学意义(均P<0.05)。
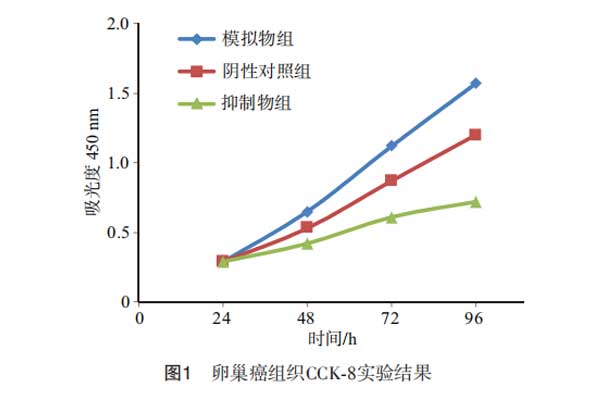
CCK-8结果显示,miR-558模拟物组的细胞增殖率显著高于阴性对照组,抑制物组细胞的细胞增殖率明显低于阴性对照组,模拟物组中增殖率水平高于抑制物组,各组间两两比较,差异有统计学意义(均P<0.05),见图1。
基质胶侵袭实验结果显示,在miR-558模拟物组、抑制物组和阴性对照组SKOV3细胞中,SKOV3细胞穿透基底膜的细胞数分别为(158.33±9.45)、(67.01±10.58)、(117.67±16.86)(P<0.05)。miR-558细胞侵袭力水平各组间两两比较,差异有统计学意义(均P<0.05)。
3、讨论
卵巢癌的发病率位居女性生殖系统恶性肿瘤的前3位,而它的死亡率却位居妇科恶性肿瘤之首[1]。据不完全统计,2015年,我国大约有5万多名女性被确诊为卵巢癌,约3万例病人死于卵巢癌[1-2]。肿瘤细胞异常的增殖和侵袭能力是恶性肿瘤的主要生物学特征,细胞的增殖和侵袭能力是影响癌症治疗和预后的重要因素。肿瘤细胞异常的增殖力与侵袭力相互作用,共同促进癌细胞的生长,最终导致癌症的发展转移和化疗耐药[1,5-7]。因此,明确卵巢癌细胞增殖和侵袭能力过度的具体原因对控制卵巢癌的发生发展具有重大意义。腺癌是卵巢上皮性癌中的主要病理类型,本研究所选用的SKOV3细胞系是卵巢腺癌细胞系能够更为真实地反映卵巢癌的生物学特性。
miRNA是小分子单链RNA,由21至23个核苷酸组成,位于内源非编码区,通过与靶mRNA特异性的碱基配对,将靶mRNA降解,或者抑制它的翻译,继而实现对目的基因的调控[3]。miR-558是miRNA中的一种,位于人类2号染色体p22.3,能够调节环氧合酶2和白细胞介素-1β的表达,诱导人关节软骨细胞分解代谢[4]。有研究表明,miR-558可通过调控细胞的凋亡、增殖以及细胞的迁移、侵袭等生物学行为从而参与肿瘤的进展,如胃癌、成神经细胞瘤[8,10]。LiY等[9]通过研究发现,在膀胱癌病人体内,环状RNAHIPK3(circHIPK3)是低表达的,circHIPK3能够抑制miR-558的表达水平,降低乙酰肝素酶的表达,从而调控细胞的迁移和侵袭及膀胱癌的血管生成,由此提示我们,miR-558能够促进膀胱癌的肿瘤发生。华中科技大学同济医学院的QuH教授团队[10]通过研究发现miR-558能够与缺氧诱导因子2的5'-非编码区结合,促进缺氧诱导因子2的表达从而促进成神经细胞瘤细胞的生长、迁移、侵袭和血管生成,从而促进肿瘤的发生,研究表明,高表达miR-558的病人生存预后较差。同时QuH教授团队[11]也在成神经细胞瘤的细胞中,通过敲除内源性miR-558的表达,证实其能够通过活化乙酰肝素酶促进成神经细胞瘤的肿瘤生成和侵袭。华中科技大学同济医学院的ZhengL教授团队[8]发现在胃癌的体内实验和体外实验中,miR-558能够识别乙酰肝素酶启动子中的互补位点,以AGO蛋白家族成员1(Argonaute1)依赖的方式结合SMAD家族成员4(Smad4)降低Smad4的表达,从而促进胃癌的进展。这些研究与我们的结果相一致,从而更加明确了miR-558的致癌作用。
FOXC1基因长约1787kb,位于人类6号染色体p25.3,经转录翻译形成FOXC1蛋白。最新的研究表明,FOXC1通过激活趋化因子受体4(CXCR4),能够参与癌症的发生发展,并且能够与活化T-细胞核因子1(NFATC1)构成基因遗传轴参与疾病的发展[12]。本课题组的前期研究已经通过QRT-PCR技术和免疫组化法分析上皮性卵巢癌、交界性卵巢上皮性肿瘤和良性卵巢上皮性肿瘤病人的卵巢组织,明确在上皮性卵巢癌中FOXC1的表达水平是降低的,与本次研究中的miR-558的表达水平呈负向相关性[13-14]。同时本研究我们通过分析miRNA靶基因预测(PicTar、miRanda和TargetScan)数据库和荧光素酶报告实验明确了miR-558对FOXC1的靶向调控作用。本课题组通过前期研究发现在重组FOXC1慢病毒表达稳定的SKOV3的细胞中,细胞的增殖和侵袭能力受到明显抑制,在本次研究中我们进一步通过细胞实验明确了FOXC1对卵巢癌细胞的增殖和侵袭能力的抑制作用是由miR-558对FOXC1的靶向调控实现的[15]。
综上所述,miR-558通过靶向调控FOXC1的表达,能够促进卵巢癌细胞的增殖和侵袭能力,这为卵巢癌的发病机制提供了重要的理论依据。但是miR-558在卵巢癌病人血清中的具体表达情况以及在卵巢癌裸鼠移植瘤动物模型中的具体作用尚不明确,且与卵巢癌病人生存预后之间的关系尚不清楚,这仍然是本课题组下一步要深入研究的重点。
参考文献
[1]CHEN WQ,ZHENG RS,BAADE PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]任红英.人附睾蛋白4在卵巢癌患者手术前后的变化及其对复发的监测价值[J].安徽医药,2018,22(2):2390-2393.
[3]余艳玲.血清miRNA-125b与miRNA-21联合检测对前列腺癌的诊断价值[J].安徽医药,2018,22(12):120-123.
[4]PARK SJ,CHEON EJ,KIM HA.MicroRNA-558 regulates the expression of cyclooxygenase-2 and IL-1beta-induced catabolic effects in human articular chondrocytes[J].Osteoarthritis Cartilage,2013,21(7):981-989.
[5]李静,王金铭,刘月华,等.微小RNA-106b靶向调控基质金属蛋白酶2对滋养细胞侵袭和增殖的影响[J].中华妇产科杂志,2017,52(5):327-332.
[6]WANG J,LIU Y,WANG X,et al.MiR-1266 promotes cell prolifer-ation,migration and invasion in cervical cancer by targeting DAB2IP[J].Biochim Biophys Acta Mol Basis Dis,2018,1864(12):3623-3630.
[7]张展,王金铭,刘月华,等.微小RNA-26a靶向调控高迁移率族蛋白A1抑制宫颈癌细胞迁移、侵袭的研究[J].中华微生物学 和免疫学杂志,2017,37(10):778-784.
[8]ZHENG L,JIAO W,SONG H,et al.miRNA-558 promotes gastric cancer progression through attenuating Smad4-mediated repres-sion of heparanase expression[J].Cell Death Dis,2016,7(9):e2382.
[9]LI Y,ZHENG F,XIAO X,et al.CircHIPK3 sponges miR-558 to suppress heparanase expression in bladder cancer cells[J].EM-BO Rep,2017,18(9):1646-1659.
[10]Qu H,Zheng L,Song H,et al.microRNA-558 facilitates the expression of hypoxia-inducible factor 2 alpha through binding to 5′-untranslated region in neuroblastoma[J].Oncotarget,2016,7(26):40657-40673.
[11]QU H,ZHENG L,PU J,et al.miRNA-558 promotes tumorigenesis and aggressiveness of neuroblastoma cells through activating the transcription of heparanase[J].Hum Mol Genet,2015,24(9):2539-2551.
[12]PAN H,PENG Z,LIN J,et al.Forkhead box C1 boosts triple-nega-tive breast cancer metastasis through activating the transcription of chemokine receptor-4[J].Cancer Sci,2018,109(12):3794-3804.
[13]李倩,任琛琛,杨立,等.上皮性卵巢癌组织中FOXC1 mRNA表达变化及其启动子区甲基化情况观察[J].山东医药,2015,55(38):21-23.
[14]黄玲,任琛琛,杨立,等.上皮性卵巢癌组织中FOXC1的表达变化及意义[J].山东医药,2017,57(13):13-16.
[15]任琛琛,刘泇希,杨立,等.上调FOXC1的表达对SKOV3细胞增殖及侵袭的影响[J].郑州大学学报(医学版),2017,52(3):271-274.
(安徽医药2020 Oct,24(10))
