发布时间:2020年12月25日 08:41:23 来源:振东健康网
姜芹、崔海涛、王君
(山东省胶州市中心医院检验科山东青岛,266300)
【摘要】目的:分析恶性肿瘤患者体内血浆凝血纤溶情况及凝血纤溶标志物在血栓诊断中的作用。方法:采用回顾性研究,收集132例恶性肿瘤患者的临床资料,根据手术前后血栓发生情况,分为术前无血栓组(73例)、术后无血栓组(36例)、血栓组(23例)。检测3组患者凝血功能标志物包括血小板计数、D-二聚体、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)和纤溶标志物包括凝血酶-抗凝血酶Ⅲ复合物(TAT)、血栓调节蛋白(TM)、纤溶酶-α2纤溶酶抑制剂复合物(PIC)、组织型纤溶酶原激活剂-抑制剂1复合物(t-PAIC)。结果:血栓组PT较术前无血栓组明显延长(P<0.05),血栓组APTT较术后无血栓组明显延长(P<0.05),血栓组与术后无血栓组血小板计数均明显低于术前无血栓组(P<0.05),血栓组D-二聚体明显高于术前无血栓组与术后无血栓组(P<0.05)。血栓组与术后无血栓组TAT、t-PAIC均明显高于术前无血栓组(P<0.05),血栓组TAT明显高于术后无血栓组(P<0.05)。血栓组与术前无血栓组TM均明显高于术后无血栓组(P<0.05)。血栓组PIC明显高于术前无血栓组与术后无血栓组(<0.05)。D-二聚体、PIC及TAT诊断恶性肿瘤患者血栓形成的受试者工作特征曲线下面积分别为0.64、0.86、0.79,敏感度分别为52.17%、75.23%、73.91%,特异度分别为82.57%、91.30%、77.06%。结论:恶性肿瘤患者体内存在血浆凝血和纤溶活性异常改变的情况,并且PIC对患者血栓形成的诊断效能明显高于D-二聚体和TAT。
【关键词】恶性肿瘤;血栓形成;凝血标志物;纤溶标志物
[中图分类号]R446[文献标志码]A[文章编号]1004-2806-b(2020)10-007
The occurrence of plasma coagulation and fibrinolysis in patients with malignant tumor and the role of detection of coagulation and fibrinolysis markers in the diagnosis of thrombus
JIANG Qin CUI Haitao WANG Jun
(Department of laboratory,Jiaozhou Central Hospital of Shandong Province,Qingdao,266300,China)
【Abstract】Objective:To analyze the plasma coagulation and fibrinolysis in patients with malignant tumor and the role of coagulation and fibrinolysis markers in the diagnosis of thrombus.Method:A retrospective study was conducted to collect the clinical data of 132 patients with malignant tumors.According to the incidence of thrombus before and after operation,the patients were divided into three groups:preoperative thrombus-free group(73cases),postoperative thrombus-free group(36cases)and thrombus group(23cases).Platelet count,D-dimer,prothrombin time(PT),activated partial thromboplastin time(APTT)and fibrinolytic markers including thrombin-antithrombin complex(TAT),thrombomodulin(TM),α2-plasmin inhibitor-plasmin complexes(PIC),tissue plasminogen activator-inhibitor complexes(t-PAIC)were detected in three groups.Result:PT of thrombus group was significantly longer than that of preoperative thrombus-free group(P<0.05),APTT of thrombus group was significantly longer than that of postoperative thrombus-free group(P<0.05),platelet count of thrombus group and postoperative thrombus-free group were significantly lower than that of preoperative thrombus-free group(P<0.05),D-dimer of thrombus group was significantly higher than those of preoperative thrombus-free group and postoperative thrombus-free group(P<0.05).The TAT and t-PAIC of thrombus group and postoperative thrombus-free group were significantly higher than those of preoperative thrombus-free group(P<0.05),and the TAT of thrombus group was significantly higher than those of postoperative thrombus-free group(P<0.05).TM of thrombus group and preoperative thrombus-free group were significantly higher than that of postoperative thrombus-free group(P<0.05).PIC of thrombus group was significantly higher than those of preoperative thrombus-free group and postoperative thrombus-free group(P<0.05).The area under receiver operating characteristic curve of D-dimer,PIC and TAT was 0.64,0.86 and 0.79 respectively,the sensitivity was 52.17%,75.23% and 73.91%,the specificity was 82.57%,91.30% and 77.06%,respectively.Conclusion:There are abnormal changes of blood coagulation and fibrinolytic activity in patients with malignant tumors,and the diagnostic efficacy of PIC is significantly higher than those of D-dimer and TAT.
【Key words】malignant tumor;thrombosis;coagulation markers;fibrinolysis marker
静脉血栓栓塞是恶性肿瘤患者死亡的主要原因之一,术后患者常因血管内皮损伤、凝血和纤溶系统应激性激活,最终可造成凝血功能障碍[1]。通过早期监测恶性肿瘤体内凝血和纤溶指标的水平可用于反映机体止凝血系统的功能状况,并且各项指标浓度异常改变与机体高凝状态存在显著关系[2],可用于评估患者血栓发生的风险性,及时采取预防抗凝措施可有效预防或减少血栓形成的发生率,这对改善患者预后状况,提高生存质量和生活质量具有重要意义[3-4]。为此,本文采用回顾性研究的方式,通过测定恶性肿瘤患者体内凝血和纤溶指标的水平,进而探讨这些指标对患者血栓形成发生的诊断价值,旨在分析其对评估患者静脉血栓形成的临床意义。
1、资料与方法
1.1、资料
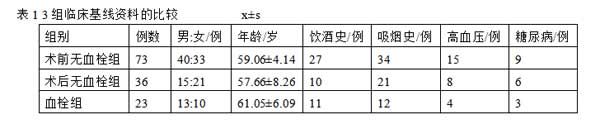
采用回顾性研究,收集2016-01-2019-12我院132例恶性肿瘤患者的临床资料,其中男68例,女64例;年龄32~86岁,平均(60.85±9.24)岁;包括肺癌45例、肝癌18例、肾癌14例、甲状腺癌7例、食管癌5例、胃癌9例、胆管癌3例、结肠癌7例、胰腺癌3例、前列腺癌2例、乳腺癌9例、卵巢癌6例、宫颈癌4例。根据手术前后血栓发生情况[诊断依据参照《深静脉血栓形成的诊断和治疗指南(第3版)》,分为术前无血栓组(73例)、术后无血栓组(36例)、血栓组(23例)。23例血栓形成的患者中,包括肺癌8例、肝癌5例、肾癌1例[5]、结肠癌4例、胰腺癌1例前列腺癌1例、卵巢癌2例、宫颈癌1例。3组临床基线资料的比较,差异均无统计学意义(P>0.05),见表1。
1.2、检测方法
对于术前患者,在予以服用抗凝药物预防性治疗前,取清晨空腹静脉血5mL,置于抗凝管中;对于术后患者,在术后5~7d进行采血;对于血栓形成患者,在血栓发生2周内进行采血。以3500r/min离心10min,取乏血小板血浆标本,置于-80℃冰箱内保存待测。采用全自动凝血分析仪(美国Beckman-Coulter公司,ACL7000型)对患者凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)及D-二聚体进行检测,检测试剂盒均购自北京九强生物技术股份有限公司,其中PT和APTT的检测采用凝固法,D-二聚体的检测采用免疫比浊法。采用全自动化学发光分析仪(德国罗氏公司,e601型)及其配套试剂盒对患者凝血酶-抗凝血酶Ⅲ复合物(TAT)、纤溶酶-α2纤溶酶抑制剂复合物(PIC)、组织型纤溶酶原激活剂-抑制剂1复合物(t-PAIC)及血栓调节蛋白(tm)进行检测,均采用化学发光酶免疫测定法。
1.3、统计学方法
采用SPSS23.0版统计学软件,计量资料用x±s表示,多组比较采用方差分析,两两比较采用LSD-t检验,计数资料采用例数表示并进行x2检验,通过绘制ROC曲线评价凝血纤溶标志物对患者血栓形成的诊断效能,P<0.05为差异有统计学意义。
2、结果
2.1、3组患者凝血功能指标的比较
血栓组PT较术前无血栓组明显延长(P<0.05)。血栓组APTT明显高于术后无血栓组(P<0.05)。血栓组、术后无血栓组血小板计数均明显低于术前无血栓组(P<0.05)。血栓组D-二聚体明显高于术前无血栓组与术后无血栓组(P<0.05)。见表2。

2.2、3组患者凝血和纤溶相关指标的比较
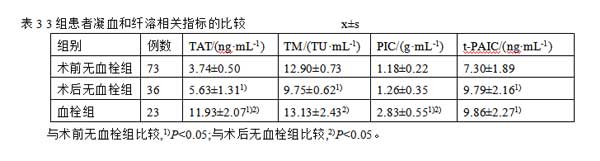
血栓组与术后无血栓组TAT均明显高于术前无血栓组,血栓组TAT明显高于术后无血栓组(P<0.05)。血栓组与术前无血栓组TM均明显高于术后无血栓组(P<0.05)。血栓组PIC明显高于术前无血栓组与术后无血栓组(P<0.05)。血栓组与术后无血栓组t-PAIC均明显高于术前无血栓组(P<0.05)。见表3。
2.3、凝血纤溶标志物对恶性肿瘤诊断效能的评价
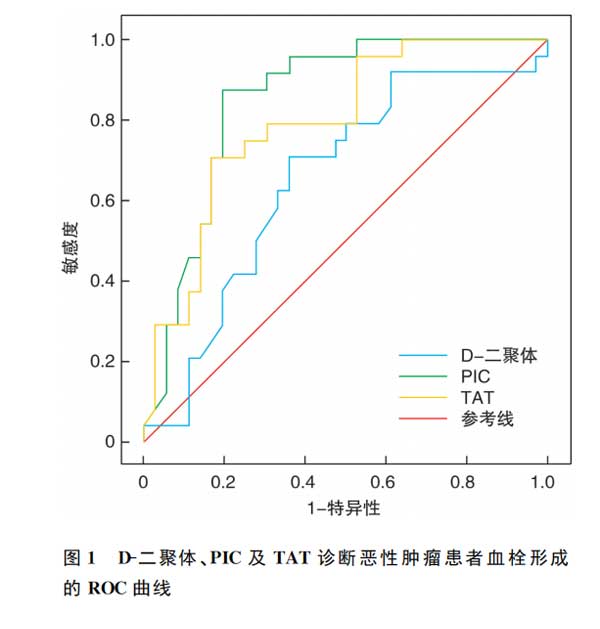
以术前无血栓与术后无血栓患者为阴性组(109例),血栓形成患者为阳性组(23例),对D-二聚体、PIC及TAT对恶性肿瘤患者血栓形成的诊断效能进行ROC曲线分析,结果显示三者ROC曲线下面积分别为0.64、0.86、0.79。见表4、图1。

3、讨论
既往研究报道,在正常人群中,血栓栓塞的发生率为每年1‰~3‰[6],但其在肿瘤患者中,由于疾病本身、服用激素、放化疗、手术操作、反复置管、长时间卧床、运动量不足等多方面的影响,使之发生率明显升高,且在不同肿瘤类型患者中的发生率亦存在一定差异[7-8]。静脉血栓是血液在静脉血管内的异常凝结,可造成血管腔堵塞,使得静脉回流受阻,进而导致静脉功能障碍,可对机体造成极大的影响[9]。并且,静脉血栓形成与静脉壁受损、血流减缓、血液处于高凝状态等方面均密切相关。
凝血、纤溶与抗凝系统在正常机体中的动态平衡对促进并维持体内血液平稳流动具有重要作用。PT是外源性凝血系统的常用检测指标,而APTT常用于内源性凝血系统的可靠筛选试验[10-11]。D-二聚体是继发性纤溶激活的特异性标志物,其水平上升是体内高凝状态和纤溶亢进的重要分子标志物[12]。本研究发现,血栓组PT较术前无血栓组明显延长,血栓组APTT较术后无血栓组明显延长,血栓组与术后无血栓组血小板计数均明显低于术前无血栓组,血栓组D-二聚体明显高于术前无血栓组与术后无血栓组。在恶性肿瘤发生和发展过程中,患者体内凝血、纤溶及抗凝的平衡状态发生改变,且主要因癌细胞诱导机体炎症反应,使得机体处于高凝状态,产生各种细胞因子和炎性介质而直接促使凝血因子激活,并且可诱导癌性促凝物质释放,最终可导致血栓形成[13]。此外,癌细胞可导致血管内皮细胞受损,促使高表达的组织因子释放入血,使得外源性凝血途径激活,进而激活凝血因子,使得凝血酶水平明显上升[14]。同时,因恶性肿瘤患者长时间卧床运动不足和频繁静脉穿刺等方面的影响,亦会导致体内血液处于高凝状态。除此之外,体内凝血途径的激活,亦会导致抗凝系统相对活跃,以促进机体凝血功能的平衡和稳定状态。凝血酶在血管内皮细胞中释放而导致纤溶系统被动活化,进而水解交联的纤维蛋白,并且继发性纤溶过程可产生纤维蛋白原降解产物与D-二聚体,这也能间接反映恶性肿瘤患者血栓形成的过程[15]。
本研究显示,血栓组与术后无血栓组TAT、t-PAIC均明显高于术前无血栓组,血栓组TAT明显高于术后无血栓组;血栓组与术前无血栓组TM均明显高于术后无血栓组;血栓组PIC明显高于术前无血栓组与术后无血栓组。结果提示,恶性肿瘤患者TAT与TM等指标水平上升与体内血栓形成存在一定关系。作为评估血管内皮损伤的重要标志物之一,TM水平上升可反映多种因素对内皮功能的影响,而TM在肺癌患者内皮受损后可释放入血,影响凝血功能,且机体启动相应代偿机制促使抗凝系统激活,以弥补凝血、纤溶及抗凝系统平衡的改变。在恶性肿瘤患者纤维蛋白溶解过程中,其体内纤溶活性明显下降,使得凝血和纤溶平衡状态向血栓栓塞方向偏移,这也能提示血栓分子标志物的水平上升与恶性肿瘤患者血栓形成存在密切关系。D-二聚体、TAT及PIC等均是血栓形成及纤溶系统激活的重要分子标志物,其对恶性肿瘤患者体内凝血和纤溶平衡状态的改变具有重要临床意义。本研究经ROC曲线分析发现,D-二聚体、PIC及TAT诊断恶性肿瘤患者血栓形成的ROC曲线下面积分别为0.64、0.86、0.79,敏感度分别为52.17%、75.23%、73.91%,特异度分别为82.57%、91.30%、77.06%。结果表明,相比D-二聚体和TAT,PIC对患者血栓形成的诊断效能可能更高。
综上所述,恶性肿瘤患者体内存在血浆凝血和纤溶活性异常改变的情况,并且PIC对患者血栓形成的诊断效能明显高于D-二聚体和TAT。
参考文献
[1]张文曦,孔祥图,代兴斌,等.3486例血液病住院患者并发血栓栓塞的临床研究[J].临床血液学杂志,2018,31(1):24-28.
[2]Otani K,Ishihara S,Hata K,et al.Colorectal cancer with venous tumor thrombosis[J].Asian J Surg,2018,41:197-202.
[3]Kanaji N,Mizoguchi H,Inoue T,et al.Clinical features of patients with lung cancer accompanied by thromboembolism or disseminated intravascular coagulation[J].Ther Clin Risk Manag,2018,14:1361-1368.
[4]Tian B,Song C,Li H,et al.Erratum to the significance of perioperative coagulation and fibrinolysis related parameters after lung surgery for predicting venous thromboembolism:a prospective,single center study[J].J Thorac Dis,2018,10:E510.
[5]中华医学会外科学分会血管外科学组.深静脉血栓形成的诊断和治疗指南(第3版)[J].中华血管外科杂志,2017,2(4):201-208.
[6]Gezelius E,Flou Kristensen A,Bendahl PO,et al.Coagulation biomarkers and prediction of venous thromboembolism and survival in small cell lung cancer:A sub-study of RASTEN-A randomized trial with low molecular weight heparin[J].PLoS One,2018,13:e0207387.
[7]李辉,姜格宁.胸部恶性肿瘤围术期静脉血栓栓塞症预防中国专家共识(2018版)[J].中国肺癌杂志,2018,21(10):739-752.
[8]Falanga A,Russo L,Milesi V,et al.Mechanisms and risk factors of thrombosis in cancer[J].Crit Rev Oncol Hematol,2017,118:79-83.
[9]Kitayama H,Kondo T,Sugiyama J,et al.Venous thromboembolism in hospitalized patients receiving chemotherapy for malignancies at Japanese community hospital:prospective observational study[J].BMC Cancer,2017,17:351.
[10]Haruki K,Shiba H,Saito N,et al.Risk stratification using a novel liver functional reserve score of combination prothrombin time-international normalized ratio to albumin ratio and albumin in patients with hepatocellular carcinoma[J].Surgery,2018,164:404-410.
[11]Drummond S,Gotskie G,Landi D,et al.Partial Thromboplastin Time:Accurate Measurement through Evidence-Based Practice[J].Clin J Oncol Nurs,2019,23:431-433.
[12]Han D,ó Hartaigh B,Lee JH,et al.Impact of D-Dimer for Prediction of Incident Occult Cancer in Patients with Unprovoked Venous Thromboembolism[J].P LoS One,2016,11:e0153514.
[13]Leci-Tahiri L,Zherka-Saracini H,Tahiri A,et al.Bilateral internal jugular veinthrombosis due to malignant tumor[J].J Med Case Rep,2018,12:42.
[14] Reitter EM,Kaider a,Ay C,et al.Longitudinal analysis of hemostasis biomarkers in cancer patients during antitumor treatment[J].J Thromb Haemost,2016,14:294-305.
[15]Chan SL,Chong CC,Chan AW,etal.Management of hepatocellular carcinoma with portal vein tumor thrombosis:Review and update at 2016[J].World J Gastroenterol,2016,22:7289-7300.
(临床血液学杂志第33卷)
