发布时间:2021年01月08日 08:39:35 来源:振东健康网
黄妙灵1 刘序友2,
1南方医科大学深圳医院健康管理中心(广东深圳518110);
2广州市红十字会医院,暨南大学附属广州红十字会医院消化内科(广州 510220)
【摘要】目的:探讨慢性萎缩性胃炎(chronic atrophic gastritis,CAG)病理改变与幽门螺旋杆菌(Helicobacter Pylori,Hp)感染、血清胃蛋白酶原、胃泌素-17的相关性。方法:选取127例病理诊断为CAG患者,14C呼气试验检测Hp,ELISA检测血清PGI、PGII、G-17水平,比较不同病理特征与Hp感染及血清PGI、PGII、PGR、G-17的关系,并绘制ROC曲线,评价其诊断价值。结果:CAG组Hp感染率较高,血清PGI、PGII、PGR、G-17下降,胃粘膜萎缩程度越重,血清PGI、PGII、PGR、G-17水平下降越明显。Hp感染阳性者以中度炎症和中度萎缩为主。经PGI、PGII、PGR、G-17绘制CAG的ROC曲线下面积分别为0.981、0.795、0.800和0.661,具有较高的诊断性能。结论:联合检测Hp及PG、G-17能提高萎缩性胃炎的诊断性能,有助于对胃黏膜萎缩程度风险分层和早期诊断。
【关键词】慢性萎缩性胃炎;幽门螺旋杆菌;胃蛋白酶原;胃泌素-17
[中图分类号] R573.3+2
Correlations between pathological changes and helicobacter pylori infection,pepsinogen,gastrin-17in chronic atrophic gastritis
HUANG Miaoling*,LIU Xuyou.
Health Management Center,Shenzhen Hospital,Southern Medical University,Shenzhen 518110,China
【Abstract】Objective:To investigate the correlations between pathological changes and helicobacter pylori infection,serum pepsinogen and gastrin-17 of chronic atrophic gastritis(CAG).Methods:127 patients with CAG were enrolled in the study.Their serum levels of PGI,PGII,G-17 andHpwere detected by 14 C-UBT test and ELISA.ROC curve was drawn to evaluate its diagnostic value.Results:The infection rate of Hpwas higher,and the serum levels of PGI,PGII,PGR and G-17 decreased in the CAG group.The more severe the gastric mucosa atrophy was,the more remarkably the serum levels of PGI,PGII,PGR and G-17 decreased.Moderate inflammation and moderate atrophy were predominant in the Hp-infected patients.The area under the ROC curve of CAG was 0.981,0.795,0.800 and 0.661 by PGI,PGII,PG Rand G-17,respectively.Conclusion:The combined test of Hp,PG and G-17 can improve the affirmative diagnose of atrophic gastritis,and it helps to stratify the atrophy risk and make early diagnosis of gastric mucosa atrophy.
【Key words】chronic atrophic gastritis;Helicobacter Pylori;pepsinogen;gastrin-17
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是公认的胃癌前病变[1],其主要特征表现为胃黏膜中腺体萎缩,确诊需结合胃镜和病理诊断[2]。因腺体萎缩常呈灶性分布,病理诊断受活检部位及幽门螺旋杆菌(Hp)感染等因素影响,导致胃镜和病理诊断准确率偏低。血清胃蛋白酶原(pepsinogen,PGI和PGII)和胃泌素-17(gastrin-17,G-17)表达水平被称为"血清学活检",可用来筛查胃黏膜萎缩[3]。研究指出,Hp感染是CAG重要因素之一[4],早期明确是否Hp感染及监测血清PG、G-17水平对诊断CAG有重要价值[5],但Hp感染、血清PG、G-17与CAG病理改变相关性尚缺深入研究。故在此基础上回顾性分析127例CAG患者内镜检查及Hp感染、血清PG、G-17检测结果并探讨其相关性,报告如下。
1、资料与方法
1.1研究对象及资料 选择2019年6月至2019年12月间诊断为CAG患者为研究对象共127例,其中男76例,女51例,年龄41~68岁,平均(49.95±12.84)岁。同期诊断为慢性非萎缩性胃炎(CNAG)患者为对照组共288例,其中男157例,女131例,年龄36~67岁,平均(47.61±11.36)岁。回顾收集患者基本资料、胃镜、Hp、病理组织活检及胃标志物三项等结果。
1.2纳入标准和排除标准 (1)纳入标准:①年(龄18~70岁;②符合《中国慢性胃炎共意见2017年,上海)》中的诊断标准[6];③临床资料完整,经医院伦理委员会论证通过并签署知情同意书。(2)排除标准:①胃及十二指肠溃疡、胃癌、胃泌素瘤;②合并心、肺、肝、肾等脏器功能障碍;③近1个月有使用抗菌药物、胃黏膜保护剂、PPI制剂;④曾接受胃部切除手术者。
1.3胃镜检查 所有研究对象均行胃镜检查并取活组织进行病理检查。活检部位包括:胃窦距幽门约2 cm处、胃体距贲门约8 cm处、胃角;若有可疑病灶则在可疑病灶处再取1块活组织。Hp检测采用14C呼气试验,以呼气试验阳性为Hp现症感染。
1.4ELISA实验 清晨采集患者空腹静脉血4 mL,离心后收集血清置于-20℃冰箱中。按照ELISA检测说明书进行,检测各组研究对象的血清PGI、PGII、G-17水平,并计算胃蛋白酶原比值(pepsinogen ratio,PGR=PGI/PGII)[7]。
1.5统计学分析 采用SPSS 22.0软件进行统计分析,计量资料以表示,两组间比较采用t检验,多组间比较采用方差分析,计数资料以例数和百分数表示,比较采用卡方检验,各指标对萎缩性胃炎诊断效果用灵敏度、特异性和ROC曲线下面积(AUC)评价。P<0.05为差异有统计学意义。
2、结果
2.1一般资料 按诊断标准及排除标准共纳入CAG患者127例,纳入对照组CNAG患者288例,两组性别、年龄差异均无统计学意义(P>0.05),具有可比性,见表1。

2.2两组患者Hp感染情况及血清PGI、PGII、PGR、G-17水平比较 两组共415例患者中,Hp感染患者254例,总感染率为61.20%,其中CAG组感染率明显高于CNAG组,差异有统计学意义(P<0.05)。两组患者血清PGI、PGII、PGR、G-17水平结果显示,与CNAG组相比,CAG组的PGI、PGII、PGR及G-17水平均下降,两组比较差异均有统计学意义(P<0.05),见表2。

2.3不同病理特征与Hp感染的关系 127例CAG患者中根据Hp感染分为阳性组和阴性组,并根据慢性炎症、萎缩、肠上皮化生和上皮内瘤变不同病理特征分级。在Hp感染阳性组中,慢性炎症反应以中度(++)为主,重度(+++)次之;Hp阴性组则以轻、中度炎症为主;两组之间比较差异有统计学意义(P<0.05),即Hp感染阳性组慢性炎症程度较Hp阴性组严重,慢性炎症与Hp感染有关。Hp感染阳性组以中度萎缩为主,Hp阴性组则以轻度萎缩为主;两组比较差异有统计学意义(P<0.05),即Hp感染阳性组萎缩程度较Hp阴性组严重,胃黏膜萎缩与Hp感染有关。CAG患者肠上皮化生、上皮内瘤变程度在Hp感染阳性组和阴性组中比较,差异均无统计学意义(P>0.05),见表3。
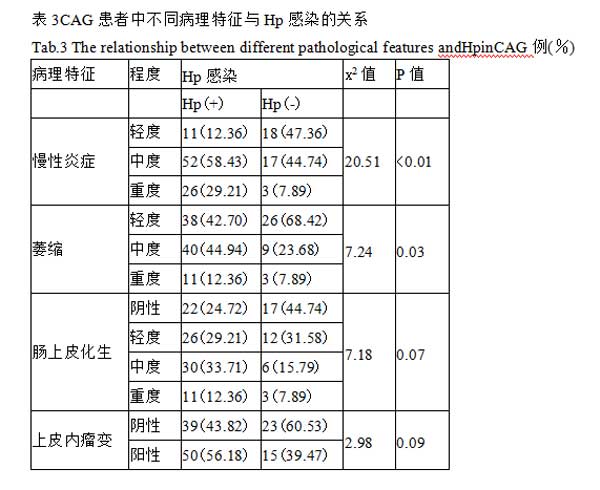
2.4不同部位萎缩性胃炎与Hp感染情况及血清PGI、PGII、PGR、G-17水平比较 将127例CAG患者按萎缩部位分3组:胃窦萎缩组65例、胃体萎缩组44例和全胃萎缩组18例,3组中以胃窦萎缩组的Hp感染率最高,胃体萎缩组最低,3组Hp感染阳性率差异有统计学意义(P<0.05)。胃窦萎缩组、胃体萎缩组、全胃萎缩组的血清PGI、PGII、PGR及G-17水平比较如下:PGI在胃窦萎缩组、胃体萎缩组和全胃萎缩组中均降低,以胃体萎缩组降低最明显,全胃萎缩组次之,两两之间比较差异有统计学意义(P<0.05);PGII在全胃萎缩组中下降明显,胃窦萎缩组与全胃萎缩组、胃体萎缩组与全胃萎缩组比较差异均有统计学意义(P<0.05);PGR以胃体萎缩组降低最明显,胃窦萎缩组与胃体萎缩组比较,差异有统计学意义(P<0.05);G-17在胃窦萎缩组中明显下降,而在胃体萎缩组中升高显著,两两之间比较差异有统计学意义(P<0.05),见表4。
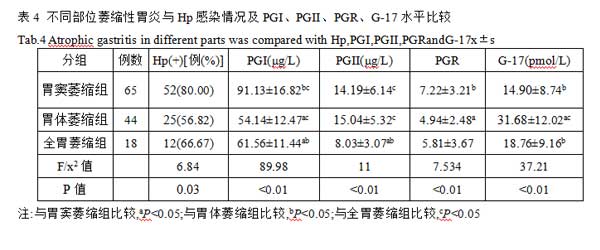
2.5不同程度萎缩性胃炎与Hp感染情况PGI、PGII、PGR、G-17水平比较 将127例CAG患者按萎缩程度分3组:轻度64例,中度49例和重度14例,3组中以中度萎缩性胃炎组的Hp感染率最高,重度次之,3组Hp感染阳性率差异有统计学意义(P<0.05)。3组研究对象PGI、PGII、PGR及G-17指标比较,随着胃黏膜萎缩程度加重,PGI、PGII、PGR及G-17水平逐渐降低,各指标的两两之间比较差异均有统计学意义(P<0.05),提示胃黏膜萎缩程度越重,PGI、PGII、PGR及G-17水平下降越明显,见表5。
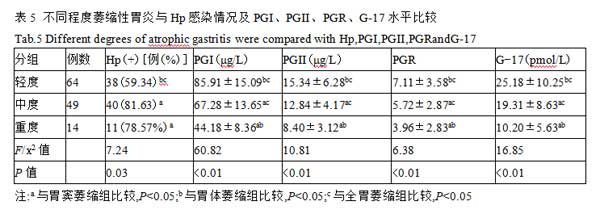
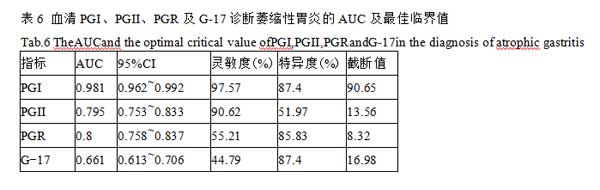
2.6血清PGI、PGII、PGR及G-17诊断萎缩性胃炎的诊断性能分析 以CAG组为病例组,CNAG组为对照组分别绘制PGI、PGII、PGR、G-17的ROC曲线。AUC越大,指标对疾病的诊断效能越高,PGI的AUC值为0.981,具有更高的诊断性能。诊断萎缩性胃炎的PGI、PGII、PGR、G-17的最佳临界值分别为90.65 μg/L、13.56 μg/L、8.32 和16.98 pmol/L。PGI诊断萎缩性胃炎的灵敏度最高,为97.57%;PGI和G-17诊断萎缩性胃炎的特异度最高,均为87.40%,见表6及图1。
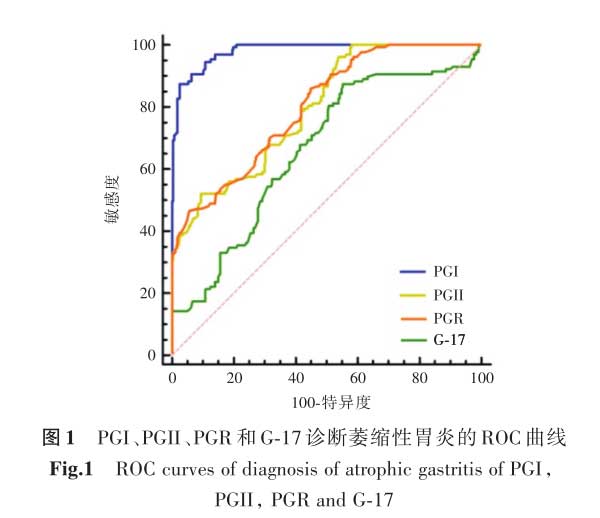
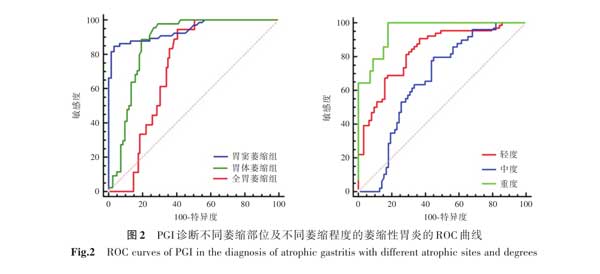
2.7血清PGI诊断不同萎缩部位及不同萎缩程度的萎缩性胃炎的诊断性能分析 在CAG组中分别以不同萎缩部位及萎缩程度分组,绘制PGI的ROC曲线。在不同萎缩部位分组中,PGI诊断胃窦、胃体及全胃萎缩性胃炎AUC分别为:0.941(0.885~0.975)、0.867(0.795~0.921)、0.719(0.633~0.795);在不同萎缩程度分组中,PGI诊断轻度、中度及重度萎缩性胃炎AUC分别为:0.830(0.754~0.891)、0.661(0.572~0.743)、0.953(0.900~0.982)。PGI对胃窦萎缩性胃炎及重度萎缩性胃炎,具有更高的诊断性能(图2)。
3、讨论
Hp感染可通过多种途径损伤胃黏膜,最终导致慢性萎缩性胃炎、胃癌的发生[8-10]。本研究以同期诊断为非萎缩性胃炎作为对照组与萎缩性胃炎患者比较,结果显示,CAG患者Hp感染的阳性率比CNAG组高,Hp阳性患者存在慢性炎症及萎缩程度较Hp阴性者严重,不同部位的萎缩性胃炎中,以胃窦萎缩组的Hp感染率最高。表明Hp感染可能促进慢性萎缩性胃炎的发生,Hp感染在CAG向肠化、异型增生乃至胃恶性肿瘤进展和转变的过程中,起到了推波助澜作用[11-12],是导致CAG病情加重乃至恶化的主要因素之一。
血清PGI由胃底(体)腺的主细胞和颈黏液细胞分泌,主要反映胃底黏膜的功能状态,PGⅡ由贲门腺、胃窦幽门腺和十二指肠Brunner腺分泌,反映全胃黏膜的分泌功能[7,13]。PG在胃酸作用下活化成胃蛋白酶,若机体胃黏膜发生病变,则会导致胃黏膜细胞及腺体功能异常,PGⅠ和PGⅡ水平也随之改变[14]。G-17是由胃窦部及十二指肠近端黏膜中G细胞分泌,可刺激盐酸、胰液和胆汁分泌,主要受胃内pH值、G细胞数量和进食(如蛋白质)影响,是反映胃窦分泌功能的敏感指标[15]。本研究中,CAG组血清PGI、PGII、PGR及G-17水平较CNAG组均显著下降,提示胃黏膜萎缩可影响血清PG及G-17水平。由于PG及G-17由胃黏膜不同部位分泌,导致不同部位及不同程度的胃黏膜萎缩对血清PG及G-17水平有不同的影响。本研究按不同部位及不同程度的胃黏膜萎缩分组,结果显示:胃体萎缩组和全胃萎缩组的PGI、PGII、PGR水平均低于胃窦萎缩组;胃窦萎缩组和全胃萎缩组G-17水平低于胃体萎缩组,以胃窦萎缩组下降显著;随着胃黏膜萎缩程度加重,PGI、PGII、PGR及G-17水平下降越明显。导致血清PG及G-17水平变化的原因分析:当胃体黏膜发生萎缩时,主细胞数量减少或消失,由胃体分泌的PGI减少,而PGII来源比较广,受胃体黏膜萎缩影响较小,PGII水平稍下降或不变,导致PGR下降。因此PGI及PGR在胃体萎缩时下降明显,PGII在胃窦萎缩或胃体萎缩时轻度下降,而PGI、PGII、PGR在全胃萎缩中的水平,则取决于胃窦和胃体萎缩所占的比重[16]。随着胃黏膜萎缩程度加重,PGI、PGII分泌均受影响,导致PGI、PGII及PGR水平均下降,其下降程度与胃黏膜萎缩程度呈正相关。血清G-17主要由胃窦的G细胞产生,其产生也受胃酸分泌的调节,当胃窦萎缩时,G细胞数量明显减少,因此分泌的G-17水平明显降低[17]。当胃体萎缩时,由于PGI及PGR下降,胃酸分泌减少,而G细胞数量不减少,导致G-17水平出现反馈性升高。随着胃黏膜的萎缩程度加重,G细胞数量逐渐减少,G-17水平逐渐下降[15,18]。在CAG组中以不同萎缩部位及不同萎缩程度ROC曲线中显示,PGI对胃窦萎缩性胃炎及重度萎缩性胃炎,具有更高的诊断性能,故联合PG、PGR及G-17检测有助于判断胃萎缩部位及其严重程度[13]。
所纳入病例诊断萎缩性胃炎的PGI、PGII、PGR、G-17的最佳临界值分别为90.65、13.56μg/L、8.32、16.98 pmol/L。单一指标中以PGI对诊断萎缩性胃炎价值较高。不同研究报道的临界值差异较大,这可能与选取病例中萎缩性胃炎的萎缩部位、程度以及Hp感染等不完全相同导致胃腺体损害及丧失程度不同有关[19],也可能与各地生活习惯及饮食结构差异导致不同人群血清PG及胃泌素差异有关[20]。
综上所述,联合检测PG、G-17及Hp能提高萎缩性胃炎的诊断性能,可作为胃镜检查前的第一线萎缩性胃炎普查方式,或通过此方法加强慢性萎缩性胃炎胃镜的随访,有助于对胃黏膜萎缩程度风险分层和早期诊断,从而为胃癌的早期防治提供依据。
参考文献
[1]RODRIGUEZ-CASTRO K I,FRANCESCHI M,NOTO A,et al.Clinical manifestations of chronic atrophic gastritis[J].Acta Biomed,2018,89(8-s):88-92.
[2]SUN Y,WANG S,QI M,et al.Psychological distress in patients with chronic atrophic gastritis:The risk factors,protection factors,and cumulative effect[J].Psychol Health Med,2018,23(7):797-803.
[3]ZHAO X,WU M,ZHANG D,et al.The relationship of interpersonal sensitivity and depression among patients with chronic atrophic gastritis:The mediating role of coping styles[J].J Clin Nurs,2018,27(5-6):e984-e991.
[4]卢圆媛,尹伶.幽门螺旋杆菌感染与疾病相关性研究进展[J].实用医学杂志,2018,34(20):3486-3489.
[5]HUANG Y K,YU J C,KANG W M,et al.Significance of serum pepsinogens as a biomarker for gastric cancer and atrophic gastritis screening:A systematic review and meta-analysis[J].PLoS ONE,2015,10(11):e0142080.
[6]中华医学会消化病学分会.中国慢性胃炎共识意见(2017年,上海)[J].中华消化杂志,2017,11(37):721-738.
[7]GONI E,VENERITO M,SCHULZ C,et al.Influence of laboratory-related and endoscopy-related factors on the assessment of serum pepsinogens and gastrin-17[J].Eur J Gastroenterol Hepatol,2017,29(12):1340-1345.
[8]LUO W,LI Y,LUO Z,et al.Chronic atrophic gastritis aggravate chronic periodontitis with helicobacter pylori infection and cd4+th cytokines infiltration[J].Histo Histopathol,2019,21(9):18187.
[9]卫银银,闵亚莉,苗向霞,等.叶酸、维生素b(12)对幽门螺旋杆菌阴性慢性萎缩性胃炎的疗效分析[J].实用医学杂志,2017,33(21):3606-3610.
[10]黄曼玲,孙圣斌,徐丹,等.幽门螺旋杆菌感染与胃镜下的不同胃炎及病理之间的关系[J].实用医学杂志,2014,30(14):2245-2247.
[11]HOLLECZEK B,SCHOTTKER B,BRENNER H.Helicobacter pylori infection,chronic atrophic gastritis and risk of stomach and esophagus cancer:Results from the prospective populationbased esther cohort study[J].Int J Cancer,2020,146(10):2773-2783.
[12]YAMADA S,TOMATSURI N,KAWAKAMI T,et al.Helicobacter pylori eradication therapy ameliorates latent digestive symptoms in chronic atrophic gastritis[J].Digestion,2018,97(4):333-339.
[13]ZHAO W X,LIU Z F,LI X L,et al.Correlations of serum homocysteine,vegf and gastrin 17 with gastric cancer and precancerous lesions[J].Eur Rev Med Pharmacol Sci,2019,23(10):4192-4198.
[14]BURCLAFF J,WILLET S G,SAENZ J B,et al.Proliferation and differentiation of gastric mucous neck and chief cells during homeostasis and injury-induced metaplasia[J].Gastroenterology,2020,158(3):598-609.e595.
[15]YU G,WANG G X,WANG H G,et al.The value of detecting pepsinogen and gastrin-17 levels in serum for pre-cancerous lesion screening in gastric cancer[J].Neoplasma,2019,66(4):637-640.
[16]NOH G,KIM N,CHOI Y,et al.Long-term follow up of serum pepsinogens in patients with gastric cancer or dysplasia after helicobacter pylori eradication[J].J Gastroenterol Hepatol,2020.2020,35(9):1540-1548.
[17]张青松,朱传卫,王三六,等.整合素基因多态性与胃癌发病风险的相关性[J].实用医学杂志,2019,35(8):1282-1287.
[18]WANG S M,ROTH M J,MURPHY G A,et al.Serologic profile of antiparietal cell antibodies,pepsinogens,and h.Pylori and risk of upper gastrointestinal cancer:A nested case-control study in china[J].Cancer Epidemiol Biomarkers Prev,2019,28(12):2022-2029.
[19]LI Y,ZHANG Y,MENG H,et al.Efficacy and safety of acupuncture therapy for chronic atrophic gastritis:A meta-analysis and trial sequential analysis protocol[J].Medicine (Baltimore),2019,98(35):e17003.
[20]BANKS M,GRAHAM D,JANSEN M,et al.British society of gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma[J].Gut,2019,68(9):1545-1575.
(实用医学杂志2020年第36卷第20期)
