发布时间:2021年05月31日 09:34:03 来源:振东健康网
毛龙飞1,2,吴琼1,孙格3,李月明1
(1.南开大学药学院/药物化学生物学国家重点实验室/天津市分子药物研究重点实验室,天津300353;
2.河南师范大学化学化工学院,河南新乡453007;
3.南方医科大学基础医学院,广东广州510515)
【摘要】世界癌症研究机构(IARC)调查结果显示,肺癌是发生率和死亡率最高的癌症,其中又以非小细胞肺癌所占比例最高(约80%)。小分子药物抑制表皮生长因子受体-酪氨酸激酶可实现靶向治疗,因其高效、低毒、高选择性等优势在非小细胞肺癌的治疗中占有非常重要的地位。上世纪八十年代,第一代可逆、非选择性的具有喹啉胺结构的表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKIs)吉非替尼和厄洛替尼问世,与传统的化学治疗药物相比,此类抑制剂显著延缓了疾病的进展,但服药后出现的耐药性一直是其短板。针对这一问题,后续开发了基于喹啉胺结构的不可逆、非选择性的第二代EGFR-TKIs,具有嘧啶结构的不可逆的、选择性抑制突变的第三代EGFR-TKIs以及目前正在研发的第四代具有大环结构的EGFR-TKIs。本文概述了当前临床使用的EGFR-TKI类抗非小细胞肺癌药物及其与相应的靶蛋白之间的作用方式,希望能为非小细胞临床治疗及同类药物的设计提供参考。
【关键词】癌症;非小细胞肺癌;表皮生长因子受体-酪氨酸激酶;靶向治疗;耐药性
[中图分类号]R914[文献标志码]A
Research progress in EGFR-TKIs for clinical treatment of NSCLC MAO Long-fei1,2,WU Qiong1,SUN Ge3,LI Yue-ming1
(1.State Key Laboratory of Medicinal Chemical Biology,College of Pharmacy and Tianjin Key Laboratory of Molecular Drug Research,Nankai University,Tianjin 300353,China;2.School of Chemistry and Chemical Engineering,Henan Normal University,Xinxiang 453007,China;3.School of Basic Medical Sciences,Southern Medical University,Guangzhou 510515,China)
【Abstract】Census by The International Agency for Research on Cancer(IARC) shows that lung cancer is the leading cause of cancer incidence and mortality,among which non-small cell lung cancer(NSCLC) owns the highest proportion(about 80%).Targeted therapy using small molecule inhibitors against epidermal growth factor receptor-tyrosine kinase has shown the advantage of high efficiency,high selectivity and low toxicity in the treatment of NSCLC.In the 1980's,the first generation of EGFR tyrosine kinase inhibitors(EGFR-TKIs) with quinoline amine structure were developed.These EGFR-TKIs were reversible and non-selective EGFR-TKIs,and significantly delayed the progress of the disease compared with traditional chemotherapy.However,these therapeutics also showed their weakness of EGFR-TKIs such as drug resistance or adverse effects.To tackle this problem,the second generation of irreversible,nonselective EGFR-TKIs bearing the quinoline amine structure,the third generation of irreversible,selective inhibitors bearing the pyrimidine structure,and the fourth generation EGFR-TKIs bearing the macrocyclic structures were developed for the treatment of NSCLC.In this paper,the clinically used EGFR-TKI-type anti-NSCLC drugs were reviewed,and their possible interaction with the target-proteins was discussed to provide information for the clinical treatment of NSCLC as well as the design of similar anti-NSCLC drugs.
【Key words】cancer;non-small cell lung cancer (NSCLC);epidermal growth factor receptor-tyrosine;targeted therapy;drug resistance
心血管疾病、癌症、慢性呼吸道疾病和糖尿病等非传染性慢性疾病已经成为全球范围内导致死亡的主要原因。世界卫生组织(WHO)统计结果显示,在全球大约50%的国家,癌症是导致死亡的首要或次要原因,是阻碍每个国家预期寿命增长的最重要因素[1-2]。而且,癌症的发生率和死亡率正逐年升高,世界癌症研究机构(IARC)对全球20个地区的统计结果显示,2018年全球癌症新发病例约1810万,由癌症导致的死亡病例约960万,其中肺癌是发生率和致死率最高的癌症。在新发癌症病例中,肺癌患者数量约209万,占所有新发病例的11.6%。肺癌导致的死亡病例约176万,占所有死亡病例的18.4%[1]。
2018年中国新诊断肺癌病例约99.4万,约占总癌症新发病例的18.1%,人群中的发病率为35.1/10万,显著高于世界平均水平22.5/10万。而中国2018年由肺癌导致的死亡病例约为77.4万,占癌症导致死亡病例的24.1%,肺癌死亡率为30.9/10万,高于世界平均水平18.6/10万[3-4]。虽然2018年中国和美国的肺癌发生率相同(35.1/10万),但在中国肺癌导致的死亡率却为美国的1.4倍(分别为30.9/10万和22.9/10万)[4]。
中国人口基数巨大,伴随逐渐的人口老龄化,癌症给社会和家庭带来的负担也越来越沉重。因此,尽早推动肺癌早期高效的预防、诊断和治疗是科研工作者和临床医生亟待解决的难题[5]。近年来的研究显示,表皮生长因子受体酪氨酸激酶(EGFR-TK)是一个重要的抗肿瘤药物靶点,它的磷酸化作用与细胞的许多调节有关,一旦其过度表达,细胞的生长就会处于失控状态,从而导致肿瘤细胞的恶性增殖。
表皮生长因子受体(EGFR)是一种由HER1(ErbB1)基因编码的细胞表面受体,同HER2/neu(ErbB2)、HER3(ErbB3)、HER4(ErbB4)均属于酪氨酸激酶受体(ErbB)家族。表皮生长因子(EGF)和转化生成因子(TGFα)为EGFR最主要的配体,EGFR胞外部分和细胞外的配体结合使EGFR单体和其他EGFR分子或者其他ErbB家族蛋白受体形成二聚体。二聚化后的EGFR胞内酪氨酸激酶区域与1分子ATP结合,经磷酸化后使该区域激活。随后通过自磷酸化或转磷酸化作用使C-端上特定的酪氨酸残基发生磷酸化,这些磷酸化的位点为其他下游信号分子提供作用位点,通过激活下游信号通路RAS-RAF-MEK-ERK和RAS-PI3K-PTEN-A-KT-mTOR,促进肿瘤细胞增殖、分化和迁移[6-12]。
鉴于EGFR在调控肿瘤细胞生长机制方面的重要作用,通过抑制其活性表达可以有效抑制肿瘤细胞的生长,因此以EFGR为靶点的靶向抗肿瘤药物的开发得到了非常显著的发展。美国食品药品管理局(FDA)分别于2003年和2004年批准了第一代EGFR酪氨酸激酶抑制剂(EGFR-TKIs)吉非替尼和厄洛替尼上市,EGFR靶向抑制剂研发从此起步。与传统化疗药物相比,靶向药物可以使患者的中位生存期从4个月提升到40个月以上。然而患者在服药几个月内会产生对第一代EGFR-TKIs的耐药性。其中,获得性耐药性最常见的机制是外显子20中的次级T790M(苏氨酸替代甲硫氨酸)把控点发生突变。为了克服对第一代TKIs获得性耐药性问题,目前已经开发了几种第二代不可逆EGFR-TKIs。第二代EG-FR-TKIs存在一些特殊的α,β-不饱和基团(迈克尔受体),可与EGFR的ATP结合裂隙中的Cys797巯基发生共价结合,形成不可逆抑制,从而增加对EGFR-TK的抑制作用。然而,第二代EGFR抑制剂在治疗过程中同时靶向突变和非突变的EGFR靶点,这不但会引起治疗剂量的不足,还会导致治疗过程中皮肤和消化系统存在毒副作用过大的风险。为了克服上述问题,逐渐开发出第三代和第四代EGFR抑制剂。本文作者对已经上市的EGFR-TKIs及其部分药理活性进行总结,希望对从事相关研究的同行提供一定的参考。
1、第一代EGFR酪氨酸激酶抑制剂
第一代可逆性EGFR-TKIs可选择性地与EGFR酪氨酸激酶的ATP结合位点结合,从而抑制EGFR的磷酸化,进而阻止下游信号通路的激活[8]。最早出现的第一代EGFR-TKIs吉非替尼(gefitinib,1,图1)和厄洛替尼(erlotinib,2,图1)最初被批准用于治疗经传统化疗失败的晚期非小细胞肺癌(NSCLC)[13],并在早期临床试验中显示出有效性,EGFR-TKIs因此进入临床用药指南[14-18]。2004年,多个临床研究表明,非小细胞肺癌对厄洛替尼或吉非替尼的敏感性与EGFR特定的激活突变相关[14-16]。2006年在一项Ⅱ期临床试验中,Asahina等[19]日本研究人员首次将吉非替尼作为一线治疗药物,用于16例EGFR基因敏感突变的晚期非小细胞肺癌患者,有效率达75%。此后,多个大型Ⅲ期随机对照试验证实了EGFR-TKIs作为EGFR基因敏感突变非小细胞肺癌一线治疗的优越性,与传统的化学治疗相比,EGFR-TKIs在无进展生存率、客观应答率、生活质量和耐受性方面均有更好的表现[18,20-22]。这些工作进一步确立了EGFR-TKIs在晚期EG-FR突变非小细胞肺癌患者中的一线治疗作用。
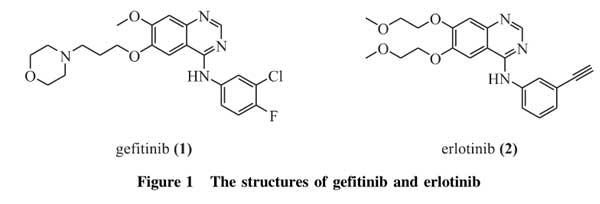
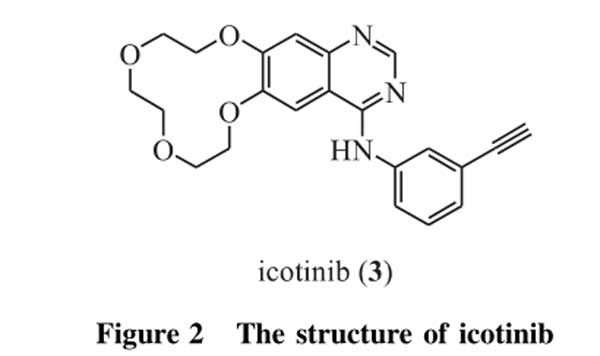
埃克替尼(icotinib,3,图2)是中国第一个EGFR-TKI,于2011年6月经中国食品药品监督管理局(CFDA)批准上市,用于治疗晚期非小细胞肺癌。在前期临床试验中,埃克替尼和吉非替尼分别用于晚期非小细胞肺癌患者时,两者中位总生存期相当。回顾性研究发现,埃克替尼对EGFR突变的非小细胞肺癌患者的治疗效果比对EGFR野生型非小细胞肺癌患者的治疗效果更好,中位无进展生存期和中位总生存期都显著延长[23-24]。近期的一系列临床试验也表明,埃克替尼作为一线药物治疗晚期EGFR突变敏感非小细胞肺癌的效果较传统的化学治疗药物具有明显的优势[25]。此外,埃克替尼能延缓EGFR基因敏感突变非小细胞肺癌伴脑转移患者的中位总生存期,与传统放疗的治疗效果相当,放疗后给予埃克替尼能显著遏制脑部转移灶的进展[26]。
2、第二代EGFR酪氨酸激酶抑制剂
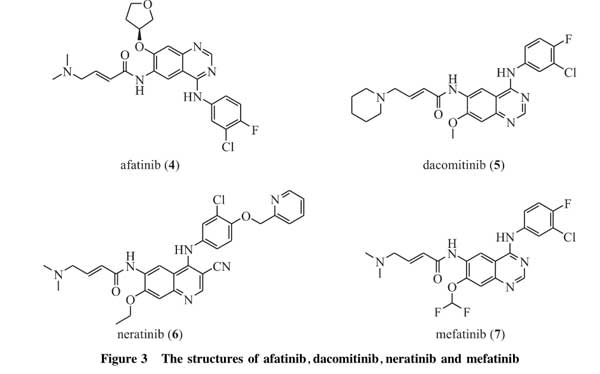
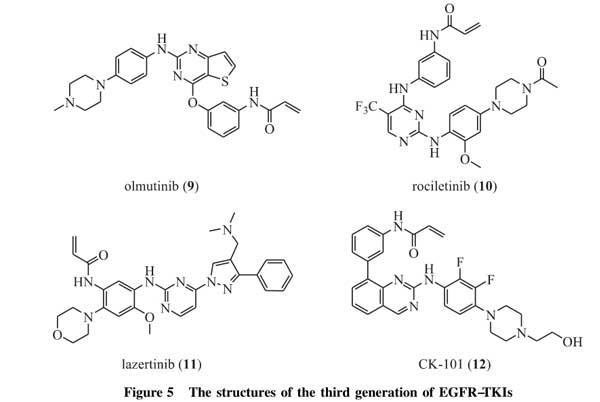
尽管第一代可逆性EGFR-TKIs在非小细胞肺癌靶向治疗中显著延缓了疾病的进展,但是耐药性问题逐渐显现,在使用第一代EGFR-TKIs约9~14个月后,几乎所有的肿瘤再次进入进展期[27]。其中约60%的患者在EGFR的ATP结合口袋处产生新的突变,即第20号外显子上第790号位点氨基酸残基由苏氨酸突变为甲硫氨酸(T790M),该突变使ATP与EGFR的ATP结合位点的亲和性增加,由于该突变发生在酪氨酸激酶域,因此会阻碍EGFR-TKIs与该位点的结合[27-28]。为了解决耐药性问题,研究人员设计了不可逆的EGFR-TKIs,通过与结合位点共价结合来增强对肿瘤细胞的持久抑制,从而克服上述突变带来的问题。目前被批准用于临床的第二代EGFR-TKIs有阿法替尼(afatinib,4)、达克替尼(dacomitinib,5)和来那替尼(neratinib,6),结构式如图3所示。三者均为EGFR和HER2的不可逆抑制剂,不仅可以竞争性地占据EGFR上的ATP结合位点,并且还能与EGFR结合口袋开口处附近所特有的氨基酸残基发生烷基化作用或共价键结合,进而实现对EGFR的不可逆抑制。
早期临床试验结果显示,阿法替尼和达克替尼作为第一代EGFR-TKIs治疗后的二线治疗药物时,并没有改善非小细胞肺癌患者的总生存期[29-30]。Miller等[29]在一项Ⅱb/Ⅲ临床试验中发现,用阿法替尼治疗使用厄洛替尼或吉非替尼治疗后疾病进展的非小细胞肺癌患者,虽然中位无进展生存期较安慰剂组延长(阿法替尼为3.3个月,安慰剂为1.68个月,风险比为0.38,P<0.001),但使用阿法替尼患者的中位总生存期与安慰剂组相比并无任何优势(阿法替尼为10.8个月,安慰剂为12.0个月,风险比为1.08,P=0.74)。此外,在Ⅱb期临床试验LUX-Lung1中,阿法替尼作为晚期EGFR突变敏感非小细胞肺癌的一线用药,其治疗失败时间、无进展生存期、客观缓解率均较吉非替尼明显改善,但总生存期未见明显差异[31]。目前许多临床试验证明,达克替尼作为EGFR突变敏感非小细胞肺癌的一线用药,延长了患者的总生存期,较第一代EG-FR-TKIs展示出明显的优势[32-33]。因此,达克替尼于2018年9月被FDA批准用于晚期非小细胞肺癌一线治疗。
迈华替尼(mefatinib,7,图3)是由华东医药开发的目前正在进行Ⅱ期临床研究的第二代不可逆EGFR/HE-R2高效双重抑制剂,具有高活性、高水溶性特点,可有效解决第一代EGFR-TKIs所产生的耐药性问题。
3、第三代EGFR酪氨酸激酶抑制剂
第二代不可逆性EGFR-TKIs虽然能通过与靶点的共价结合产生更持久的药效,但与第一代可逆性EGFR-TKIs一样对EGFR缺少选择性,在抑制突变型EGFR的同时也抑制了野生型EGFR活性,使皮肤和胃肠道等正常的EGFR受到影响,从而产生皮疹、腹泻等不良反应,且这类抑制剂并未显著改善T790M突变引起的耐药现象。临床上仅用于经可逆性EGFR-TKIs治疗后复发的非小细胞肺癌患者[29-30]。鉴于该类EGFR-TKIs的局限性,研究者开发了针对EGFR有选择性且可以解决耐药突变问题的第三代EGFR-TKIs[34]。第三代EG
FR-TKIs的核心结构为嘧啶,此类抑制剂可以与C797位点结合,选择性地靶向T790M突变以及EGFR基因敏感突变(第19号外显子缺失突变和L858R突变),从而解决了EGFR基因敏感突变的晚期非小细胞肺癌患者对第一代EGFR-TKIs的耐药性问题,并且降低了不良反应[35-36]。
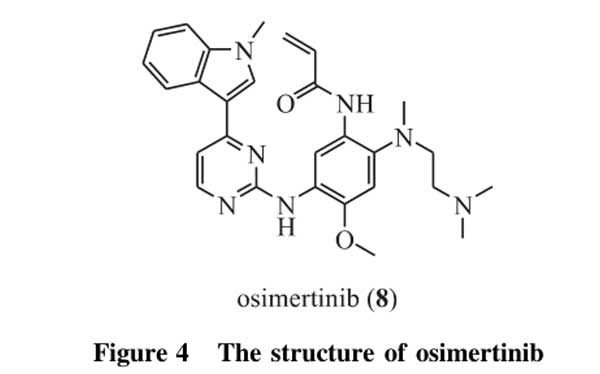
奥希替尼(osimertinib,8,图4)是目前唯一被批准用于临床的第三代不可逆性EGFR-TKI。奥希替尼以嘧啶环为基础,不可逆地结合EGFR的ATP结合口袋中的C797,能够靶向EGFR激活突变(第19号外显子缺失突变和L858R突变)或耐药相关突变T790M阳性的EGFR激活突变,并且对EGFR野生型没有抑制活性。奥希替尼不仅对一线治疗后T790M阳性的晚期非小细胞肺癌具有较好的治疗效果,而且作为EGFR敏感突变晚期非小细胞肺癌患者的一线治疗时,也表现出较第一代厄洛替尼或吉非替尼更强的治疗效果和更小的不良反应[37]。Mok等[38]将奥希替尼用于第一代EGFR-TKIs治疗后耐药的具有T790M突变的晚期非小细胞肺癌患者,结果显示,与培美曲塞(pemetrexed)和含铂化疗药物(如卡铂、顺铂)联合治疗相比较,使用奥希替尼的患者无进展生存期更长(奥希替尼为10.1个月,联合组为4.4个月,风险比为0.30),客观缓解率为71%,显著高于对照组(31%),并且延长了伴脑转移非小细胞肺癌患者的中位无进展生存期(奥希替尼为8.5个月,培美曲塞为4.2个月,风险比为0.32)。此外,使用奥希替尼的不良反应要明显小于培美曲塞和含铂化疗药物联合治疗。将奥希替尼用于EGFR敏感突变的晚期非小细胞肺癌一线治疗时,同样表现出较好的临床效果。
研究显示,与厄洛替尼或吉非替尼的标准治疗相比较,奥希替尼用于治疗携带EGFR第19号外显子缺失突变或L858R突变的非小细胞肺癌时,在中位无进展生存期和中位持续缓解时间上均表现出明显优势[39]。此外,多项研究表明,奥希替尼能更好地穿透血脑屏障[40-41],对晚期非小细胞肺癌脑转移具有较好的治疗效果,能够显著延长中枢神经系统(CNS)转移灶的无进展生存期[42-43]。奥希替尼和其他非小细胞肺癌靶向治疗药物如MET、Bcl-2、MARK信号通路抑制剂等的联合应用,也处于研究阶段[44]。
除了奥希替尼,还有大量第三代EGFR-TKIs处于临床研究阶段,如奥摩替尼、诺斯替尼、naquotinib(ASP8273)等[36]。奥摩替尼(olmutinib,9,图5)是由韩美制药研发的第三代EGFR-TKI,于2016年5月经韩国食品药品安全部(MFDS)批准上市,用于治疗非小细胞肺癌晚期或转移性T790M突变。奥摩替尼能与突变EGFR激酶结构域中的半胱氨酸残基C797发生不可逆共价结合,其半衰期超过24h,对癌细胞株H1975(EGFRL858-R/T790M)及HCC827(EGFRExon19del)具有较强的抑制作用(IC50值分别为10nmol·L-1和9.2nmol·L-1),对野生型EGFR非小细胞肺癌细胞几乎无毒性(IC50值为2225nmol·L-1),表现出良好的选择性。
诺斯替尼(rociletinib,10,图5)能够抑制突变体EGFR表达的细胞中的EGFR磷酸化,IC50值为62~187nmol·L-1,而在三个野生型EGFR表达的细胞中,IC50值大于2000nmol·L-1,表现出良好的选择性。诺斯替尼能够选择性抑制非小细胞肺癌细胞表达的突变体EGFR的生长(GI50值为7~32nmol·L-1),并诱导细胞凋亡。临床研究发现,诺斯替尼对EGFRT790M突变阳性患者的客观有效率为59%,疾病控制率为93%,中位无进展生存期为13.1个月;对EGFRT790M突变阴性患者的客观有效率为29%,疾病控制率为59%,中位无进展生存期为5.6个月。临床治疗相关不良反应比较少且轻微,不良反应主要包括恶心(35%)、疲劳(24%)、腹泻(22%)、QT间期延长(22%)及高血糖。其中高血糖主要为三级不良反应,在接受治疗剂量的患者中发生率为22%,大多数可通过减量或口服二甲双胍得到控制[45]。
Lazertinib(11,图5)是韩国柳韩洋行开发的第三代不可逆EGFR-TKI,能够穿透血脑屏障。在EGF-RL858R+T790M突变的小鼠实验中,lazertinib可使皮下和颅内病变的肿瘤呈剂量依赖性消退,且在抑制肿瘤生长及总生存期方面都比相同剂量的奥希替尼效果更好。在Ⅰ/Ⅱ期临床试验中,共纳入105例经EGFR-TKI治疗过的EGFR阳性晚期小细胞肺癌患者,其中,剂量递增组33例患者,lazertinib给药剂量为20~240mg·d;剂量扩增组72例,给药剂量为40~240mg·d,临床试验以21d为一周期。在91例可评估的患者中,客观缓解率达到64%。其中T790M阳性(76例)的客观缓解率为67%;T790M阴性(15例)的客观缓解率为47%,相比T790M阳性明显较低;9例脑转移患者的颅内客观缓解率为56%。最常见的不良反应为皮肤瘙痒(12%)、食欲下降(11%)、皮疹(11%)和便秘(10%),三级以上不良反应比例为5%,药物暴露量与剂量正相关,没有观察到剂量限制性毒性[46]。
2017年9月,美国FortressBiotech旗下控股公司CheckpointTherapeutics表示,美国FDA已授予该公司在研第三代EGFR抑制剂CK-101(RX518,12,图5)用于治疗EGFR突变阳性的非小细胞肺癌的孤儿药资格。CK-101是一款口服的第三代选择性EGFR共价抑制剂,可用于EG-FRT790M突变非小细胞肺癌患者的二线治疗及EGFR敏感突变(Del19、L858R)非小细胞肺癌患者的一线治疗。此外,临床前研究也显示,CK-101具有与免疫检查点抑制剂(PD-1或PD-L1)、cMET抑制剂、MEK抑制剂联合应用的治疗潜力。CK-101目前处在临床Ⅰ/Ⅱ期试验部分的剂量递增研究阶段[47]。
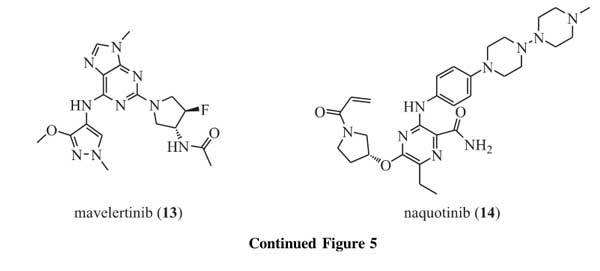
辉瑞制药开发的mavelertinib(PF-06747775,13,图5),也是一种选择性、可逆的EGFR-TKI,具有很好的体外活性,目前正处于非小细胞肺癌治疗的I期研究,主要用于二线治疗。Naquotinib(14,图5)是一种具有高效口服活性、针对突变型EGFR具有高效选择性的不可逆的EGFR-TKI,其在激酶结构域中可以与C797不可逆共价结合,抑制EGFR磷酸化可达24h,从而起到靶向治疗的作用。Naquotinib抑制EGFR突变体细胞生长的IC50值为8~33nmol·L-1,同时体外抑制野生型EGFR的IC50值为230nmol·L-1,表现出良好的选择性。而且,naquotinib对使用奥希替尼和诺斯替尼出现耐药的患者同样有效[34]。
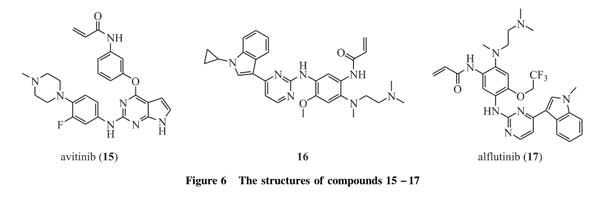
艾维替尼(avitinib,15,图6)是杭州艾森医药研究有限公司自主研发的第三代EGFR靶向药物,靶向EGFR敏感突变(Del19、L858R)和T790M突变,于2014年9月获国家CFDA和美国FDA临床批件。2015年,艾维替尼分别在中国和美国启动Ⅰ期临床研究,成为第一个进入中国临床研究并同步开展美国临床研究的自主创新药物,目前在Ⅱ期临床试验中[48]。
奥美替尼(16,图6)是豪森药业研发的具有自主知识产权的新型第三代EGFR-TKI,能够不可逆地、高选择性抑制EGFR敏感突变和EGFRT790M耐药突变。通过合理的设计,避免了非选择性代谢物的产生,同时更易通过血脑屏障,对脑转移患者仍然有效[49]。
艾氟替尼(alflutinib,17,图6)是上海艾力斯医药开发的一种不可逆的EGFR抑制剂。艾氟替尼具有强大的穿透血脑屏障的能力,可能对脑转移的非小细胞肺癌患者有效,目前已经完成Ⅰ/Ⅱ期临床研究。该临床研究结果显示,艾氟替尼对EGFR-TKI耐药后出现T790M突变的晚期非小细胞肺癌患者的客观缓解率为76.7%,疾病控制率为88.1%;在Ⅱb期临床研究中,客观缓解率为74.1%,疾病控制率为93.6%,对于脑转移患者的客观缓解率也高达65.5%。在安全性方面,3/4级不良反应的发生率为10%。因此,艾氟替尼整体安全性良好,在胃肠道不良反应、皮肤及皮下组织不良反应、心脏毒性方面的安全性数据优于同类药公布的结果[50]。
4、第四代EGFR酪氨酸激酶抑制剂
研究发现,在服用第三代EGFR靶向抑制剂的患者中,有20%~40%会产生Del19/T790M/C797S或L858R/T790M/C797S三突变。例如奥希替尼虽然解决了T790M突变的问题,但临床上已经观察到在奥希替尼二线治疗的EGFR-T790M阳性非小细胞肺癌患者中,服药10个月后出现耐药现象,其中20%~40%为C797S突变(即包含Del19/T790M/C797S或L858R/T790M/C797S的顺式或反式三突变)。
目前有很多在研新药虽然聚焦C797S耐药突变,但体内、体外药效仍不明确,或需要与抗体药物等其他疗法联用才能抑制肿瘤生长。而且目前大多数药物研发主要是针对L858R/T790M/C797S三突变,对于Del19/T790M/C797S三突变则效果不佳;或主要聚焦于c-MET、HER2突变,以C797S耐药突变为旁路靶点。因此,开发下一代EGFR抑制剂则需要满足更多临床需求:一是对Del19突变(最常见的突变形式)的EGFR具有高活性;二是能解决耐药突变T790M和/或C797S;三是对野生型EGFR无作用;四是在整个人类激酶组显示高选择性。
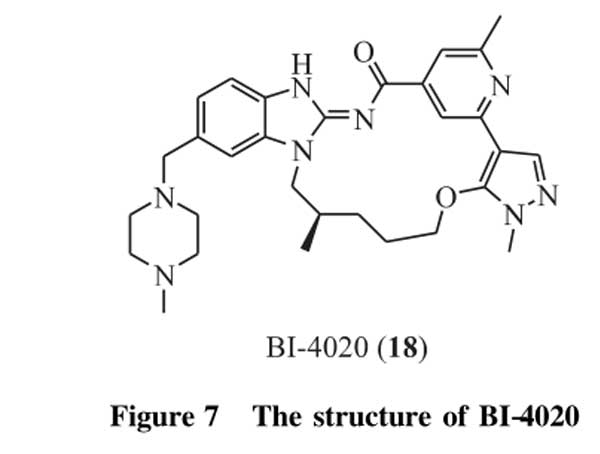
勃林格殷格翰(Boehringer-Ingelheim)制药公司通过高通量筛选和基于结构的药物设计开发了首个第四代EGFR抑制剂BI-4020(18,图7),并在JournalofMedicinalChemistry上发表了其发现过程[51]。蛋白及细胞实验均显示,BI-4020能有效抑制T790M和/或C797S突变的EGFR,并在含顺式三突变Del19/T790M/C797S的小鼠异体移植非小细胞肺癌肿瘤模型(humanPC-9)中显示出很好的治疗效果。BI-4020的溶解度和渗透性均高于奥希替尼,且对EGFRDel19/T790M/C979S突变依赖的细胞IC50值达到1nmol·L-1左右,选择性进一步提高。在带有EGFRDel19/T790M/C797S突变的PC-9小鼠异体移植肿瘤模型上,奥希替尼几乎失去了对肿瘤生长的抑制,而BI-4020则能使肿瘤消退。
5、结语
自从第一代EGFR-TKIs吉非替尼和厄洛替尼上市以来,有效地延长了非小细胞肺癌患者的生存期,直到现在这两种药依旧在临床上广泛使用。EGFR酪氨酸激酶作为一种重要的靶点依然是药学科研人员研究的热点之一。但是EGFR-TKIs的研发也面临着众多挑战:1)持续服药后,出现的各种位点突变导致的耐药性问题;2)缺少选择性导致的有效药物利用度低以及对正常细胞EGFR产生抑制导致毒副作用较大的问题。
本文作者总结了目前已经用于临床的EGFR-TKIs,并分析其与靶点的作用机制以及产生耐药的原因,希望对后续EGFR-TKIs的开发有所帮助。相信随着科技的进步及人工智能在新药研究中的应用,会有越来越多更加有效、更具选择性的EGFR-TKIs被发现,能够为非小细胞肺癌患者提供更多的有效的治疗方案,使肺癌的诊治向精准化个体化治疗的目标迈进。
参考文献
[1]BRAY F,FERLAY J,SOERJOMATARAM I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2]ABOU-ZIED H A,YOUSSIF B G M,MOHAMEDM F A,et al.EGFR inhibitors and apoptotic indu-cers:
design,synthesis,anticancer activity and doc-king studies of novel xanthine derivatives carrying chalcone moiety as hybrid molecules[J].Bioorg Chem,2019,89:102997.
[3]CHEN W,ZHENG R,BAADE PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[4]FENG R M,ZONG Y N,CAO S M,et al.Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics? [J].Cancer Commun(Lond),2019,39(1):22-33.
[5]王伟进,张晓路,中国癌症的现状与疾病负担[J].中国经济报告,2019,4:63-73.WANG W J,ZHANG X L.Stat-quo and disease burden of cancer in China[J].China Policy Review,2019,4:63-73.
[6]ARTEAGA C L. The epidermal growth factor receptor:from mutant oncogene in nonhuman cancers to therapeutic target in human neoplasia[J].J Clin Oncol,2001,19(18):32S-40S.
[7]PRENZEL N,FISCHER O M,STREIT S,et al.The epidermal growth factor receptor family as a central element for cellular signal transduction and diversification[J].Endocr Relat Cancer,2001,8(1):11-31.
[8]HERBST R S,BUNN P A.Targeting the epidermal growth factor receptor in non-small cell lung cancer[J].Clin Cancer Res,2004,9(16):5813-5824.
[9]SIEGELIN M D,BORCZUK A C.Epidermal growth factor receptor mutations in lung adenocarcinoma[J].Lab Invest,2014,94(2):129-137.
[10]JORISSEN R N,WALKER F,POULIOT N,et al.Epidermal growth factor receptor: mechanisms of activation and signalling[J].Exp Cell Res,2003,284(1):31-53.
[11]LIEBMANN C.Regulation of MAP kinase activity by peptide receptor signalling pathway:paradigms of multiplicity[J].Cell Signal,2001,13(11):777-785.
[12]刘星雨.EGFR 酪氨酸激酶抑制剂的设计、合成和生物活性筛选以及吡咯类化合物的合成研究[D].浙江:浙江大学,2018.LIU X Y.Design,synthesis and biological evaluation of EGFR inhibitors and research on the synthesis of pyrrole compounds [D].Zhengjiang:Zhengjiang University,2018.
[13]BLACKHALL F,RANSON M,THATCHER N.Where next for gefitinib in patients with lung cancer?[J].Lancet Oncol,2006,7(6):499-507.
[14]LYNCH T J,BELL D W,SORDELLA R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl J Med,2004,350:2129-2139.
[15]PAEZ J G,JANNE P A,LEE J C,et al.EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy[J].Science,2004,304:1497-1500.
[16]PAO W,MILLER V,ZAKOWSKI M,et al.EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib[J].Proc Natl Acad Sci USA,2004,101(36):13306-13311.
[17]MOK T S,WU Y L,THONGPRASERT S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarc inoma[J].N Engl J Med,2009,361(10):947-957.
[18]ROSELL R,CARCERENY E,GERVAIS R,et al.Erlotinib versus standard chemotherapy as first-line treatm-ent for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EUR-TAC):a multi centre,open-label,randomised phase 3 trial[J].Lancet Oncol,2012,13(3):239-246.
[19]ASAHINA H,YAMAZAKI K,KINOSHITA I,et al.A phase Ⅱ trial of gefitinib as first-line therapy for advanced non-small cell lung cancer with epidermal growth factor receptor mutations[J].Br J Cancer,2006,95:998-1004.
[20]TAN D S W,YOM S S,TSAO M S,et al.The international association for the study of lung cancer consensus statement on optimizing management of EGFR mutation-positive non-small cell lung cancer:status in 2016[J].J Thorac Oncol,2016,11(7):946-963.
[21]MITSUDOMI T,MORITA S,YATABE Y,et al.West Japan Oncology,gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJT-OG3405):an open label,randomised phase 3 trial[J].Lancet Oncol,2010,11(2):121-128.
[22]WU Y L,ZHOU C,LIAM C K,et al.First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer:analyses from the phase Ⅲ,randomi-zed,open-label,ENSUR-E study[J].Ann Oncol,2015,26(9):1883-1889.
[23]SHI Y,ZHANG L,LIU X,et al.Icotinib versus gefitinib in previously treated advanced non-small-cell lung cancer(ICOGEN):a randomised,double-blind phase 3 non-inferiority trial[J].Lancet Oncol,2013,14(10):953-961.
[24]SUN Y,SHI Y,ZHANG L,et al.Final overall survival and updated biomarker analysis results from the rando-mized phase Ⅲ ICOGEN trial[J].J ClinOncol,2012,30(15):7559-7559.
[25]SHI Y K,WANG L,HAN B H,et al.First-line icotinib versus cisplatin/pemetrexed plus pemetrexed maintena-nce therapy for patients with advanced EGFR mutation-positive lung adenocarcinoma (CONVINCE): a phase 3,open-label,randomized study[J].Ann Oncol,2017,28(10):2443 -2450.
[26]FAN Y,XU Y,GONG L,et al.Effects of icotinib with and without radiation therapy on patients with EGFR mutant non-small cell lung cancer and brain metastases[J].Sci Rep,2017,7:45193.
[27]SEQUIST L V,WALTMAN B A,DIAS S D,et al.Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors[J].SciTransl Med,2011,3(75):75ra26.
[28]YUN C H,MENGWASSER K E,TOMS A V,et al.The T790M mutation in EGFR kinase causes drug resistance by increasing the affinity for ATP[J].Proc Natl Acad Sci USA,2008,105(6):2070-2075.
[29]MILLER V A,HIRSH V,CADRANEL J,et al.Afatinib versus placebo for patients with advanced,metastatic non-small-cell lung cancer after failure of erlotinib,gefitinib,or both,and one or two lines of chemotherapy (LUX-Lung 1):a phase 2b/3 randomi-sedtrial[J].LancetOncol,2012,13(5):528-538.
[30]RECKAMP K L,GIACCONE G,CAMIDGE D R,et al. A phase 2 trial of dacomitinib(PF-00299804),an oral,irreversible pan-HER(human epidermal growth factor receptor) inhibitor,in patients with advanced non-small cell lung cancer after failure of prior chemotherapy and erlotinib[J].Cancer,2014,120(8):1145-1154.
[31]PAZ A L,TAN EH,O'BYRNE K,et al.Afatinib versus gefitinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: overall survival data from the phase Ⅱb LUX-Lung 7 trial[J].Ann Oncol,2017,28(2):270-277.
[32]WU Y L,CHENG Y,ZHOU X,et al.Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer(ARCHER 1050):a randomised,open-label,phase 3 trial[J].Lancet Oncol,2017,18(11):1454-1466.
[33]MOK T S,CHENG Y,ZHOU X,et al.Improvement in overall survival in a randomized study that compared dacomitinib with gefitinib in patients with advanced non-small-cell lung cancer and EGFR-acti-vating mutations[J].J Clin Oncol,2018,36(22):2244-2250.
[34]胡鹏程,耿僡临,魏慎海,等.晚期非小细胞肺癌靶向治疗的研究进展[J].山东医药,2020,60(16):102-106.HU P C,GENG H L,WEI S H,et al.Re-search progress of targeted therapy for advanced non-small cell lung cancer[J].Shandong Med J,2020,60(16):102-106.
[35]CROSS D A E,ASHTON S E,GHIORGHIU S,et al.AZD9291,an irreversible EGFR TKI,overcomes T790-M-mediated resistance to EGFR inhibitors in lung cancer[J].Cancer Discov,2014,4(9):1046-1061.
[36]MURTUZA A,BULBUL A,SHEN J P,et al.Novel third-generation EGFR tyrosine kinase inhibitors and strategies to overcome therapeutic resistance in lung cancer[J].Cancer Res,2019,79(4):689-698.
[37]SORIA J C,OHE Y,VANSTEENKISTE J,et al.Osimertinib in untreated EGFR-mutated advanced non small-cell lung cancer[J].N Engl J Med,2018,378(2):113-125.
[38]MOK T S,WU Y L,AHN M J,et al.Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung can-cer[J].N Engl J Med,2017,376(7):629-640.
[39]REMON J,PLANCHARD D.AZD9291 in EGFR-mutant advanced non-small-cell lung cancer patients[J].Future Oncol,2015,11(22):3069-3081.
[40]BALLARD P,YATES J W T,YANG Z,et al.Preclinical comparison of osimertinib with other EG-FR-TKIs in EGFR-Mutant NSCLC brain metastases models,and early evidence of clinical brain metasta-sesactivity[J].Clin Cancer Res,2016,22(20):5130-5140.
[41]YANG J C,KIM S W,KIM D W,et al.Osimertinib in patients with epidermal growth factor receptor mutation-positive non-small-cell lung cancer and leptomeningeal metastases:the bloom study[J].J Clin Oncol,2020,38(6):538-547.
[42]WU Y L,AHN M J,GARASSINO M C,et al. CNS efficacy of osimertinib in patients with T790M-positive advanced non-small-cell lung cancer:data from a randomized phase Ⅲ trial ( AURA3) [J].J Clin Oncol,2018,36(26):2702-2709.
[43]GOSS G,TSAI C M,SHEPHERD F A,et al.CNS response to osimertinib in patients with T790M-positive advanced NSCLC:pooled data from two phaseⅡ trials[J].Ann Oncol,2018,29(1):687-693.
[44]谢倩,俞婷婷,单莉.EGFR-TKI第三代药物临床研究进展[J].医学综述,2017,23(22):4427-4432.XIE Q,YU T T,SHAN L.Clinical research advances of the third generation drugs of EGFR-TKIs[J].Medi-cal Recapitulate,2017,23(22):4427-4432.
[45]孔月月,饶国武.第三代EGFR抑制剂研究进展[J].浙江化工,2019,50(1):14-22.KONG Y Y,RAO G W.Research progress in the third-generation of EGFR inhibitors[J].Zhengjiang Chemic-al Industry,2019,50(1):14-22.
[46]新型肺癌靶向药Lazertinib疗效优于奥西替尼,2020年ASCO[EB/OL].[2020-06-10].https://www.dxy.cn/bbs/newweb/pc/post/43466865.
[47]第三代EGFR抑制剂CK-101获孤儿药认定[EB/OL].[2017-09-12].https://news.bioon.com article/6709739.html.
[48]王璐,郑昕,王维聪,等.艾维替尼在一组中国晚期非小细胞肺癌病人体内单多次给药代谢产物的药代动力学研究[J].中国临床药理学与治疗学,2018,23(10):1147-1152.WANG L,ZHENG X,WANG W C,et al.Pharmaco-kinetics of the metabolites of abivertinib in Chinese patients with advanced NSCLC in a single and multiple dose group[J].Chin J Clin Pharmacol Ther,2018,23(10):1147-1152.
[49]何珩,黄璐,许勇.新型抗非小细胞肺癌药物奥美替尼[J].中国新药杂志,2016,25(16):1801-1806.HE H,HUANG L,XU Y.Osimertinib:a new drug for non-small cell lung cancer[J].Chinese Journal of New Drugs,2016,25(16):1801-1806.
[50]ASCO 2020石远凯教授:肺癌靶向治疗后浪奔涌,艾氟替尼惊涛来袭[EB/OL].[2020-06-05].https://m.sohu.com/a/400011118_120051442/.
[51]ENGELHARDT H,BOSE D,PETRONCZKI M,et al.Start selective and rigidify: the discovery path toward a next generation of EGFR tyrosine kinase inhibitors[J].J Med Chem,2019,62:10272-10293.
(中国药物化学杂志 2021年2月第31卷 第2期)
