发布时间:2021年06月07日 09:08:49 来源:振东健康网
程支利,陈智彬,郭鹏,李小荣
【摘要】目的:探讨微小RNA-579(miR-579)在肾癌中表达的临床意义及其生物学功能。方法:选取2012年1月—2014年3月四川省内江市第一人民医院泌尿外科手术治疗肾癌患者92例,收集其癌组织及癌旁正常组织,检测miR-579表达水平;比较不同临床病理特征癌组织中miR-579水平;对不同miR-579水平的肾癌患者进行生存分析。将肾癌A498细胞按随机数字表法分为对照组(不予转染)、miR-NC组(转染阴性对照)、miR-579组(转染miR-579),比较3组细胞miR-579表达水平、增殖水平及3’-磷酸肌醇依赖性蛋白激酶1(PDK1)和鼠双微体2(MDM2)表达水平。结果:癌组织中miR-579表达水平低于癌旁组织(t/P=16.010/0.000),癌组织中miRNA-579水平与肿瘤直径(t/P=3.420/0.001)及分化程度、临床分期(F/P=10.514/0.000、7.308/0.000)有关。miR-579低表达组患者的生存率低于高表达组(x2/P=4.684/0.030)。与对照组和miR-NC组比较,miR-579组细胞miR-579表达水平升高(F/P=480.200/0.000);在培养48h和72h时的OD值降低(F/P=12.870/0.000、13.040/0.000);PDK1和MDM2的表达水平降低(F/P=67.500/0.000、18.780/0.000)。结论miR-579在肾癌组织和细胞呈低表达,与肿瘤直径、分化程度、临床分期及低生存率有关。体外转染miR-579模拟物可抑制细胞增殖,可能与抑制PDK1和MDM2表达有关。
【关键词】微小RNA-579;肾癌;细胞增殖;3’-磷酸肌醇依赖性蛋白激酶1;鼠双微体2
[中图分类号]R737.11 [文献标识码]A
Clinical significance and biological function of miR-579 in renal carcinoma
Cheng Zhili,Chen Zhibin,Guo Peng,Li Xiaorong.
Urology Department of the First People's Hospital of Neijiang City,Sichuan Rrovince,Neijiang 641000,China
[Abstract] Objective To explore clinical significance and biological function of microRNA-579 (miR-579) in renal carcinoma.Methods The samples of cancer tissues and adjacent normal tissues in ninety-two patients with renal carcinoma who underwent operation in the Urology Department of the First People's Hospital of Neijiang City,Sichuan Province from January 2012 to March 2014 were collected.The expression of miR-579 in tissues were detected.The levels of miR-579 in cancer tissues of patients with different clinicopathological characteristics were compared.The survival rates of patients with different miR-579 levels were compared.Renal cancer A498 cells were randomly divided into three groups:control group,miR-NC group and miR-579 group.The expression of miR-579,the level of proliferation,and the expression of 3’-phosphoinositide-dependent protein kinase-1(PDK1) and murine double minute 2 (MDM2) were compared.Results The expression level of miR-579 in cancer tissues was lower than that in adjacent tissues (t/P=16.010/0.000),but related to tumor diameter (t/P=3.420/0.001),differentiation degree and clinical stage (F/P=10.514/0.000,7.308/0.000).The survival rate of the low expression group was lower than that of the high expression group (x2/P=4.684/0.030).Compared with control group and miR-NC group,the expression level of miR-579 in miR-579 group increased (F/P=480.200/0.000),the OD value decreased at 48 and 72 hours after culture (F/P=12.870/0.000,13.040/0.000),a-nd the expression levels of PDK1 and MDM2 decreased(F/P=67.500/0.000、18.780/0.000).Conclusion The low expression of miR-579 in renal carcinoma tissues and cells is related to tumor diameter,differentiation degree,clinical stage and low survival rate.MiR-579 mimics in vitro can inhibit cell proliferation,which may be related to the inhibition of PDK1 and MDM2 expression.
[Key words] MicroRNA-579;Renal carcinoma;Proliferalion;3’-phosphoinositide-dependent protein kinase-1;Mu-rine double minute 2
肾细胞癌约占成人恶性肿瘤的3%,占肾恶性肿瘤的90%,是继前列腺癌和膀胱癌后第三常见的泌尿系统肿瘤,但病死率最高,约为25%,我国仅2015年就死亡23400例[1]。目前,肾细胞癌的最佳治疗方法是手术切除,但20%~40%的患者在肾切除后会复发或转移[2]。用于治疗的靶点及随访的生物标志物非常少是导致其预后不良的主要原因之一[3]。因此,有必要寻找新的靶点或生物标志物用于肾切除术后的治疗及预后评估。微小RNA(miRNA)是一种长约22个核苷酸的单链RNA,可与目标mRNA的3'端非翻译区结合,从而调节基因表达[4-8]。研究表明,miRNA在多种肿瘤细胞中表达失调,参与肿瘤细胞增殖、侵袭、转移和凋亡,被认为是癌症治疗的潜在靶点[9-13]。微小RNA-579(miR-579)是近年发现的一种抑癌分子,仅在少数肿瘤类型中有所报道,Fattore等[14]发现miR-579可以抑制黑色素瘤细胞增殖、迁移、侵袭,促进细胞凋亡,诱导细胞周期阻滞于G0/G1期,研究显示miR-579与鼠双微体2(MDM2)mRNA的3'-端非编码区特异性结合,导致其表达下调。此外,Kalhori等[15]发现miR-579通过与3'-磷酸肌醇依赖性蛋白激酶1(3'-phosphoinositide-dependent protein kinase-1,PDK1)mRNA相互作用,从而抑制胶质母细胞瘤细胞的增殖。但是,miR-579对肾细胞癌发生发展的影响及PDK1、MDM2是否参与其作用机制均不清楚,因此本文旨在探讨miR-579在肾细胞癌中表达的临床意义及其生物学功能,报道如下。
1、资料与方法
1.1 临床资料 选取2012年1月—2014年3月四川省内江市第一人民医院泌尿外科手术治疗肾癌患者92例,患者术前均未进行放化疗,术中获取癌组织进行病理学检查确诊,取癌组织及癌旁正常组织(距肿瘤边缘4~8cm的正常肾组织) 样本,保存于液氮中作为研究对象,其中男54例,女38例,年龄41~75(59.32±9.96)岁。根据癌组织中miRNA-579水平的中位数,将患者分为低表达组和高表达组(各46例)。低表达组男24例,女22例,年龄32~59(51.43±9.61)岁23例,60~76(65.20±6.74)岁23例;肿瘤直径1.1~4.8(3.9±1.1)cm18例,5.1~9.8(6.8±1.5)cm 28例;高分化1例,中分化30例,低分化15例;Ⅰ期2例,Ⅱ期8例,Ⅲ期26例,Ⅳ期10例;透明细胞癌36例,非透明细胞癌10例。高表达组男30例,女16例,年龄35~59(52.26±9.38)岁18例,60~78(65.88±7.02)岁28例;肿瘤直径1.2~4.5(3.7±0.9) cm31例,5.0~9.1(6.4±1.1) cm 15例;高分化9例,中分化31例,低分化6例;Ⅰ期6例,Ⅱ期15例,Ⅲ期23例,Ⅳ期2例;透明细胞癌31例,非透明细胞癌15例。2组患者肿瘤直径、分化程度、临床分期比较差异有统计学意义(P<0.05),而性别、年龄、病理类型比较差异无统计学意义(P>0.05)。
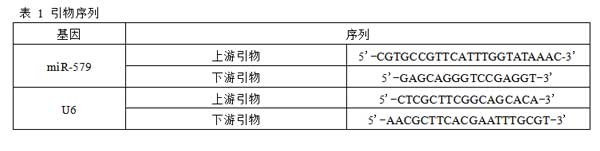
1.2 细胞学实验 为了研究miR-579对肾癌细胞增殖的影响,本研究首先检测了miR-579在不同细胞株间的表达水平,包括人正常肾脏细胞株HK-2与肾癌细胞株Caki-1、A498、769-P、786-O(均购自美国模式培养物保藏中心,ATCC),结果显示miR-579在A498细胞种的表达水平最低,因此选择A498细胞作为转染对象,以观察上调miR-579水平能否抑制A498细胞的增殖。细胞培养于含10%胎牛血清的DMEM培养液(美国Gibco公司)中,放置于37℃、5%CO2的培养箱。miR-579类似物阴性对照(miR-NC)与miR-579类似物(miR-579 mimics)由上海吉玛制药技术有限公司合成,将A498细胞按随机数字表法分为3组,即对照组、miR-NC组、miR-579组,每组设3个复孔,每孔2×105个细胞。miR-NC组和miR-579组分别使用miR-NC和miR-579 mimics进行转染,按照Lipofectamine 2000转染试剂说明书(美国Invitrogen公司)进行操作。对照组不进行转染。
1.3 观测指标与方法
1.3.1 肾癌组织miR-579表达水平检测:采用荧光定量聚合酶链式反应(qRT-PCR)检测不同组织(患者癌组织与癌旁正常组织)及不同细胞(HK-2、Caki-1、A498、769-P、786-O及对照组、miR-NC组、miR-579组)中的miR-579水平。Trizol法(美国Promega公司)常规提取组织及细胞中的总RNA,然后应用逆转录试剂盒(日本Takara公司)将其逆转录为cDNA,最后应用PCR试剂盒(日本Takara公司)对目的基因进行扩增,反应条件:95℃3 min;95℃ 10s,60℃ 30s,共进行40个循环。以U6作为内参基因,记录各基因PCR扩增后的CT值,使用2-ΔΔCT法计算组织及细胞中miR-579的表达水平。引物合成于上海生工生物工程股份有限公司,见表1。
1.3.2 肾癌细胞吸光度值(OD值)测定:MTT法检测3组细胞增殖水平。将3组细胞以5×103的细胞密度接种于96孔板,继续培养24h、48h和72h,将培养基吸弃,加入无血清培养液180μl和MTT溶液(5mg/ml,美国Sigma公司)20μl,在培养箱中继续孵育4h,加入DMSO(美国Amersco公司)150μl,震荡5min后,使用酶标仪(美国Multiskan公司)于450nm波长下测定OD值。
1.3.3 肾癌细胞PDK1、MDM2蛋白测定:使用RIPA裂解液(上海碧云天公司)提取总蛋白,BCA蛋白定量试剂盒(上海碧云天公司)测定蛋白浓度。取40g的总蛋白进行聚丙烯酰胺凝胶电泳,电转印后常规封闭2h,加入一抗4℃过夜孵育,各一抗稀释浓度:PDK1 1∶1000,MDM2 1∶1000,GAPDH 1∶3000均购自英国Abcam公司。次日,洗膜3次,加入二抗(武汉博士德公司)室温孵育1h,洗膜3次,ECL液(上海碧云天公司)显色,凝胶成像仪(美国Bio-Rad公司)下拍照。使用Quantity One软件测定各条带的灰度值,将对照组中目的蛋白与GAPDH灰度值之比作为1。
1.4 统计学方法 使用SPSS 20.0软件对数据进行统计学分析。正态分布计量资料以均数±标准差(±s)表示,2组比较采用t检验,多组间比较采用单因素方差分析,组内两两比较使用LSD-t检验。对生存情况进行随访,Kaplan-Meier法绘制生存曲线,Log-rank法比较2组患者生存率的差异。P<0.05为差异有统计学意义。
2、结果
2.1 肾癌与癌旁组织中miR-579表达水平比较肾癌组织中miR-579表达水平低于癌旁组织,差异有统计学意义(0.63±0.26 vs.1.44±0.42,t=16.010,P=0.000)
2.2 不同类型肾癌细胞株miR-579表达水平比较与人正常肾脏细胞株HK-2(1.00±0.14)比较,肾癌细胞株Caki-1(0.39±0.15)、A498(0.18±0.08)、769-P(0.28±0.10)、786-O(0.25±0.11)miR-579的表达水平均降低(F/P=78.510/0.000),且A498、769-P、786-O中miR-579表达水平显著低于Caki-1,差异均有统计学意义(F/P=5.987/0.002),而A498、769-P、786-O间比较,差异无统计学意义(F/P=2.772/0.080),见图1。
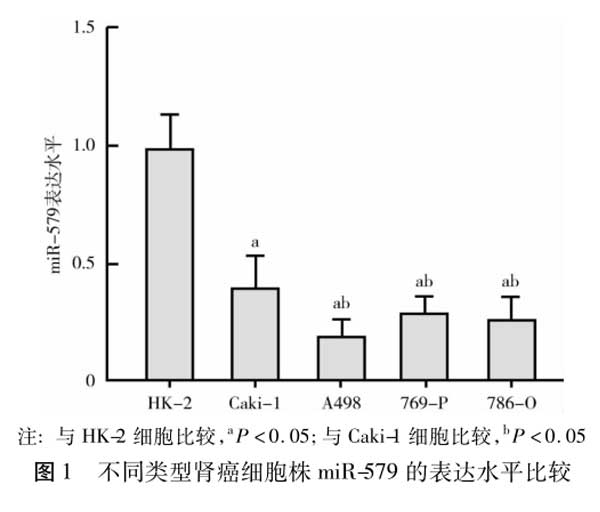
2.3 3组细胞中miR-579表达水平比较miR-579组miR-579表达水平为3.11±0.24,显著高于对照组(1.00±0.12)和miR-NC组(0.96±0.15),差异均有统计学意义(F/P=480.200/0.000),而对照组和miR-NC组比较,差异无统计学意义(t/P=0.659/0.519),见图2。
2.4 不同临床/病理特征癌组织中miR-579水平比较肾癌组织中miRNA-579水平在不同性别、年龄、病理类型中比较,差异无统计学意义(P>0.05),肿瘤直径≥5cm、分化程度低、临床分期高的癌组织中miRNA-579水平显著低于肿瘤直径<5cm、分化程度高、临床分期低者,差异均有统计学意义(P<0.05),见表2。

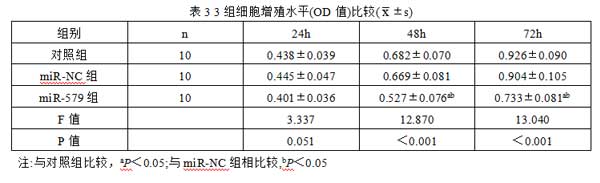
2.5 miR-579对肾癌细胞增殖的影响 与对照组和miR-NC组比较,miR-579组细胞在培养48h、72h时的OD值降低,差异有统计学意义(P<0.05),而对照组和miR-NC组3个时间点的OD值相比较,差异无统计学意义(t/P=0.362/0.721、0.384/0.706、0.503/0.621),见表3。
2.6 miR-579对肾癌细胞中PDK1和MDM2表达的影响 与对照组和miR-NC组比较,miR-579组细胞中PDK1和MDM2的表达水平降低(P均<0.05),而对照组和miR-NC组比较,差异无统计学意义(P>05),见图3,表4。
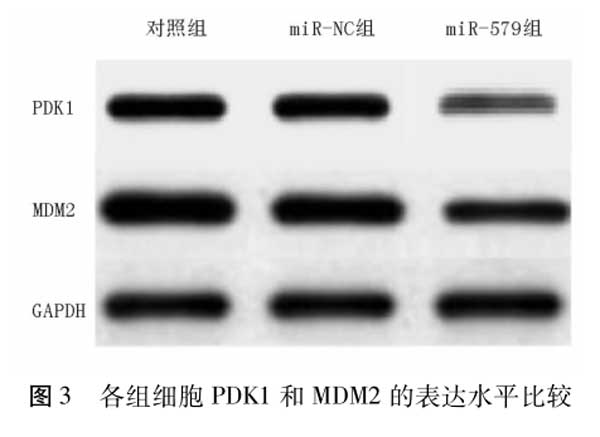
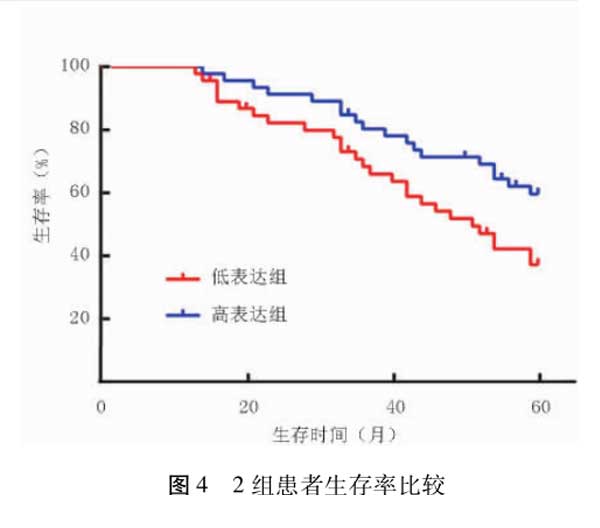
2.7 miR-579水平与肾癌预后的关系 对不同miR-579水平的肾癌患者进行生存分析,结果显示低表达组患者的生存率显著低于高表达组,差异有统计学意义(x2=4.684,P=0.030),见图4。
3、讨论
尽管miR-579在多种肿瘤类型中被发现表达失调,但是一直未得到单独且深入的研究,Li等[16]通过深度测序及相关调控网络分析发现,包括miR-579在内的14个miRNA可用于预测神经胶质瘤患者的生存率;Lin等[17]研究了肝转移性结直肠癌与非转移性结直肠癌中miRNA表达的差异性,结果表明28个miR-NA在肝转移癌中的表达发生变化,其中miR-579表达下调。本研究则基于上述报道,对miR-579在肾癌中的表达情况进行了检测,并深入探讨了其临床意义与生物学功能,认为其在临床和基础中均具有较好的研究价值和应用前景。
本研究首先对肾癌组织及癌旁组织中miR-579的表达水平进行qRT-PCR检测,结果显示癌组织中miR-579表达水平显著低于癌旁组织,与Lin等[17]报道相一致,提示miR-579可能是一种抑癌基因。此外,肿瘤直径大、分化程度低、临床分期高的患者癌组织中miRNA-579水平较低,表明miR-579与肾癌的发生发展密切相关。为了进一步探讨miR-579水平对肾癌预后的影响,本研究对所有患者的生存情况进行了为期60个月的随访,结果显示低表达组患者的生存率明显低于高表达组,提示低水平的miR-579可用于预测患者预后不良。但Azizian等[18]发现,miR-579在直肠癌组织中表达升高,且与患者的低生存率显著相关,与本研究结论不一致,可能与肿瘤类型、病例数量、随访时间等因素有关,未来需要通过增加病例、严格随访等方法进一步证实本研究结论。
本研究通过体外细胞试验对miR-579的生物学功能做了进一步研究,首先使用qRT-PCR检测了不同类型肾癌细胞中miR-579的表达水平,结果显示肾癌细胞株Caki-1、A498、769-P、786-O中miR-579的表达水平均显著低于人正常肾脏细胞株HK-2,与肾癌组织中低表达的趋势相吻合。其中,A498细胞中miR-579表达水平降低最为明显,因此本研究选择A498细胞作为后续研究的细胞类型。体外转染miR-579模拟物后可显著抑制A498细胞增殖,进一步表明了miR-579的抑癌效应。
为了探讨miR-579抑制肾癌细胞增殖的分子机制,在miR-579的相关报道中,发现2个可能的靶向抑制分子,即PDK1和MDM2[14-15]。PDK1是一种丝氨酸/苏氨酸激酶,可以促进AKT蛋白质磷酸化,从而激活PI3K/AKT信号通路,在细胞增殖、代谢等生理病理过程中发挥重要作用[19-22]。Wang等[23]发现,miR-375可通过靶向抑制PDK1,降低肾癌细胞的增殖和迁移,本结果也显示,miR-579组细胞中PDK1表达水平低于对照组和miR-NC组,表明PDK1可能是miR-579的靶点之一。MDM2是p53的负性调节因子,参与调节DNA损伤修复、细胞周期等过程,与肿瘤的发生发展密切相关[24-26]。本结果显示,体外转染miR-579模拟物可抑制MDM2表达,与Fattore等[14]的研究结论相一致,即miR-579可与MDM2相互作用而发挥靶向抑制效应。
本研究的不足:(1)研究仅检测了miR-579在组织中的表达情况,其在血清中的表达尚不清楚,血清miR-579水平能否用于早期诊断也有待进一步研究;(2)除细胞增殖外,肾癌细胞的生物学行为还包括凋亡、迁移、侵袭等,但是本研究未对这些指标进行全面系统的检测;(3)除PDK1和MDM2外,其他基因的表达也有可能是miR-579的靶点,未来仍然需要通过生物信息学、双萤光素酶报告基因试验等方法进行筛选和验证。
综上所述,miR-579在肾癌组织和细胞中低表达,与肿瘤直径、分化程度、临床分期及低生存率有关。体外转染miR-579模拟物可抑制细胞增殖,可能与抑制PDK1和MDM2表达有关。
参考文献
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.DOI: 10.3322/caac.21338.
[2]Ljungberg B,Albiges L,Abu-Ghanem Y,et al.European association of urology guidelines on renal cell carcinoma:The 2019 update[J].Eur Urol,2019,75(5):799-810.DOI:10.1016/j.eururo.2019.02.011.
[3]Li Y,Guan B,Liu J,et al.MicroRNA-200b is downregulated and suppresses metastasis by targeting LAMA4 in renal cell carcinoma[J].EBio Medicine,2019,44:439-451.DOI:10.1016/j.ebiom.2019.05.041.
[4]宋钱林,秦聪.miRNA-21在泌尿系统肿瘤中的研究进展[J].疑难病杂志,2019,18(6): 635-639.DOI:10.3969/j.issn.1671-6450.2019.06.024.
[5]胡刚强,李浩勇,宁金卓.外源性硫化氢对人肾癌786-O细胞增殖及凋亡的影响[J].疑难病杂志,2018,17(8):828-832.DOI:10.3969/j.issn.1671-6450.2018.08.017.
[6]吴佳成,陆雅君,姜力.miR-21下调程序性死亡细胞4对抑制裸鼠肾细胞癌肿瘤转化和增殖的实验研究[J].疑难病杂志,2019,18(1):61-66.DOI:10.3969/j.issn.1671-6450.2019.01.015.
[7]张智旸,李孝远,白春梅,等.胰腺转移性肾透明细胞癌的临床病理特征和预后分析[J].中华肿瘤杂志,2020,42(1):44-49.DOI:10.3760/cma.j.issn.0253-3766.2020.01.006.
[8]钟凯华,陈东,吴志明,等.siRNA干扰BIRC6对肾癌786-O细胞凋亡和自噬的影响[J].南方医科大学学报,2020,40(11):1651-1655.DOI:10.12122/j.issn.1673-4254.2020.11.18.
[9]Li X,Xu M,Ding L,et al.MiR-27a:A novel biomarker and potential therapeutic target in tumors[J].J Cancer,2019,10(12):2836-2848.DOI:10.7150/jca.31361.
[10]He T,Chen P,Jin L,et al.miR-660-5p is associated with cell migration,invasion,proliferation and apoptosis in renal cell carcinoma[J].Mol Med Rep,2018,17(1):2051-2060.DOI:10.3892/mmr.2017.8052.
[11]秦瑞峰,薛佳栋,霍浩然,等.miR-141-3p和miR-22-3p在胰腺癌组织中的表达及其与临床病理特征和预后的关系[J].疑难病杂志,2020,19(3):261-265.DOI:10.3969/j.issn.1671-6450.2020.03.010.
[12]刘扬帆,蔡政,魏光敏,等.敲减microRNA-27a通过Wnt/β-cate-nin信号通路抑制肾细胞癌增殖和转移[J].中国药理学通报,2020,36(1):115-121.DOI:10.3969/j.issn.1001-1978.2020.01.023.
[13]赵静丽,赵丽丽,牛文忠,等.淋巴细胞白血病缺失基因1调控miR-513a-5p和RANBP2通路对肾母细胞瘤细胞增殖凋亡的影响[J].中华肿瘤杂志,2020,42(10):849-855.DOI:10.3760/cma.j.cn112152-20200311-00194.
[14]Fattore L,Mancini R,Acunzo M,et al.miR-579-3p controls melanoma progression and resistance to target therapy [J].Proc Natl Acad Sci USA,2016,113(34):E5005-E5013.DOI:10.1073/pnas.1607753113.
[15]Kalhori MR,Irani S,Soleimani M,et al.The effect of miR-579 on the PI3K/AKT pathway in human glioblastoma PTEN mutant cell lines[J].J Cell Biochem,2019,120(10):16760-16774.DOI:10.1002/jcb.28935.
[16]Li R,Li X,Ning S,et al.Identification of a core miRNA-pathway regulatory network in glioma by therapeutically targeting miR-181d,miR-21,miR-23b,beta-Catenin,CBP,and STAT3 [J].PLoS One,2014,9(7):e101903.DOI:10.1371/journal.pone.0101903.
[17]Lin M,Chen W,Huang J,et al.MicroRNA expression profiles in human colorectal cancers with liver metastases [J].Oncol Rep,2011,25(3):739-747.DOI: 10.3892/or.2010.1112.
[18]Azizian A,Epping I,Kramer F,et al. Prognostic value of microR-NAs in preoperative treated rectal cancer[J].Int J Mol Sci,2016,17(4):568.DOI:10.3390/ijms17040568.
[19]Emmanouilidi A,Falasca M.Targeting PDK1 for chemosensitization of cancer cells[J].Cancers (Basel),2017,9(10):140.DOI:10.3390/cancers9100140.
[20]Gagliardi PA,Puliafito A,Primo L.PDK1: At the crossroad of cancer signaling pathways[J].Semin Cancer Biol,2018,48:27-35.DOI:10.1016/j.semcancer.2017.04.014.
[21]王方,王昕,刘哲,等.抑制PDK1经由ASK1/JNK/Bim通路诱导慢性粒细胞白血病细胞凋亡[J].中国癌症杂志,2020,30(6):401-406.DOI:10.19401/j.cnki.1007-3639.2020.06.001.
[22]张斌,孟平,袁建林.长链非编码RNA作为肾细胞癌预后生物标志物的研究新进展[J].现代肿瘤医学,2020,28(5):839-843.DOI:10.3969/j.issn.1672-4992.2020.05.035.
[23]Wang J,Sun X.MicroRNA-375 inhibits the proliferation,migration and invasion of kidney cancer cells by triggering apoptosis and modulation of PDK1 expression [J].Environ Toxicol Pharmacol,2018,62:227-233.DOI: 10.1016/j.etap.2018.08.002.
[24]Ning Y,Hui N,Qing B,et al.ZCCHC10 suppresses lung cancer progression and cisplatin resistance by attenuating MDM2-mediated p53 ubiquitination and degradation[J].Cell Death Dis,2019,10(6):414.DOI: 10.1038/s41419-019-1635-9.
[25]Liu J,Cheng LG,Li HG.LncRNA SNHG20 promoted the proliferation of glioma cells via sponging miR-4486 to regulate the MDM2-p53 pathway[J].Eur Rev Med Pharmacol Sci,2019,23(12):5323-5331.DOI: 10.26355/eurrev_201906_18199.
[26]Zeng K,Chen X,Hu X,et al.LACTB,a novel epigenetic silenced tumor suppressor,inhibits colorectal cancer progression by attenuating MDM2-mediated p53 ubiquitination and degradation [J].On-cogene,2018,37(41): 5534-5551.DOI:10.1038/s41388-018-0352-7.
(疑难病杂志 2021年2月第20卷第2期)
