发布时间:2022年03月25日 09:34:07 来源:振东健康网
【摘 要】
文章来源:中国知网,《世界临床药物》2020年第11期
目的: 方法:选取郑州大学附属肿瘤医院2010年6月至2019年3月一线治疗的晚期胃癌患者85例,试验组采用XELOX联合复方苦参注射液方案,对照组采用XELOX方案,比较两组的有效率、无疾病进展时间、生活质量改善率及毒副反应。结果:试验组和对照组的客观有效率(Response rate, RR)分别为44%和32.5%,疾病控制率(Disease control rate, DCR)分别为80%和67.5%,无进展生存期(Progression-free survival, PFS)分别为6.3个月和5.5个月;实验组的RR、DCR和PFS均高于对照组,但差异无统计学意义。试验组的生活质量改善率为76%,高于对照组的生活质量改善率50%,差异有统计学意义。两组毒副反应均可耐受,试验组的总体毒副反应低于对照组,其中白细胞减少、厌食和恶心呕吐明显低于XELOX组,差异具有统计学意义。结论:晚期胃癌患者可从XELOX方案联合复方苦参注射液治疗中获益,有较好的近期临床疗效,可明显改善患者生活质量,且不良反应更少,值得临床推广和应用。
胃癌的发病率和病死率均居中国恶性肿瘤的第2位,严重威胁着我国人民的生命健康,我国的胃癌患者就诊时大多已处于中晚期,失去了手术治愈的机会,使后续治疗变得困难,预后极差[1]。在过去的十几年中,一线治疗铂类联合氟尿嘧啶类药物被认为是标准治疗方案,其中奥沙利铂联合卡培他滨的XELOX方案目前已被临床广泛应用。该方案可以降低疾病进展风险,延长生存期,但患者的中位生存时间仍难以超过1年[2-3]。同时,胃癌患者通常营养状态差,静脉化疗及口服化疗药物毒副反应相对较为明显,对患者的生活质量产生了不同程度的影响。中医中药作为中国传统的医学文化精髓,在胃癌的治疗中也起到非常重要的作用,其对于改善胃癌患者的生存质量、延缓进展有一定的效果[4-5]。本研究中,我们采用一线XELOX联合复方苦参注射液方案治疗晚期胃癌患者,提高了治疗的有效率,减轻了化疗的毒副反应,改善患者的生活质量,现将相关临床观察总结如下。
1 资料与方法
1.1 临床资料
选择 2010 年6月至2019年3月就诊于郑州大学附属肿瘤医院暨河南省肿瘤医院,年龄大于或等于18岁初治晚期胃癌患者 85 例,其中男53例,女 32 例,年龄26 ~ 76岁,中位年龄 57岁(26 ~76岁);均经胃镜活检或术后病理组织确诊,且至少有1个可测量病灶,卡氏功能状况评分( KPS ) >60 分,预计生存期>3个月,病理类型:低中分化腺癌82例和印戒细胞癌3例,临床分期均为IV期。所有患者均为一线化疗,均无化疗禁忌证,患者或家属均知情并签署治疗同意书。患者分为试验组与对照组,试验组45例,接受XELOX联合复方苦参注射液治疗,对照组40例,仅接受XELOX方案治疗,两组患者的性别、年龄、病理类型及手术情况等一般资料进行组间比较。
1.2 治疗方法
对照组采用XELOX方案化疗:卡培他滨每次1000mg /m2,饭后半小时口服,2次/天,连续口服14天,奥沙利铂130mg/m2静脉滴注,第1天,3周为1周期。试验组则采用XELOX联合复方苦参注射液(山西振东制药股份有限公司,国药准字Z14021231) 治疗,将20ml复方苦参注射液溶于0.9%氯化钠250 ml注射液中静脉滴注,1次/天,第1-7天,与化疗方案同步进行,该方案每3周重复。每治疗2个周期后进行影像学检查评价疗效,疾病进展者停用该方案,有临床获益患者至少进行4周期治疗,收集并记录治疗前后的血常规、心电图、肝肾功能、电解质、血糖等,并随访观察进展时间。
1.3疗效及毒副反应
按照 RECIST 标准评价肿瘤疗效[6]。按照治疗效果分为完全缓解(Complete response, CR)、部分缓解(Partial response, PR)、稳定(Stable disease, SD)、进展(Progression disease, PD)。CR+PR 为客观缓解率(RR),CR+PR+SD 为疾病控制率(DCR)。无进展生存期指从患者治疗开始直至肿瘤进展或死亡的时间。采用欧洲癌症研究和治疗组织(EORTC)生活质量测评量表QLQ-C30对患者进行治疗前后生活质量测评;按照国立癌症研究所常规毒性判定标准(NCI-CTC)3.0 版标准评价不良反应,分为 0-4 级[7]。
1.4 统计学分析
有患者均随访至2020年1月。应用SPSS 16.0软件进行统计分析,组间比较采用χ2检验,生存分析用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
患者分为试验组与对照组,试验组45例(XELOX+复方苦参注射液),对照组40例(XELOX),两组在性别、年龄、病理类型、肿瘤部位、ECOG评分、合并症及手术情况等方面,均无统计学差异,具有可比性 (P>0.05),见表1。

2.2 疗效
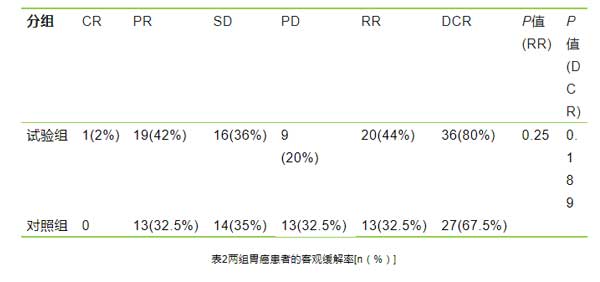
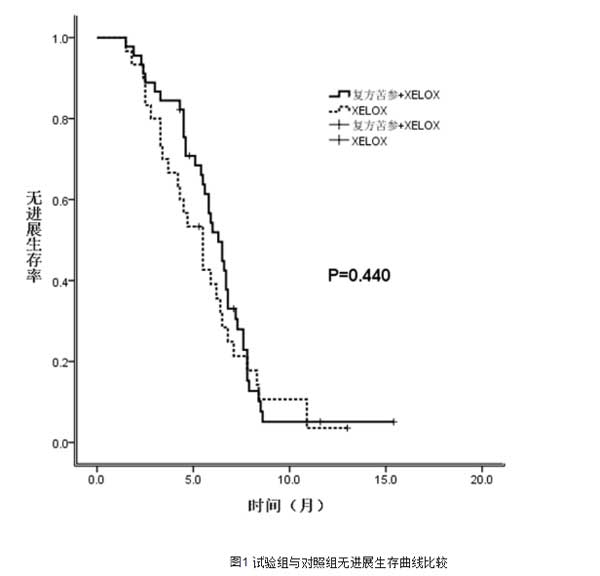
XELOX联合复方苦参注射液组45例患者中,1例获CR, PR 19例,SD 16例,PD 9例,RR为44%,DCR为80%。XELOX组中,CR 0例,PR13例,SD 14例,PD 13例,RR为32.5%,DCR为67.5%。试验组的有效率及疾病控制率均高于对照组,但两组RR及DCR比较差异无统计学意义(P>0.05),见表2。试验组的中位PFS为6.3个月高于对照组的5.5个月,但两组PFS的差异无统计学意义(P>0.05),见图2。
2.2 生活质量评价
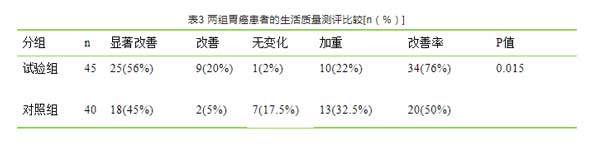
试验组QLQ-C30评价显著改善25例,改善9例,无变化1例,加重10例,生活质量改善率为76% ;对照组QLQ-C30评价显著改善18例,改善2例,无变化7例,加重13例,生活质量改善率50%。两组生活测评比较差异具有统计学意义(P <0.05),见表3。
2.3 毒副反应
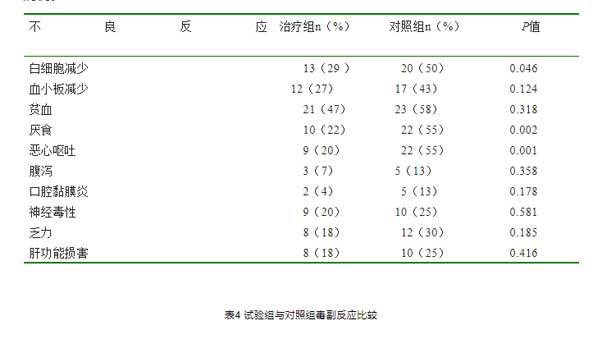
两组患者最主要的化疗不良反应为骨髓抑制(白细胞减少、血小板减少和贫血),其次为胃肠道症状(恶心、呕吐、厌食、腹泻、口腔黏膜炎以及肝功能损害)、神经毒性和乏力。XELOX+复方苦参注射液组的白细胞减少、厌食、和恶心呕吐均低于XELOX组,两组比较有统计学差异( P< 0. 05) 。XELOX+复方苦参注射液组的其余不良反应也低于XELOX组,但比较均无统计学差异( P > 0. 05),见表4。两组的不良反应均可耐受,无严重不良反应导致死亡病例。
3 讨论
晚期胃癌的主要治疗手段是姑息化疗,近年来晚期胃癌治疗进展非常缓慢,目前仍没有标准的一线治疗方案[8]。奥沙利铂联合卡培他滨的XELOX方案目前临床应用广泛,不良反应主要为骨髓抑制、消化道反应、周围神经毒性等[9]。而晚期胃癌患者由于营养差、免疫力低,对化疗的耐受性相对较差,化疗后更易引起骨髓抑制、恶心呕吐等毒性[10]。
近年来研究发现,中药在晚期消化道肿瘤的治疗中发挥了一定的功效,尤其在提升患者生活质量、调节免疫功能、提高化疗疗效与减毒等方面[11-13]。其中复方苦参注射液是从苦参、白土茯苓中药中提炼配置而成,其主要成分为苦参碱,药理研究表明,它能诱导肿瘤细胞分化及凋亡,杀伤肿瘤细胞,降低化疗的毒副作用、增强宿主免疫功能、并有止痛、升白细胞等方面的作用[14]。临床研究发现复方苦参联合化疗对肿瘤细胞具有抑制和诱导凋亡作用,还能提高患者免疫力,改善患者生活质量,一定程度上降低肿瘤患者的不良反应。
闫兵杰[15]对102例晚期胃癌患者采用复方苦参联合FOLFOX6方案对比单纯化疗,结果显示有效率高于单纯化疗组,且可调节血清 T 细胞亚群,增强免疫力,降低血清 CEA 水平,提高患者的生存质量。林春丽[16]对85例晚期胃癌患者采用复方苦参联合化疗对比化疗,结果显示治疗有效率为58.1%,明显高于单用化疗组,生活质量改善明显优于化疗组,且联合治疗组患者治疗后的不良反应明显低于单用化疗组,差异有统计学意义。覃桂珍等[17]开展Meta分析结果也显示FOLFOX方案联合复方苦参注射液治疗胃癌的有效率和患者生存质量均高于单纯化疗组,复方苦参可提高治疗胃癌患者的疗效并减轻部分化疗不良反应。
本研究结果显示,XELOX联合复方苦参注射液组的中位PFS为6.3个月高于对照组的中位PFS 5.5个月,尽管两组PFS的差异无统计学意义(P>0.05)。XELOX联合复方苦参注射液组患者的临床有效率和疾病控制率分别为44%和80%,均明显高于对照组的32.5%和67.5%,可能由于样本量较小,两组RR及DCR比较差异也无统计学意义(P>0.05)。两组患者最主要的化疗不良反应为骨髓抑制,其次为胃肠道症状,神经毒性和乏力。实验组的白细胞降低、厌食、和恶心呕吐均显著低于XELOX组,其余不良反应也低于对照组,但差异无统计学意义。同时XELOX联合复方苦参注射液组生活质量改善率76%,高于对照组的生活质量改善率50%,差异有统计学意义。上述结果提示:与XELOX化疗方案比较,复方苦参注射液联合XELOX方案有提高晚期胃癌患者化疗疗效的趋势,并且提高了患者的生活质量,减轻了化疗相关不良反应。
总之,复方苦参注射液联合XELOX方案治疗晚期胃癌具有减毒增效及提高生活质量的作用,同时具有不良反应发生率较低,值得在临床上推广应用。
参考文献
[1]Chen W, Zheng R, Baade PD, et al. Cancer statistics in Chi- na, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2]Kang YK, Kang WK, Shin DB, et al. Capecitabine/cisplat- in versus 5-fluorouracil/cisplatin as first-line therapy in pa- tients with advanced gastric cancer: a randomised phase III noninferiority trial[J]. Ann Oncol, 2009, 20(4): 666- 673.
[3]刘嘉,刘彤.应用 XELOX 及 FOLFOX4 方案治疗进展期胃癌疗效及安全性评价[J].天津医科大学学报,2015,21(2):140 -142.
[4]刘驯炎 张天惠 陈焰. 晚期胃癌中西医结合治疗探讨[J]. 肿瘤研究和临床, 2004年16卷1期 26-28页 .
[5]黑秀明.健脾活血方联合化疗对晚期胃癌患者生活质量及免疫功能的影响研究[J].实用中西医结合临床. 2017年17卷2期 81-82页.
[6]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors,European Organization for Re- search and Treatment of Cancer,National Cancer Institute of the United States[J].J Nail Cancer lnst,2000;92(3):205-16.
[7]Aaronson NK,Cul A,Kasa S,et al. The European Organization for Reaearch and Treatment of Cancer (EOPTC) modular approach to quality of life assessment in oncology[J]. Int J Ment Health, 1994, 23(2): 75-96.
[8]Trotti A,Byhardt R,Stetz J,et al.Common toxicity criteria:version2.0.an improved reference for grading the acute effects of cancer treatment:im- pact on radiotherapy[J].Int J Radiat Oncol Biol Phys,2000;47(1):13-47.
[9]闫海山.奥沙利铂联合卡培他滨治疗45例晚期胃癌的疗效探讨[J].中国现代药物应用,2015,7(7):115-116.
[10]Yang T,Shen X,Tang X,et al.Phase lI trial of oxaliplatin plus oral capecitabine as first-line chemotherapy for patients with advanced gastric cancer[J].Tumori,2011,97:466-472.
[11]韩燕.复方苦参注射液联合化疗治疗胃癌的临床疗效观察[J].临床合理用药杂志,2018,11(35):60-61.
[12]陈涛利,王苗,韩伟一.复方苦参注射液辅助化疗治疗晚期胃癌效果及对外周血Th、Tc漂移的影响[J].黑龙江医药,2018,31(5):1010-1012.
[13]林燕,张华.复方苦参注射液在晚期胃癌患者辅助化疗中的作用[J].川北医学院学报,2017,32(3):412-415.
[14]孙爱华,周静,周良春.晚期消化道肿瘤患者行复方苦参注射液辅助化疗治疗的疗效评价[J].临床和实验医学杂志,2016,15(6):564-566.
[15]闫兵杰,韩娜娜.复方苦参注射液联合改良FOLFOX6化疗方案对晚期胃癌患者血清T细胞亚群、CEA水平及生存质量的影响[J].北方药学,2019,16(2):137,136.
[16]林春丽,葛继红.复方苦参注射液联合化疗治疗晚期胃癌的临床研究[J].世界中西医结合杂志,2011,06(4):316-318.
[17]覃桂珍,王芦萍,王淼,魏永长.FOLFOX方案辅助复方苦参注射液治疗胃癌疗效及不良反应系统评价[J].中华肿瘤防治杂志,2019,26(12):881-887.
