发布时间:2022年04月15日 09:53:50 来源:振东健康网
【摘 要】
目的:通过分析鼻咽癌患者循环肿瘤细胞(Circulating Tumor Cells,CTCs)阳性率与其分期之间的关系。评估其与肿瘤T分期、N分期、临床分期的相关性,评估CTCs在预测复发和远处转移风险的价值。方法:选取2018年6月至 2019年 12月梧州市红十字会医院收治的100例首诊无远处转移鼻咽癌患者为研究对象,另选取100例慢性鼻炎患者为对照组,在治疗前抽取外周血,利用CTCBIOPSY检测系统,采用ISET技术过滤分离受检者外周血,将分离后的滤膜采用瑞氏吉姆萨染色进行细胞形态学判定及采集图像;并进一步通过原位杂交技术检测EBERs进行验证,确定受检外周血中鼻咽癌CTCs及其数量,同时结合核磁共振检查(Nuclear Magnetic Resonance Imaging,简称MRI),按2017年AJCC第8版鼻咽癌分期统计肿瘤T分期、N分期、临床分期。通过单因素分析、Logistic 多因素回归分析分析CTCs阳性率与患者分期之间的关系。评估CTCs与肿瘤T分期、N分期、临床分期的相关性,评估CTCs在预测复发和远处转移风险的价值。结果:鼻咽癌患者CTCs阳性表达率为62%,而对照组CTCs阳性表达率为0.0%(P<0.05)。鼻咽癌患者CTCs在淋巴转移和无淋巴转移中存在差异(P<0.05),在N0~N1分期与N2~N3分期中阳性表达率存在差异(P<0.05)。鼻咽癌患者CTCs在T分期中阳性表达率无统计学差异(P>0.05)。鼻咽癌患者CTCs在临床总分期Ⅰ~Ⅱ期和Ⅲ~Ⅳ期中存在差异(P>0.05)。经Spearman相关性分析可知,鼻咽癌外周血CTCs阳性率与与N分期、临床总分期呈正相关(P<0.05),而与T分期不相关(P>0.05)。结论:鼻咽癌外周血CTCs与N分期、临床分期有的相关,与T分期不相关,提示外周血CTCs阳性患者有更高的远处转移风险,可作为鼻咽预后的辅助评价指标。
鼻咽癌是头颈部常见的恶性肿瘤之一,与其他恶性肿瘤相比,鼻咽癌5年总存活率可达70%~80%[1]。然而晚期鼻咽癌患者5年存活率还有待提高,而远处转移及局部复发是影响晚期鼻咽癌预后的重要因素[2]。CTCs是指从原发部位脱落并经血液循环传播至身体各处的癌细胞[3]。CTCs进入外周血后会随血液运行黏附及侵袭血管壁,进入组织实质并进行细胞分裂增殖,最终实现病灶转移[4]。最新研究显示[5-7],CTCs与肺癌、胃癌、结直肠癌等多种恶性肿瘤病情进展及预后有关,而关于CTCs与鼻咽癌临床分期的关系目前研究仍较为有限。因此,本研究将分析CTCs与临床分期的关系,旨在为鼻咽癌远处转移风险评估提供参考,为对鼻咽癌远处转移早期干预提供依据。现在报告如下:
资料与方法
1.1临床资料
2018年6月至 2019年 12月选取梧州市红十字会医院收治的100例首诊无远处转移鼻咽癌患者为研究对象,纳入标准:1经病理组织学确诊;2患者入组前未接受过手术或局部放化疗治疗;3预计生存期限>6个月。另选取100例慢性鼻炎患者为对照组,排除标准:1合并其他恶性肿瘤;2合并心肝肾等脏器功能衰竭;3患者不愿意配合本次研究。其中男52例,女48例;年龄28~75岁,平均(48.5±4.7)岁;病理类型:低分化型35例,中分化型45例,高分化型20例;T分期:T1 9例,T2 17例,T3 35例,T4 42例;N分期:N0 8例,N1 14例,N2 46例,N3 33例;临床总分期:Ⅰ期8例,Ⅱ期15例,Ⅲ期27例,Ⅳa期49例。
1.2方法
1.2.1 CTCs检测方法
鼻咽癌及对照组患者入组后于次日清晨空腹采集第一管外周血行其它项目检测,第二管采集5mLEDTA抗凝外周血用于CTCs检测,以避免穿刺过程中皮肤上皮细胞的污染。CTCBIOPSY®检测系统购自武汉友芝友医疗科技有限公司,以微孔滤膜过滤法(ISET)分离外周血CTCs,采用专用的细胞染色液进行染色。
在光学显微镜下观察CTCs形态学特征:(1)细胞体积较大,呈圆形、椭圆形或梭形,长径多大于10μm;(2)细胞核异型性,呈折叠、扭曲、结节或分叶状等;核深染且着色不均匀,核膜增厚,出现凹陷或褶皱;核偏位,或巨大核仁;(3)核质比异常,多大于0.8。同一个标本中符合上述标准的细胞≥2个为CTCs阳性。
1.2.2EBERs原位杂交
EBERs原位杂交试剂盒购自北京中杉金桥生物技术有限公司。将贴有滤膜的载玻片依次放入100%乙醇、95%乙醇、75%乙醇中脱色;0.4%胃蛋白酶消化10分钟;EBERs探针杂交过夜;信号检测采用过氧化物酶结合抗地高辛抗体和3,30-二氨基联苯胺(DAB);苏木精复染。阳性信号呈棕黄色,局限于细胞核内。
1.2.3 MRI评估淋巴结转移
采用MRI评估患者淋巴结转移情况,取TSE序列,扫描方向为冠状面、矢状面、横断面,扫描范围从鞍上池至胸锁骨,扫描参数:层厚/层距为5 mm/1.5 mm,T1W1 TR/TE=400~600/15~25 ms;T2W1:TR/TE=1800~3000/90~150 ms,有以下情况视为淋巴结转移:淋巴结包膜外侵犯;横断面上图像淋巴结直径≥10 mm;同一区域内淋巴结呈族状个数≥3个,且淋巴结最小直径≥8 mm;淋巴结中间出现液化坏死,边缘环状强化。
1.3统计学方法
采用SPSS21.0软件对数据进行分析,计数资料采用百分比(%)表示,用百分数和例数表示计数资料,组间比较采用χ2检验,相关性分析采用Spearman单因素分析。
结 果
2.1 鼻咽癌患者与对照组外周CTCs比较
鼻咽癌患者CTCs阳性表达率为62%,而对照组CTCs阳性表达率为0.0%,比较有统计学意义(P<0.05),见表1,图1。
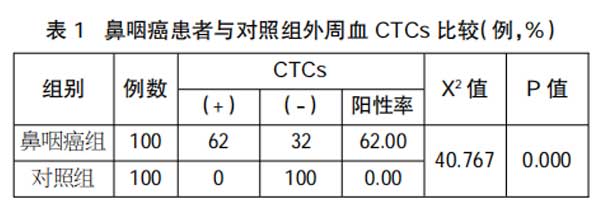
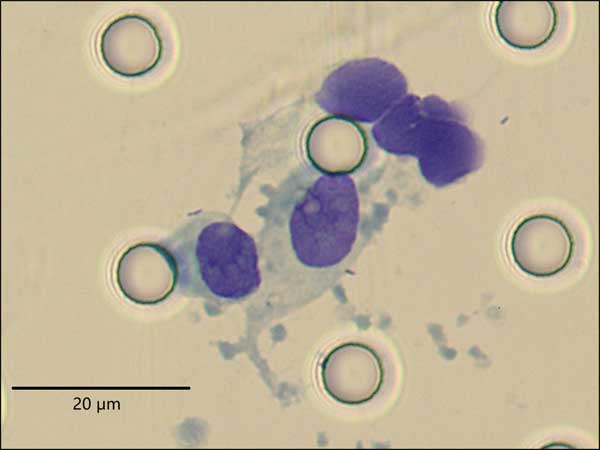
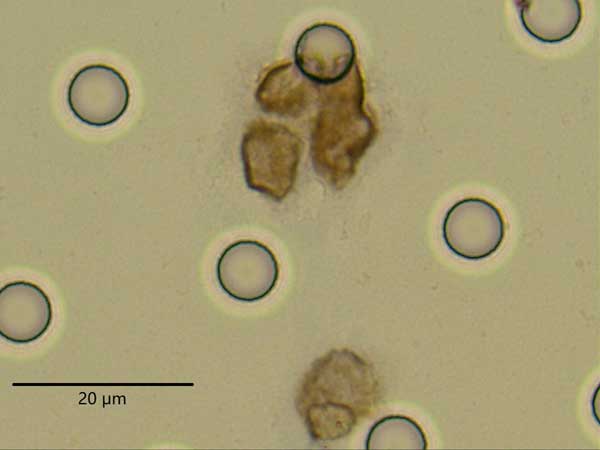
图1 鼻咽癌CTCs图谱
2.2 鼻咽癌患者外周血CTCs阳性率与患者临床特征的关系
鼻咽癌患者CTCs在N0~N1分期与N2~N3分期中阳性表达率存在差异(P<0.05)。鼻咽癌患者CTCs在T分期中阳性表达率无统计学差异(P>0.05)。鼻咽癌患者CTCs在临床总分期Ⅰ~Ⅱ期和Ⅲ~Ⅳa期中存在差异(P>0.05)。鼻咽癌患者CTCs在淋巴转移和无淋巴转移中存在差异(P<0.05),见表2。
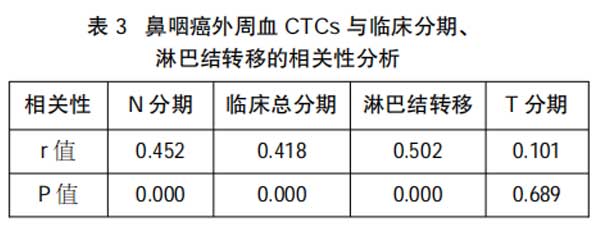
2.3鼻咽癌外周血CTCs与临床分期、淋巴结转移的相关性分析
经Spearman相关性分析可知,鼻咽癌外周血CTCs阳性率与与N分期、临床总分期及淋巴结转移呈正相关(P<0.05),而与T分期不相关(P>0.05),见表3。
讨 论
随着鼻咽癌患者病情进展,部分癌细胞可发生表型转化,由原来病灶播散到淋巴系统、血循环系统、骨髓系统中,但尚未形成病灶转移,仅发生肿瘤微转移,当微转灶随血液在靶器官血管壁附着时即发生远处转移,大大降低了患者存活率[8-9]。临床常规检查难以发现肿瘤病灶微转移,因此容易导致部分肿瘤细胞脱落原病灶并在特定条件下被激活而形成转移病灶[10]。肿瘤细胞从原病灶组织中脱落进入血液后,会受到自身凋亡、血流切变力、体内免疫力等作用,会导致大量癌细胞侵袭力减弱或凋亡,只有获得高侵袭性、高成瘤能力的癌细胞才具备远传转移的可能,这意味着CTCs具备了逃逸免疫监测及干细胞的生物学特性,由于鼻咽癌患者的肿瘤细胞基本都带有EB病毒基因组,EBERs被认为EB病毒潜伏感染的最好标志物[11-12]。通过微孔过滤装置将外周血中的CTCs从血细胞中分离并富集,后续应用原位杂交技术检测细胞内EBERs,可以准确鉴定出真正的鼻咽癌CTCs,确定鼻咽癌CTCs的形态特征[13]。
目前多项研究表明[14-15],外周血CTCs阳性与肿瘤分期有密切的关系,患者外周血中CTCs数量越多,患者面临肿瘤细胞远处转移的风险越大。本研究结果显示,鼻咽癌患者外周血CTCs阳性率为62%,100例慢性鼻炎患者外周血CTCs阳性率为0,表明CTCs是肿瘤患者特有的标志物。G Kallergi等[16]应用改良免疫磁珠富集联合免疫荧光细胞技术检测鼻咽癌患者外周CTCs,患者阳性率为82.9%,高于本研究结果,这可能与CTCs检测方法有关,本研究检测方法采用磁珠富集肿瘤细胞结合免疫荧光法及荧光原位杂交技术进行监测,不受肿瘤细胞上皮标志物表达影响,提高了CTCs检测准确性及灵敏性。鼻咽癌N分期是用于评价肿瘤区域淋巴结转移风险,分期越高提示区域淋巴结转移风险越高,原发肿瘤细胞经淋巴管进入血液的风险越大[17]。T分期是用于评价肿瘤侵犯黏膜层及邻近结构情况,分期越高提示局部复发风险越高,原发肿瘤细胞经血管进入血液的风险越大。临床总分期越高提示肿瘤侵袭性越高,患者治疗后局部及淋巴结残留风险越大,因此增加患者局部复发及远处转移风险[18]。预后差。本研究经Spearman相关性分析可知,鼻咽癌外周血CTCs阳性率与与N分期、临床总分期呈正相关(P<0.05),表明鼻咽癌患者外周血CTCs与N分期、临床分期有密切的关系。提示鼻咽癌患者外周血CTCs阳性者有更高的局部复发及远处转移风险。另本研究发现,鼻咽癌患者外周血CTCs与T分期无相关性(r=0.101,P>0.05),提示鼻咽癌患者外周血CTCs阳性对局部复发风险评估价值较低 [19-20]。
总之,鼻咽癌外周血CTCs与N分期、临床分期及淋巴结转移有一定的关系,可作为鼻咽癌局部复发及远处转移风险的辅助评价指标,相比较而言,其对远处转移风险评估价值较高。但肿瘤转移的发生是一个复杂的生理调控过程,肿瘤细胞进入血循环只是病灶转移发生的一部分, CTCs进入血液后需吸附在血管上并侵入靶器官组织,最后完成增殖才形成转移灶。因此对CTCs进行研究时,除了对CTCS进行定性外,还需要对CTCs进行定量研究,这是由于CTCs数量越多,最终存活的CTCs数量越多,最终发生远处转移的几率越高。而本研究仅对CTCs进行定性分析,缺乏定量分析,因此需在日后研究中还需要对研究进一步完善。
参考文献
[1]许青,于新发.血浆EB病毒-DNA检测在鼻咽癌中的应用[J].海南医学,2020,31(1):114-117.
[2]许德颖.不同疗法在鼻咽癌放疗后肺部转移中的应用效果对比[J].贵州医药,2020,44(1):38-40.
[3]毛燕娇,徐剑锋,尹伟.外周血循环肿瘤细胞在49例鼻咽癌中表达[J].肿瘤学杂志,2019,25(2):97-101.
[4]丁成.循环肿瘤细胞以及循环肿瘤DNA在孤立性肺结节患者诊断治疗中的应用研究[D].苏州大学,2019:.
[5]茆春国,邓波.肺癌循环肿瘤细胞侵袭转移机制的研究进展[J].中国肺癌杂志,2020,23(3):189-195.
[6]欧洋.胃癌患者外周血循环肿瘤细胞检测及临床意义的研究[D].济南大学,2019:
[7]金小虎,赵毅.循环肿瘤细胞在乳腺癌新辅助化疗疗效评估中的应用和展望[J].现代肿瘤医学,2020,28(4):655-659.
[8]王时梅,黄永塔,叶秋容,等.miR-584-5p对鼻咽癌远处转移及临床预后的预测作用[J].广东医学,2018,39(18):2746-2749.
[9]黄永塔,叶秋容,翁敬锦,等.miR-155-5p表达水平与鼻咽癌远处转移及预后的关系[J].中国临床新医学,2018,11(9):851-854.
[10]郑屹峰,黄小燕,沈建,等.3.0T MR-DWI在鼻咽癌颈部转移性淋巴结诊断中的应用[J].浙江医学,2016,38(11):892-893,901.
[11]Rumeal D,Whaley,Roman,et al.Lymphoepithelial Carcinoma of Salivary Gland EBV-association in Endemic versus Non-Endemic Patients: A Report of 16 Cases.[J].Head and neck pathology,2020,14(4):1001-1012.
[12]Nehla Mokni,Baizig,Ben Ayoub,et al.The Clinical Significance of IGF-1R and Relationship with Epstein-Barr Virus Markers: LMP1 and EBERs in Tunisian Patients with Nasopharyngeal Carcinoma.[J].The Annals of otology, rhinology,and laryngology,2020,129(10):1011-1019.
[13]Fredrik,Petersson.EBV-Associated Non-keratinizing Nasopharyngeal Carcinoma with Prominent Spindled Cell and Whorling Patterns: A Previously Unreported Histological Variant in a Patient Presenting with Dermatomyositis.[J].Head and neck pathology,2020,14(1):203-207.
[14]Ying Wang,Yanxia Liu,Lina Zhang,et al.Vimentin expression in circulating tumor cells (CTCs) associated with liver metastases predicts poor progression-free survival in patients with advanced lung cancer[J].J Cancer Res Clin Oncol,2019,145(12):2911-2920.
[15]Hossein Safarpour,Sadegh Dehghani,Rahim Nosrati,et al.Optical and electrochemical-based nano-aptasensing approaches for the detection of circulating tumor cells (CTCs)[J].Biosens Bioelectron,2020,15(2):78-80.
[16]G Kallergi,D Aggouraki,N Zacharopoulou,et al.Evaluation of α-tubulin, detyrosinated α-tubulin, and vimentin in CTCs: identification of the interaction between CTCs and blood cells through cytoskeletal elements[J].Breast Cancer Res,2018,20(1):67-68.
[17]吴君心,贺俊彦,杜开新,等.鼻咽癌患者外周血循环肿瘤细胞的检测及其与预后的相关性[J].现代肿瘤医学,2017,25(7):1035-1039.
[18]S Li,Q Chen, H Li,et al.Mesenchymal circulating tumor cells (CTCs) and OCT4 mRNA expression in CTCs for prognosis prediction in patients with non-small-cell lung cancer[J].Clin Transl Oncol, 2017,19(9):1147-1153.
[19]Masaki Hashimoto,Fumihiro Tanaka,Kazue Yoneda,et al.The clinical value of circulating tumour cells (CTCs) in patients undergoing pulmonary metastasectomy for metastatic colorectal cancer[J].J Thorac Dis,2018,10(3):1569-1577.
[20]Marta Vismara,Carolina Reduzzi,Maria Grazia Daidone,et al.Circulating Tumor Cells (CTCs) Heterogeneity in Metastatic Breast Cancer: Different Approaches for Different Needs[J].Adv Exp Med Biol,2020,1220(2):81-91.
第一作者:黄伟义 1975 男 硕士研究生 副主任医师,研究方向:头颈肿瘤放疗
hwygxwz@163.com 15277437121
通讯作者:梁锦辉 1970 男 硕士研究生 主任医师,研究方向:头颈肿瘤放疗 566jv@sina.cn
